# Appareils Biologie / Chimie
# Appareils de l'espace Biologie / Chimie
Retrouvez également la liste des principaux équipements [sur notre site internet](https://fablab.sorbonne-universite.fr/propos-du-fablab/les-espaces-et-equipements).
**Le Fablab Biologie Chimie se situe tour 43-44 au 2ème étage**
#### Imprimantes 3D résine
**2 imprimantes Elegoo Saturn**
- Description : Impression par photopolymérisation en cuve, technologie LED
- Volume maximal d'impression : 192 mm\* 120 mm\*200 mm
- Épaisseur minimum des couches : 10µm
- Épaisseur maximum des couches : 150µm
- Matières compatible : résine
- Logiciel : Chitubox
- Formats de fichiers requis : stl, obj
**1 imprimante Elegoo Mars 2**
- Description : Impression par photopolymérisation en cuve, technologie LED
- Volume maximal d'impression : .....
- Épaisseur minimum des couches : .... µm
- Épaisseur maximum des couches : ... µm
- Matières compatible : résine
- Logiciel : Chitubox
- Formats de fichiers requis : stl, obj
#### Autre équipements
| *Nom de la machine* | *Modèle* | *Fabricant* | *Quantité* |
| Agitateur 2D | KS 501 | IKA Labor Technik |
|
| Agitateur 2D vitesse variable | STD 1000 | VWR |
|
| Agitateur à balance | Rocking platform | VWR |
|
| Agitateur basculant 3D | SSL3 | Stuart |
|
| Agitateur magnétique avec ou sans potence | MR Hei-Mix S PVDF | Heidolph |
|
| Agitateur magnétique chauffant |
| IKA RCT |
|
| Agitateur rotatif chauffant | VMS-A | VWR |
|
| Autoclave | Vapour-line lite | VWR | 1 |
| Bain à sec pour micro-tubes | SBH 130B | Stuart |
|
| Bain marie Numérique TBW | LSCI TBW-06 | Cloup | 1 |
| Bain marie métallique petit volume (100°C) |
|
|
|
| Bain marie plexiglas 5L 65°C |
|
| 2 |
| Balance 0.001 | Practum | Sartorius |
|
| Balance 0.1g 210g max | EC211 | Acculab |
|
| Balance d'analyse max 320 g à 0,1 mg | ABS 320-4M | Kern |
|
| Balance de précision 0.001 (120g max) | LA124 | VWR |
|
| Balance de précision max 3200 g à 0,01g | PNS 3000-2 | Kern |
|
| Banc Kofler |
| Wagner & Munz |
|
| Bec électrique Hofmann avec régulateur |
|
|
|
| Bulleur d'aquarium |
| Superfish |
|
| Centrifugeuse de paillasse 8x 2/1,5ml | Frontier Mini FC5306 | Ohaus |
|
| Centrifugeuse pour micro-tubes de paillasse | MC12 | Benchmark |
|
| Centrifugeuse réfrigirée (micro tubes : 1,5 et 2 mL et falcon : 15 et 50 mL) | Sirena | Afi |
|
| Chauffage et pompe filtrante pour aquarium |
|
|
|
| Chauffe ballon (100/250mL) |
|
|
|
| Cloche à vide + tuyau |
|
|
|
| Conductimètre de paillasse avec capteur LE703 | FiveEasy F30-Standard kit | Mettler |
|
| Déshydrateur alimentaire |
| Gorenje |
|
| Dessicateur électronique | MB23 | OHAUS |
|
| Disperseur homogénéiseur | T 18 digital | Ultra-Turrax |
|
| Electrophorèse WesternBlot (cuve pour migration et transfert, système de coulage du gel…) |
|
|
|
| Etuve universelle ventilée 112 litres +300°C | XUE112 | France étuves |
|
| Four chaleur tournante |
| Severin |
|
| Générateur d'ozone |
|
|
|
| Sorbonne fixe |
|
|
|
| Hotte à flux laminaire | Optigel 12 | ADS Laminaire |
|
| Hotte chimique mobile + filtre | Captair | Erlab |
|
| Imageur (UV et lum. blanche) | 200 | Azure biosystems |
|
| Incubateur agitant | IncuShaker 10L | Benchmark |
|
| Incubateur agitant modulable | Unimax 1010/Incubateur 1000 | Heidolph |
|
| Incubateur fixe | Heratherm IGS60 | Thermo Scientific |
|
| Incubateur fixe | Incu-line | VWR |
|
| Incubateur réfrigéré à convection forcée 240 litres | BRE240 | Froilabo |
|
| Lampe à alcool |
|
|
|
| Machine à glace en paillettes | GB 902A | Brema |
|
| Marie jeanne avec bulleur |
|
|
|
| Micro-ondes 27L |
| Sharp |
|
| Microscope binoculaire | B-192PL 1000X | Optika |
|
| Oxygraphe complet (cellule, sonde à oxygène avec agitateur, table traçante) | L200E | Linseis |
|
| pH/mV/redox-mètre de paillasse | FiveEasy pH F20-Standard kit | Mettler |
|
| Phytotron | IPP 260+ | Memmert |
|
| Pompe à vide | N022AN | KNF |
|
| Pompe de recirculation pour aquarium | AT808 |
|
|
| Pompe filtrante pour bassin 440L/h | 2213 | Eheim |
|
| Roto-évaporateur |
| Heidolph |
|
| Roue à micro-tubes à vitesse fixe |
| VWR |
|
| Spectromètre FT-IR | Spectrum Two | PerkinElmer |
|
| Spectrophotomètre UV-visible | Libras 22 | Biochrome |
|
| Spectrophotomètre UV-visible à balayage spectral | 7615 Blanc | Jenway |
|
| Stérilisateur UV | CHS208A |
|
|
| Système de filtration Résine pour production d'eau distillée | E200 | Veolia |
|
| Table chauffante céramique diam. 28 cm |
| Kalorik |
|
| Table UV | TFP 20M | Bio Bloc Scientific |
|
| Thermocyleur affichage numérique | XT96 | VWR |
|
| Thermo-hygromètre digital programmable | 0172 SI | IHM |
|
| Vortex à vitesse variable |
| Stuart |
|
| Warburg (incomplet) |
| B. Braun |
|
| Osmoseur (pour purifier et démineraliser l'eau)
| OmniaPure XS Touch UV-TOC | Stakpure
|
|
Catalogue des équipements de l'espace biologie-chimie et leur usages dans diverses disciplines : [file:///C:/Users/fablabuser/Downloads/Appareillage%20FabLab%20-%20Appareillage\_FabLab-5.pdf](file:///C:/Users/fablabuser/Downloads/Appareillage%20FabLab%20-%20Appareillage_FabLab-5.pdf)
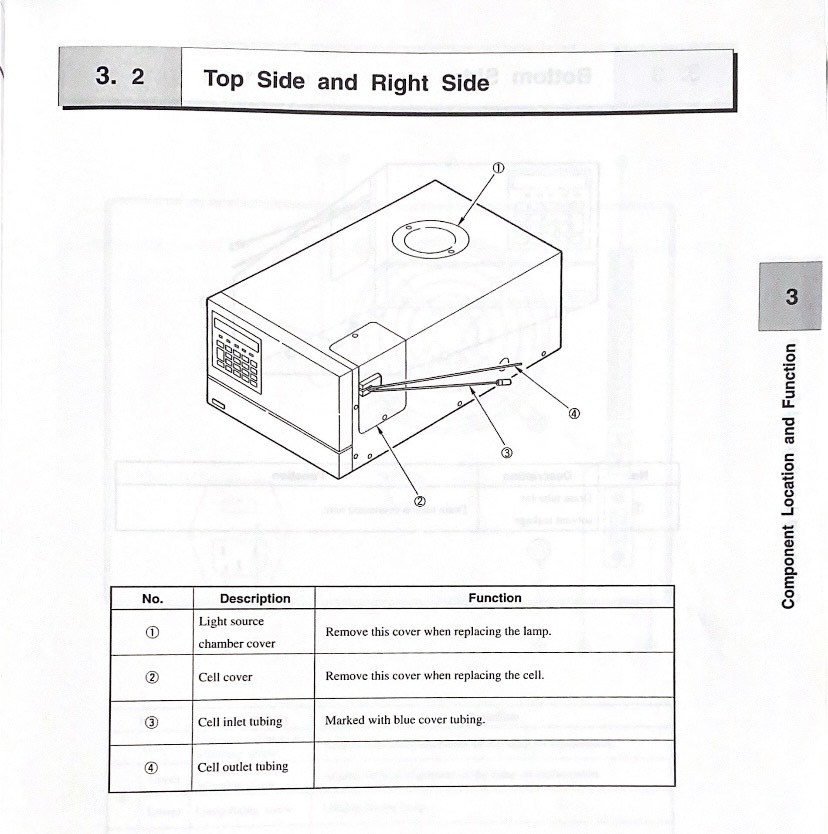
# Beckman System Gold High Performance Liquid Chromatograph
# System Gold™ 126 168 HPLC instrument
### **Qu'est-ce que l'HPLC :**
L'HPLC (High Performance Liquid Chromatography) est une technique de séparation analytique de molécules présentes dans un échantillon, ce qui permet leur analyse qualitative et quantitative. Dans cette technique, une phase mobile (éluant) et une phase stationnaire (colonne) permettent la séparation des molécules d'un échantillon en fonction de différents critères. Elle est utilisée par de nombreuses industries, comme la pharmacie et la bio-pharmacie, l'alimentation, la cosmétique...
En fonction de la colonne et de l'éluant choisi pour l'analyse, le type de chromatographie peut différer. Voici certains des différents types de chromatographies que nous pouvons réaliser :
- Chromatographie d'adsorption
- Chromatographie de partage (la plus utilisée):
- En phase normale. Les phases mobile et stationnaire sont polaires
- En phase inversée. La phase stationnaire est apolaire mais la phase mobile reste polaire
- Chromatographie par échange d'ions
- Chromatographie d'exclusion stérique (en fonction de la taille des molécules)
Il est important de se renseigner sur la compatibilité des solvants avec les colonnes avant de commencer une manipulation. Il est également nécessaires d'utiliser les bons éluants et colonnes en fonction des espèces pouvant être présentes dans un échantillon.
### **Description générale**
Le chromatographe HPLC que nous utilisons (Beckman Coulter System Gold) est une chaine composé de plusieurs sous blocs, chacun ayant une fonction qui lui est propre.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/th-beckmn-gold-125-166.jpg)*System GOLD HPLC*
##### 1) Pompe ou "Solvent Module" :
Le rôle de cette pompe est d'envoyer l'éluant (ou les éluants) sélectionné(s) à travers la chaine de chromatographie. Le modèle que nous utilisons est le "Solvent Module 126". Il permet un mélange de plusieurs solvants, afin d'éviter à avoir à préparer nous même des mélanges au préalable.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/system-gold-126-solvent-module-1.JPG)*Pompe "Solvent Module 126"*
Les flacons de solvant sont placés en haut de la colonne et sont reliés à des pompes A et B, qui permettent un mélange des solvants avec les rapports qui nous intéressent. Le flux débité par la pompe est ensuite envoyé directement vers le deuxième bloc du système HPLC, c'est-à-dire l’échantillonneur automatique (Autosampler). Tous les paramètres permettant de contrôler la pompe (débit, pressions minimale et maximale, choix des solvants pour les pompes A et B, rapport A:B) sont modifiés depuis l’ordinateur.
Si on ne veut pas envoyer notre éluant vers le reste du systeme HPLC (échantilloneur et détecteur), il suffit d'ouvrir la valve d'évacuation ("Drain Valve") : elle enverra tous l'éluant dans une bouteille "déchet".
##### 2) Échantillonneur automatique ou "Autosampler 507e"
L’échantillonneur est détecté en tant que "Autosampler 507e" par le logiciel 32 Karat, même s'il se nomme en réalité "Autosampler 508".
Le rôle de l'échantillonneur et de prélever automatiquement les différents échantillons préparés et placés au préalable dans des flacons situés sur une plaque tournante. Chaque emplacement est numéroté, et à chaque nouveau programme, l'échantillonneur commencera son prélèvement au premier flacon. Les flacons utilisés sont de petites tailles et sont tous dotés d'un bouchon spécial doté d'un septum, ce qui permet à l’échantillonneur de le percer avec une aiguille.

*Echantillonneur "Autosampler 507e"*
L'échantillonneur est aussi doté d'une bouteille qui permet le rinçage de la seringue entre chaque injection : elle peut être remplie avec du méthanol ou un mélange d'eau et isopropanol. Elle est ensuite accrochée à la machine, tout en faisant passer le tube de nettoyage par l'ouverture se trouvant sur le bouchon.
Afin d'envoyer notre échantillon vers la colonne et vers le détecteur, l'Autosampler est doté d'un système spécial INJECT/LOAD, ce qui permet d'envoyer une petite quantité d'échantillon vers la colonne : tant que l'échantillon n'est pas envoyé vers la colonne, il est éliminé ou bien il reste à l'intérieur du système INJECT/LOAD, jusqu'à ce qu'il soit envoyé vers la colonne.
##### 3) Colonnes
La colonne est directement rattachée au système INJECT/LOAD de l'échantillonneur et au détecteur. C'est elle qui permet la séparation des différentes molécules d'un échantillon, dont la présence sera ensuite confirmée par le détecteur. Il en existe différents types, chacune ayant des caractéristiques qui lui sont propres, et plus ou moins adaptés à certaines molécules et éluants.
La colonne est directement rattachée à la sortie 6 de l'échantillonneur, grâce à un tube en plastique fin, et est relié de la même manière au détecteur, vers une entrée qui consiste en un fin tube en métal. La colonne est vissée aux entrée et sortie afin d'éviter toute suite possible en dehors du système.
##### 4) Détecteur ou "Detector
Le détecteur (Detector 168) se situe à la fin de la chaine, et il permet de savoir à quel moment une molécule de l'échantillon sort de la colonne. Ce modèle de détecteur fonctionne à l'aide d'une lampa PDA, qui permet une analyse en 3 dimension de notre échantillon (temps, longueur d'onde et absorbance), ce qui permet de limiter le nombre de répétitions de manipulation, contrairement à une analyse UV-vis en 2 dimension, dans laquelle nous sommes limités à une longueur d'onde bien spécifique. Même si cette méthode est simple à utiliser, elle est limitée aux molécules qui absorbe les longueurs d'onde de l'UV ou du visible (complexes métalliques colorés, molécules organiques conjugués, cycles aromatiques...); pour notre détecteur, il s'agit des longueurs d'onde situées entre 190nm et 600nm. C'est pour cela qu'il est préférable d'utiliser comme éluant des composés n'absorbant pas en UV (eau, éthanol...).
Une fois que l'éluant passe à travers la colonne puis le détecteur, il est rejeté par en sortie par un "Back Pressure Regulator", afin d’empêcher à l'éluant de sortir avec une pression trop importante à la fin du circuit.
### **Contrôle depuis l'ordinateur**
Tous les différents blocs de la chaine HPLC peuvent être contrôlés depuis l'ordinateur.
##### Ouverture de la chaine
Aucune connaissance informatique n'est requise. L'ordinateur n'a pas de mot de passe.
Avant toute chose, il faut s'assurer que tous les éléments de la chaine soient allumé. Leurs interrupteurs sont tous placés à l'arrière de chaque bloc (il faut allumer séparément les différents constituants du système HPLC).
Une fois sur le bureau de l’ordinateur, il suffit d'ouvrir le logiciel "32 Karat Software". Une fois lancé, il faut cliquer sur "Chaine fonctionnelle", qui correspond à la chaine qui nous intéresse (le chargement pour l'ouverture de la chaine peut-être long).
##### Contrôle de l'HPLC à l'aide de Direct Control :
Une fois la chaine ouverte, on peut à présent ouvrir "Direct Control". Pour se faire, il faut cliquer sur "Control" puis sélectionner "Direct Control" dans le menu défilant. A ce moment, une nouvelle fenêtre apparait. Elle permet le contrôle direct de différents réglages sur la pompe, l’échantillonneur et le détecteur.
- La pompe : il est possible de régler le débit de la pompe en appuyant sur Flow Rate, puis en entrant la valeur de débit qui nous intéresse, allant jusqu'à 10 mL/min, et en cochant la checkbox "Flow On". Une fois prêt à lancer la pompe, il suffit d'appuyer sur OK. Si on veut arrêter la pompe, il faut à nouveau cliquer sur Flow Rate, puis décocher la checkbox "Flow ON", et appuyer sur OK. Pour réaliser des mélanges de solvants (A + B), il fut cliquer sur %B, puis choisir le ratio en pourcentage de A et de B en rentrant une valeur pour B, et confirmer notre choix en appuyant sur OK. Il est possible de choisir lequel des 4 solvants possibles les pompes A ou B vont utiliser en cliquant sur les flèches colorés afin qu'elles indiquent la couleur/le chiffre qui nous intéresse pour cette pompe. Enfin, on peut sélectionner les pressions minimales et maximales pour les pompes A et B en cliquant sur les icones de pompes correspondant à A ou à B, puis en choisissant les valeurs qui nous intéressent en kPSI ou en MPa ; on peut confirmer notre choix en cliquant OK.
- Le détecteur : on peut allumer la lampe en cliquant sur l’icône ressemblant à une lampe et en sélectionnant ON ou OFF. On peut également la calibrer en appuyant sur "Calibrate", puis en cliquant sur ON; il est également possible de choisir les longueurs d'onde de travail qui nous intéresse, en sélectionnant "Ch1"/"Ch2", puis en entrant les valeurs voulues.
Créer sa propre méthode
Le logiciel 32 Karat nous permet d'automatiser le processus d’échantillonnage en créant nos propres méthodes. Pour se faire, il faut se rendre dans le menu déroulant "Files", puis sélectionner "Method" et "New", ce qui ouvrira une nouvelle fenetre. Depuis cette fenetre, on peut influencer certains paramètres sur la pompe, le détecteur ou encore l'échantillonneur, et meme programmer des temps pour notre méthode.
Dans l'onglet Pumps, on peut configurer le contenu de chaque solvant (A1, A2, B1...), influencer le débit et sa durée, changer les valeurs de pression minimale ainsi que maximale et les mélanges en pourcentage entre A et B.
Dans l'onglet Detector, on peut choisir la plage de longueur d'onde sur laquelle les mesures seront réalisées, ainsi que l'intervalle de scan (2nm par défaut) si l'on veut réaliser des mesures de données en 3D. Si l'on veut réaliser une analyse 2D (intensité + temps), il suffit de décocher la checkbox 3D Data, puis de régler les paramètres dans la partie Channel Definition.
Dans l'onglet Injector, on peut régler l’échantillonneur afin qu'il nettoie l'aiguille entre chaque injection, qu'il permette ou non le uL Pickup, ou qu'il réalise le Tray Cooling, qui permet de garder les échantillon à des certaines températures (on peut également influencer d'autres paramètres, comme le volume de nettoyage "Wash Volume").
L'onglet Time Program nous permet de programmer directement en fonction du temps les actions que les différents blocs de l'HPLC devront réaliser à travers le temps.
Reglages de la pompe :
Une pompe mal réglée peut amener des bulles d'air dans le système, ce qui risque de fausser nos résultats ; c'est pour cela qu'il est primordial de la régler correctement.
\- Ouvrir la valve de drain en tournant le robinet dans le sens inverse des aiguilles d'une montre.
\- Insérer une seringue dans le port qui nous intéresse (A ou B), tourner l puis retirer le conten
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/c3gimage.png)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/heSimage.png)
**A) LES UNITÉS**
**1. L'ordinateur : application 32 KARAT SOFTWARE
**
NB : Aucune connaissance informatique n'est requise. L'ordinateur n'a pas de mot de passe.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/ordinateur-hplc.jpg)
Le logiciel Gold, apporte 3 niveaux d'interaction et de contrôle à la chromatographie haute performance.
1. **Gestionnaire pour 1 ou 2 systèmes HPLC**, repérés SYSTEM1 ( carte PCI1 ) et SYSTEM2 ( carte PCI2 ) , chaque système pouvant contenir jusqu'à 8 modules (pompes, détecteurs, interfaces etc...). Chaque système peut acquérir le résultat à deux longueurs d'onde), ces deux voies étant appelées CHANNEL A et CHANNEL B. En contrôle direct (direct control), ou en automatique au travers de méthodes (edit method), l'ordinateur coordonne le fonctionnement de chacun des modules HPLC. Bien qu'il soit prévu pour un fonctionnement avec des éléments BECKMAN, il peut être connecté à d'autres éléments au travers d'une interface (modèle 405) permettant des contrôles par des contacts de relais et/ou le traitement du signal d'un détecteur.
2. **Collecte les chromatogrammes des analyses effectuées**, les analyse, les transcrit en un rapport final, et/ou les stock, permettant ainsi un retraitement ultérieur. La calibration et les résultats des échantillons analysées sont réalisés facilement, le rapport final apparaît dans le format et avec les informations qui sont le plus appropriées.
3. **Retrait des résultats** (outil très puissant). Chaque donnée étant stockée en mémoire (sur disque dur ou sur disquette), il permet de réanalyser tout échantillon désiré pour corriger des erreurs ou déterminer l'effet de calibrations différentes. La puissance des analyses chromatographiques et des fonctions de balayage en longueurs d'onde permet une étude approfondie des résultats obtenus, non possible jusqu'à présent.
**3. Spectrofluorometric detector : RF-10 Axl**
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/devant-spectrofluorometre.jpg)
Spectrofluoromètre de face
| [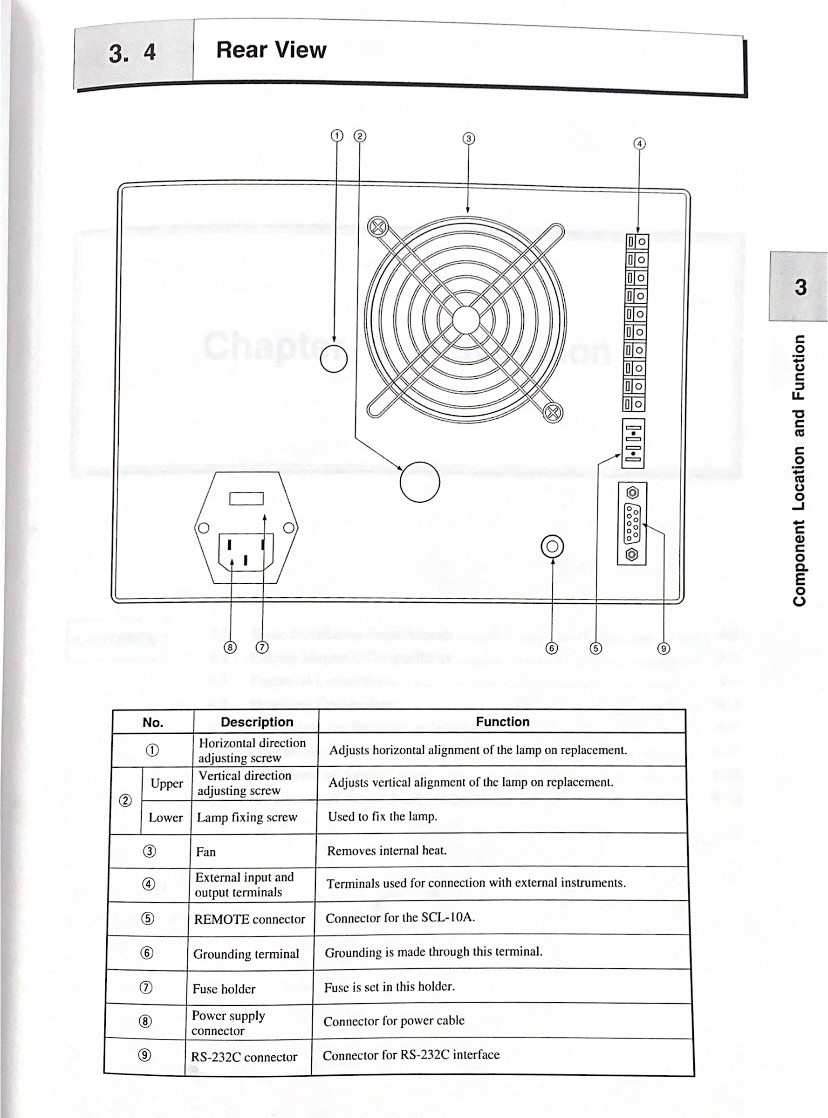](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/8vRarriere-spectrofluorometre.jpg)
Arrière spectrofluoromètre
|
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/rSLcotes-droit-et-gauche-spectrofluorometre.jpg)
Côtés spectrofluoromètre
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/cote-spectrofluorometre.jpg)
Dessous spectrofluoromètre
|
**Liens**
1. Manuel HPLC+software [https://www.artisantg.com/info/Beckman\_Coulter\_Model\_166\_Manual.pdf](https://www.artisantg.com/info/Beckman_Coulter_Model_166_Manual.pdf) dispo en papier
2. Manuel Foxy 200 [https://archive-resources.coleparmer.com/Manual\_pdfs/01471-xx.pdf](https://archive-resources.coleparmer.com/Manual_pdfs/01471-xx.pdf) dispo en papier
3. Manuel Sedex Model 80 [https://www.knauer.net/Dokumente/detectors/third\_party/manuals/sedere\_elsd\_80\_manual\_\_rev3.0\_\_release.pdf](https://www.knauer.net/Dokumente/detectors/third_party/manuals/sedere_elsd_80_manual__rev3.0__release.pdf) dispo en papier
Autre manuel papier dispo :
1. Installation & Maintenance Guide HPLC
2. P/ACE MDQ Basic Training Workbook
Un forum de FAQ [https://www.labwrench.com/forums/equipment/155/beckman-coulter-system-gold](https://www.labwrench.com/forums/equipment/155/beckman-coulter-system-gold)
# Guide d'utilisation du système HPLC
# I / Mise en marche du système :
Pour mettre en marche la chaîne HPLC, il faut d’abord allumer chaque module. Un interrupteur d’alimentation est présent à l’arrière du détecteur, de la pompe et de l’autosampler. Une fois les trois modules mis en marche, il faut démarrer le PC et appuyer sur « ok » sans insérer de mot de passe sur la page de connexion à la session.
# II / Préparation de l’échantillon et de l’appareil :
La configuration du système HPLC présent au Fablab comprend : une pompe Solvent Module 126, essentielle pour faire circuler la phase mobile à travers la colonne sous haute pression, généralement entre 1000 et 5000 psi ; un injecteur automatique Autosampler 508, qui introduit l'échantillon dans le flux de phase mobile de façon automatique, reproductible et précise ; une colonne C18 en phase inverse de 20 cm de la gamme Gemini de Phenomenex, contenant la phase stationnaire en silice, qui est l'élément central où se produit la séparation des composants de l'échantillon ; une phase mobile comprenant de l'eau (solvant A) et de l'acétonitrile (solvant B), stockés dans deux bouteilles distinctes, permettant d'optimiser la séparation des composés; un détecteur DAD (Diode Array Detector) Detector 168, qui permet de mesurer l'absorbance de l'échantillon sur une large gamme de longueurs d'onde simultanément ; un système d’acquisition de donnés opérant sous Windows 2000 qui permet d’enregistrer et d’analyser les signaux du détecteur via le logiciel 32 Karat.

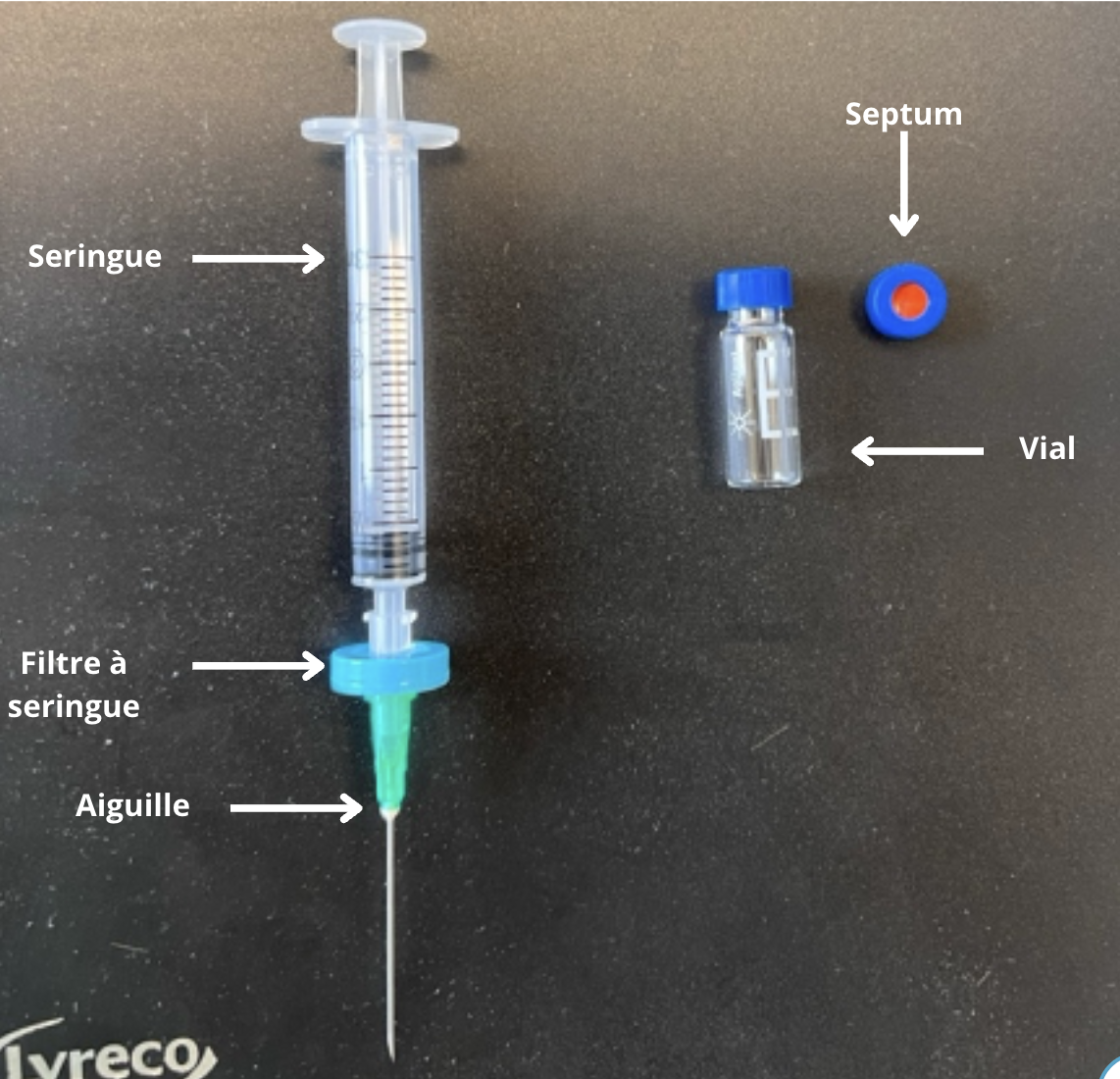
Pour pouvoir analyser un échantillon avec un injecteur automatique, il faut un matériel spécifique. Nous devons utiliser des vials, qui sont des petits tubes en verre d’un volume de 2 ml, pour pouvoir stocker l’échantillon à analyser. Un bouchon en caoutchouc, appelé septum, viens recouvrir le vial. Le septum est conçu pour être percé par l'aiguille de l'autosampler de l'HPLC, permettant ainsi l'introduction de l'échantillon dans le système sans exposer le contenu du vial à l'air extérieur. Ce vial est ensuite placé dans les compartiments de l’autosampler afin d’être analysé.
Si votre solution à analyser n’est pas préalablement filtrée, il ne faut pas oublier d’utiliser les aiguilles et les filtres à seringues de 0,45 µm avant l’introduction de l’échantillon dans le vial.
Avant de commencer une analyse, il est essentiel de vérifier qu'il n'y a pas de bulles d'air dans la tuyauterie des pompes A et B au risque d’endommager la colonne et les pompes. S’il y a présences de bulles d’air, veuillez-vous référez à la partie Maintenance de l’appareil en fin de notice afin d’effectuer l’amorçage des pompes.
Attention, Il est crucial d'adapter la phase mobile en fonction des caractéristiques spécifiques de l'échantillon à analyser pour obtenir des résultats précis et reproductibles en HPLC.
- Échantillons Acides ou Basique : Pour les échantillons qui présentent des propriétés acides ou basiques, il est souvent nécessaire d'utiliser des solutions tampons dans la phase mobile. Les tampons maintiennent un pH constant, ce qui est essentiel pour stabiliser la rétention et la séparation des analytes sensibles au pH. Par exemple, un tampon phosphate peut être utilisé pour des échantillons à pH neutre à légèrement basique, tandis qu'un tampon acétate peut convenir pour des échantillons légèrement acides.
- Analytes Neutres : Pour les analytes neutres, un simple mélange de solvants organiques comme l'eau/acétonitrile ou eau/méthanol peut suffire.
Lorsque des solutions tampons sont utilisées dans la phase mobile, il est impératif de rincer la colonne après chaque utilisation. Les tampons peuvent précipiter et s'accumuler dans la colonne, entraînant des obstructions, une perte de performance de la colonne et des problèmes de reproductibilité.
# III / Configuration via le logiciel 32 Karat :
Attention, la partie suivante suppose que tous les matériels ont été installés et allumés.
Le système HPLC fonctionne sous le logiciel 32 Karat Software. Il est possible de le lancer en cliquant directement sur son icône depuis le bureau. Ce logiciel permet d’acquérir les données provenant du détecteur mais également de configurer certains paramètres avant l’analyse d’échantillons, notamment le pourcentage eau/acétonitrile, le débit d’élution, le temps d’analyses, etc.
Une fois le logiciel lancé, une fenêtre avec les instruments configurés apparaît. Le terme instrument fait référence au système HPLC connecté à l’ordinateur. Le fait de configurer un instrument permet donc de choisir le système sur lequel on souhaite travailler. La chaîne HPLC présente au Fablab a déjà été configurée et est reconnu par l’instrument Chaine\_fonctionnelle. Il faut donc cliquer sur cet instrument.
Lorsque l’on accède à l’instrument, une petite fenêtre Instrument Wizard apparaît, on peut la fermer. On tombe ensuite sur le chromatogramme du précédent test réalisé avec cet instrument, il ne faut pas en tenir compte.
1. ## Direct Control
Afin de pouvoir contrôler le système HPLC depuis le logiciel, il faut accéder au panneau de contrôle Direct Control. Pour cela, il faut cliquer sur l’onglet Control puis sélectionner Direct Control dans le menu défilant.
L’interface Direct Control permet de sélectionner et de modifier immédiatement les paramètres de fonctionnement du système HPLC. L'écran Direct Control est utilisé pour contrôler l'instrument en cliquant avec la souris sur les zones interactives de la fenêtre. Ces zones activent soit la boîte de dialogue associée, permettant de modifier les paramètres de l'instrument, soit la tâche correspondante directement. L'écran Direct Control affiche également des messages de service indiquant l'activité actuelle de l'instrument et son état en temps réel.
On observe trois sous fenêtre dans l’interface de contrôle, chacune permettant de contrôler un module du système.
[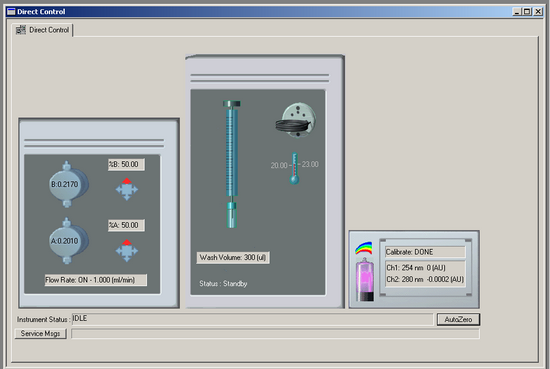](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/2A0image.png)
La sous fenêtre à gauche permet de contrôler les pompes et la phase mobile. On peut y définir le pourcentage d’eau et de solvent dans la phase mobile à l’état initial. Pour cela, il faut cliquer sur %B et régler le pourcentage de solvant (pompe B) que l’on souhaite depuis la boîte de dialogue qui apparaît. Le pourcentage d’eau (pompe A) se réglera automatiquement en fonction de ce que l’on met pour %B. On peut également choisir la valve de sélection du solvant en cliquant sur l’une des 4 flèches en dessous de %B et %A. Cela permet de choisir le chemin de tuyauterie que dois emprunter le solvant depuis la bouteille pour rejoindre les pompes. Par exemple, si c’est le tuyau B1 que l’on utilise dans la bouteille de solvant B, il faudra régler la valve de sélection sur la position 1 (flèche pointant vers le haut). La tuyauterie utilisée sur ce système correspond normalement aux tuyaux A1 et B1, les valves de sélection sont normalement déjà réglées sur ces positions, il n’y a donc pas besoin de modifier ce paramètre. Ensuite, il est possible de régler le débit d’élution de la phase mobile. Pour cela, il faut cliquer sur Flow Rate, cocher la case Flow ON si ce n’est pas déjà fait et indiquer le débit sous lequel on souhaite travailler en face de Flow rate. Généralement, on travaille à 1 ml/min.
Attention, il faut faire attention à ne JAMAIS dépasser 2 ml/min, par risque d’endommager considérablement les pompes, la tuyauterie et la colonne.
Enfin, il est possible de vérifier la pression des pompes et de régler les pressions minimales ou maximales en cliquant directement sur l’icône de chaque pompe.
La sous fenêtre au milieu permet de contrôler l’autosampler. Il est possible de nettoyer l’aiguille de l’autosampler en appuyant sur la grande icône d’aiguille. Cela permet de nettoyer l’aiguille avec l’isopropanol contenu dans la bouteille de lavage fixé sur l’autosampler. Il est recommandé de nettoyer l’aiguille lorsque l’on change d’échantillon. Le volume de nettoyage doit être trois fois supérieur au volume de la boucle (300 µl pour une boucle de 100 µl). Cela permet de s'assurer que tout résidu de l'échantillon précédent est complètement éliminé. Si plusieurs prélèvements sont effectués dans le même échantillon, il n’y a pas besoin de nettoyer l’aiguille entre les tests. Il est également possible d’activer l’option Tray Cooling en cliquant sur l’icône de thermomètre, si l’on souhaite régler une température spécifique pour le plateau de l’autosampler.
La petite sous-fenêtre à droite correspond au détecteur. L’option Calibrate, permet d’initier la procédure de calibration du détecteur. Pour cela, il faut cliquer sur Calibrate et cocher la case ON dans la boîte de dialogue apparaissant. En cliquant sur l’icône de la lampe, on peut allumer ou éteindre la lampe UV du détecteur. Si l’icône est rose, cela signifie que la lampe est allumée. Le détecteur 168 est un détecteur à barrette de diodes (DAD), cela signifie que l’on peut se placer sur deux longueurs d’ondes distinctes simultanément, contrairement à un détecteur UV classique. En cliquant sur Ch1 en dessous de l’option de calibration, une boite de dialogue apparaît. Le detecteur 168 possède deux channel. On peut définir la longueur d’onde de notre choix pour chaque channel en face de Wavelength ainsi que la bande passante en face de Bandwith. L’appareil est initialement réglé sur 254 nm et 280 nm mais cela peut être ajusté en fonction de vos échantillons. Enfin, en dessous de la sous-fenêtre du détecteur se trouve un bouton AutoZero. Cela permet d’ajuster le détecteur à zéro, ce qui est nécessaire avant chaque analyse.
Suivez ces étapes à chaque lancement du logiciel :
Préparation initiale
- Depuis le panneau de contrôle, commencez par effectuer le zéro du détecteur en cliquant sur le bouton AutoZero.
- Ensuite, réalisez la calibration en cochant la case ON dans la boîte de dialogue correspondante. Attendez que le message DONE apparaisse en face de Calibrate.
Réglage des paramètres
- Réglez le pourcentage eau/acétonitrile que vous souhaitez utiliser.
- Activez le débit d’élution et réglez-le sur 1 ml/min. Attention, ne JAMAIS dépasser 2 ml/min.
- Attendez que la pression des pompes A et B se stabilise, c’est-à-dire jusqu’à ce que la pression des deux pompes ne varie plus ou très peu.
Nettoyage de l’aiguille
- Si c’est votre première analyse ou si vous changez d’échantillon, nettoyez l’aiguille en cliquant sur la grande icône d’aiguille.
Vérification finale
- Assurez-vous que l’autozero et la calibration sont effectués, que le débit d’élution et le pourcentage de solvant sont réglés, que la pression des pompes est stable et que l’aiguille est propre.
Une fois ces étapes réalisées, le système HPLC sera bien préparé mais pas encore prêt à analyser l’échantillon. Il est crucial de rappeler que le panneau de contrôle permet de régler votre système en temps réel, mais ces paramètres peuvent changer lors d’une analyse si une méthode précise a été définie. Avant de lancer une analyse, il est donc essentiel de savoir créer et paramétrer une méthode appropriée.
2. ## Créer une méthode :
Le fait de créer une méthode va permettre d’attribuer à chaque module les paramètres qu’ils devront utiliser une fois l’analyse lancé mais également de définir le temps d’analyse total. Il est possible de créer plusieurs méthodes et de les enregistrer. Cela va donc permettre d’automatiser le processus d’échantillonnage.
Pour créer une méthode, il faut se rendre dans l’onglet Files / Method / New, ce qui ouvrira une nouvelle fenêtre appelée Instrument Setup. Il faut maintenant régler les paramètres de chaque module qui seront utilisés lors de l’analyse.
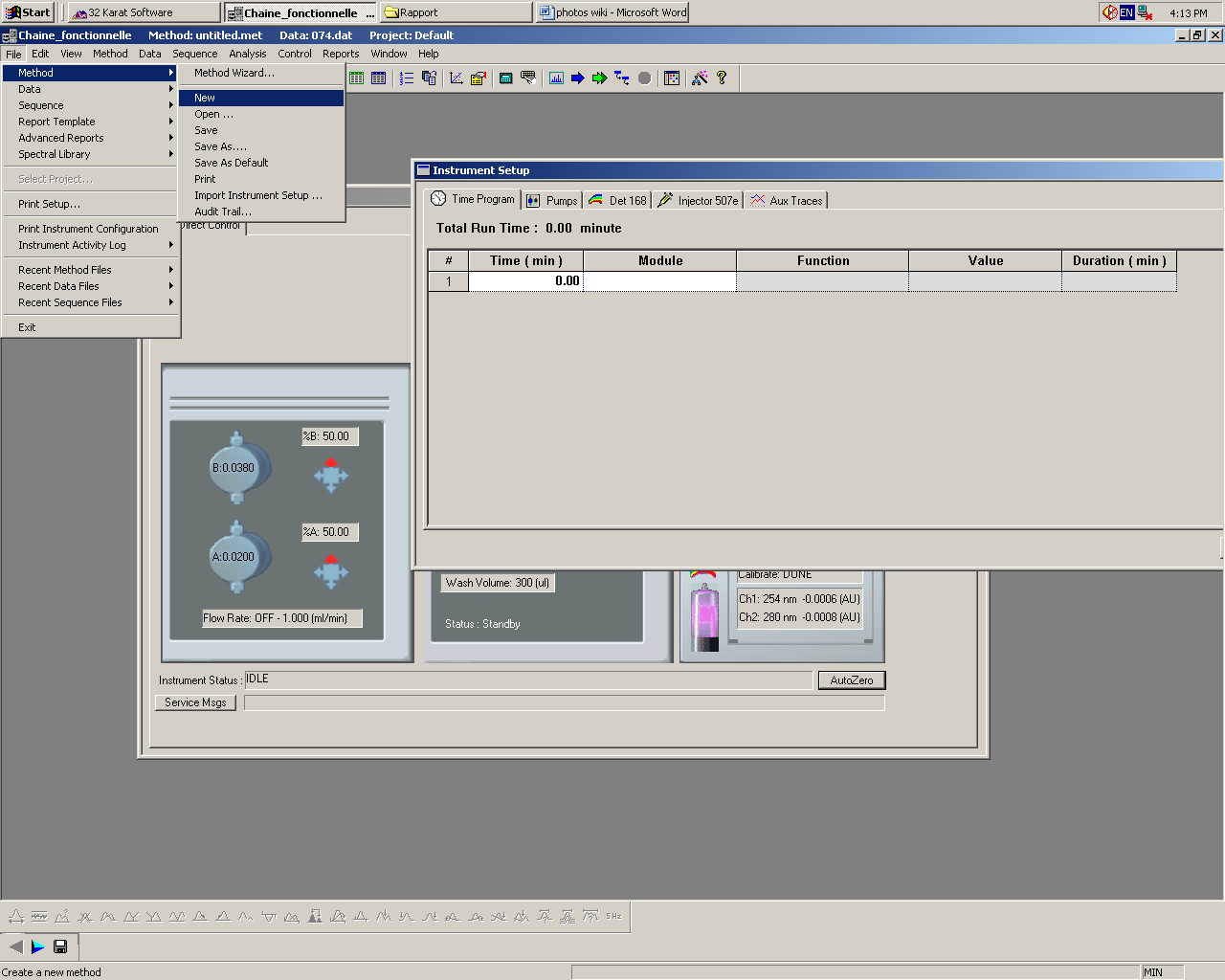
Attention, les paramètres réglés dans Instrument Setup ne seront appliqués que lorsqu’une analyse sera lancée. Si vous souhaitez changer un des paramètres pour une autre analyse (ex : %B), il faut absolument rouvrir Instrument Setup et effectuer vos changements. Le fait de modifier les paramètres depuis le panneau Direct Control n’aura aucun impact lorsque vous relancerez une analyse.
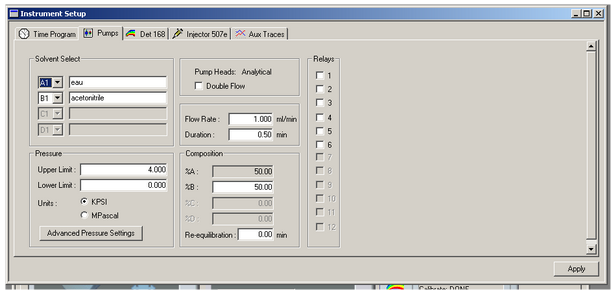
Après avoir cliqué sur l’onglet Pumps, commencez par régler le débit d’élution en entrant 1 ml/mn en face de Flow Rate et 0.50 min en face de Duration. Vous pouvez nommer vos solvant dans les champs d’écriture à côté de A1 et B1. Réglez ensuite le pourcentage de solvant en face de %B (idéalement 50%) ainsi que la pression maximale sur 4.000 KPSI.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/fDuimage.png)
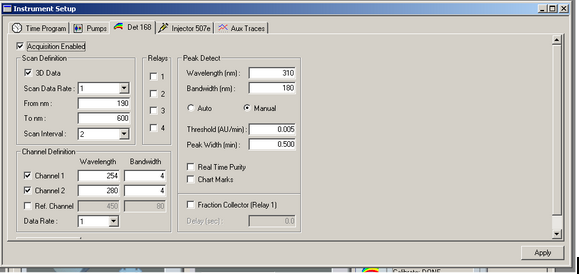
Dans l’onglet Det 168, cochez l’option Acquisition Enabled et 3D Data si ce n’est pas déjà fait. Cochez également Channel 1 et Channel 2 et définissez les longueurs d’ondes sur lesquels vous souhaitez travailler. Ne pas toucher aux autres paramètres.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/JTYimage.png)
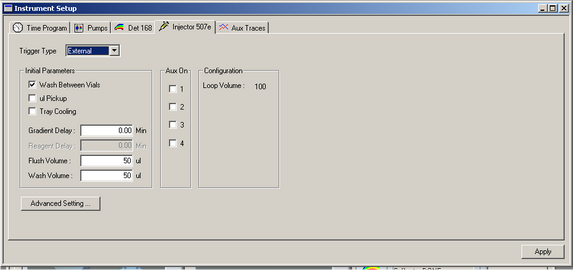
Dans l’onglet Injector 507e, cochez l’option Wash Between Vials et sélectionnez External en face de Trigger Type.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/cfkimage.png)
Une fois les réglages des modules effectués, nous allons pouvoir régler le mode et le temps d’analyse dans l’onglet Time Program.
Avant d’aborder une analyse, il faut savoir si vous souhaitez travailler en mode isocratique ou en mode gradient. Le mode isocratique utilise une composition de phase mobile constante tout au long de l’analyse. Cela signifie que le ratio des solvants reste inchangé, ce qui simplifie la méthode et peut être suffisant pour des échantillons simples où les composés ont des propriétés similaires. En revanche, le mode gradient implique une variation progressive de la composition de la phase mobile au cours de l’analyse. Cette variation peut être linéaire ou non-linéaire et est utilisée pour améliorer la séparation des composés dans des mélanges complexes. Le mode gradient est particulièrement utile pour les échantillons contenant des analytes avec des polarités très différentes ou des temps de rétention variés, permettant ainsi d'obtenir une meilleure résolution et des temps d’analyse plus courts.
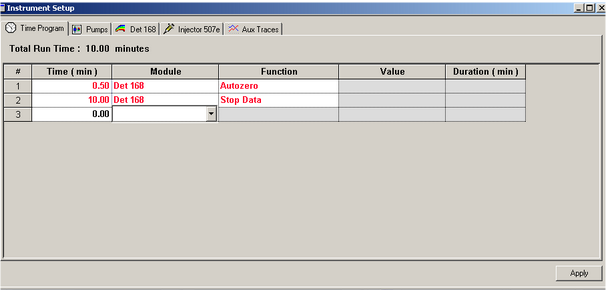
1. ### Réglages mode isocratique
Pour une analyse en mode isocratique, vous aurez juste à paramétrer le moment d’arrêt de l’analyse ainsi que l’autozero. Dans Time, il faut entrer 0,50 min, dans Module sélectionner DET 168 et dans Function sélectionner Autozero. Il faut ensuite sélectionner la deuxième ligne et entrer le temps d’analyse total souhaité (par exemple 10.00 min) dans Time, sélectionner le même détecteur et choisir Stop Data dans Function.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/QnUimage.png)
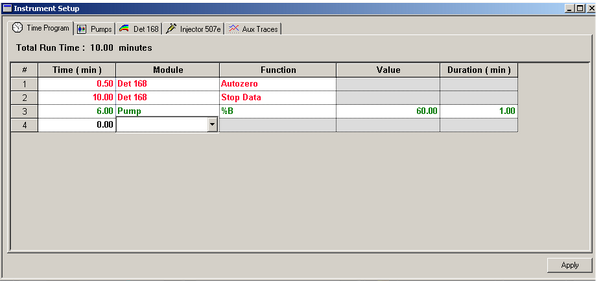
2. ### Réglages mode gradient
Pour une analyse en mode gradient, il faut d’abord appliquer les paramètres du mode isocratique. Afin de faire varier la composition de la phase mobile au bout d’un certain moment, il faut sélectionner Pump dans les modules, choisir %B dans les fonctions, définir le pourcentage souhaité dans Value et le temps durant lequel ce pourcentage sera appliqué dans Duration. Il faut également définir le moment où cette variation va avoir lieu dans Time.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/ZZqimage.png)
Il ne faut pas oublier d’enregistrer sa méthode pour pouvoir la réutiliser une prochaine fois. Pour cela, il faut sélectionner File/Method/Save as.
Une fois la méthode crée, il est possible de passer à l’analyse de notre échantillon.
3. ## Lancer une analyse :
Avec le système HPLC du Fablab, il est possible de choisir entre deux modes d’analyse en fonction de vos besoins expérimentaux. Après avoir placé votre échantillon à analyser dans l’autosampler, vous pouvez opter pour une analyse unique, où un seul échantillon est injecté dans le système, permettant ainsi une évaluation précise et individuelle de cet échantillon. Alternativement, vous avez la possibilité de lancer une séquence d'analyses, où plusieurs échantillons sont injectés successivement. Cette approche est particulièrement avantageuse pour les études comparatives ou les séries d'échantillons, car elle permet une gestion automatisée et efficace de plusieurs analyses, réduisant ainsi le temps de manipulation et augmentant la productivité globale du processus d'analyse.
3. ### Pour lancer une analyse unique :
Préparation de l'échantillon :
- Placez votre vial contenant l’échantillon en position 1 dans l’autosampler et assurez-vous qu’il est bien fermé avec son septum.
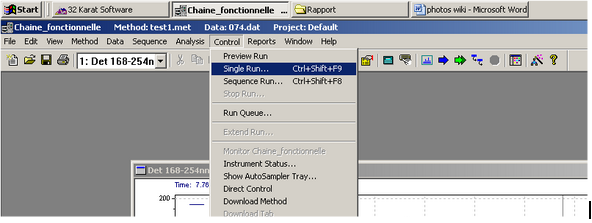
Configuration de l'analyse :
- Rendez-vous dans l’onglet Control et sélectionnez Single Run, ou cliquez directement sur la flèche bleue dans la barre d’outils. La fenêtre Single Run Acquisition apparaît.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/5PWimage.png)
- Vérifiez que la méthode précédemment créée est bien sélectionnée en face de Method.
- Nommez l’échantillon en face de Sample ID.
- Définissez le nom du fichier sous lequel il sera enregistré en face de Data File.
- Choisissez l’emplacement où il sera enregistré en face de Data path.
Vérification des paramètres :
- Assurez-vous que le numéro en face de Vial correspond à la position de votre échantillon dans l’autosampler. Si votre échantillon est en position 1, laissez le numéro 1.
- Gérez le volume d’injection de l’échantillon si nécessaire.
- Ne modifiez pas les autres paramètres.
Lancement de l'analyse :
- Une fois toutes les vérifications faites, appuyez sur Start pour lancer l’analyse.
4. ### Pour lancer une séquence d’analyses :
Préparation des échantillons :
- Placez vos échantillons à analyser les uns à la suite des autres, dans l’ordre numérique, sur l’autosampler.
Configuration de la séquence :
- Rendez-vous dans l’onglet File / Sequence / Sequence Wizard.
[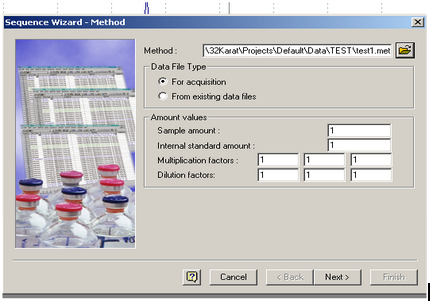](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/Mfuimage.png)
- En face de Method, sélectionnez votre méthode si ce n’est pas déjà fait, puis cliquez sur Next.
- Définissez le nom de votre séquence en face de Sample ID et le nom de fichier de votre séquence en face de Data File.
- Cliquez sur la flèche bleue en face de Data File et sélectionnez Increment Number.
- Entrez 3 en face de Number of unknown runs et cliquez sur Next.
[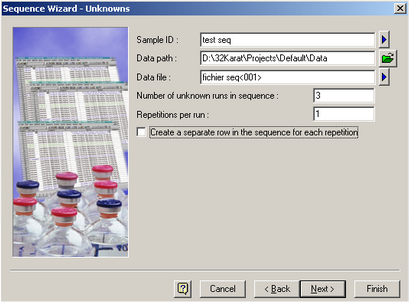](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/pa9image.png)
- Définissez le volume d’injection de la séquence et cliquez sur Finish.
- Enregistrez la séquence que vous venez de créer dans l’onglet File / Sequence / Save as et nommez-la.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/d5Rimage.png)
Lancement de la séquence :
- Rendez-vous dans l’onglet Control et sélectionnez Sequence Run, ou cliquez directement sur la flèche verte dans la barre d’outils.
[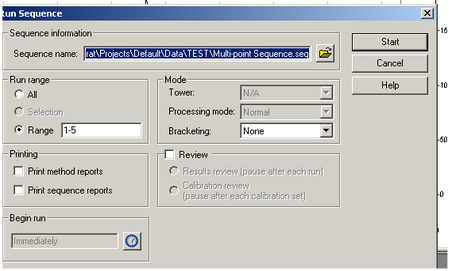](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/VIvimage.png)
- Assurez-vous que votre séquence est bien sélectionnée en face de Sequence name.
- Cochez la case Range et désignez l’ordre de placement des vials sur l’autosampler. Par exemple, si vous souhaitez analyser 5 échantillons placés de la position 1 à 5, entrez 1-5 en face de Range.
- Cliquez sur Start pour lancer la séquence d’analyses.
4. ## Observation et interprétation des chromatogrammes
Juste après avoir lancé une analyse, il est possible d’observer les chromatogrammes aux longueurs d’ondes prédéfinis en temps réel. Pour cela, il suffit de cliquer sur les onglets « DET 168 – 254nm » en bas de l’écran. Il est également possible de profiter de l’analyse en 3D du détecteur PDA et d’avoir une vue globale sur plusieurs graphes. Pour cela, il faut cliquer sur View / PDA View / Mixed View.
Une fois l’analyse terminée, on obtient un chromatogramme mal intégré. Afin de l’intégrer correctement, deux paramètres importants sont à prendre en compte :
- Fonction Threshold : Cette fonction va permettre de définir la ligne de base et d’éliminer les pics que l’on ne souhaite pas intégrer. Après avoir cliqué sur le chromatogramme que l’on souhaite intégrer, Il faut sélectionner l’option Threshold dans la barre d’outils en bas (deuxième logo en partant de la gauche). Une fois sélectionné, il faut cliquer sur le début de la ligne de base, soit un peu après 0, puis cliquer une deuxième fois juste avant le premier pic que l’on souhaite intégrer. Il faut ensuite cliquer sur « Analyze Now » dans la boîte de dialogue qui apparaît.
- Fonction Width : Cette fonction va permettre de connaitre la largeur exacte d’un pic et donc d’intégrer efficacement le graphique. Pour cela, il faut cliquer sur la fonction Width dans la barre d’outils en bas (premier logo à gauche), cliquer au début du pic le plus intense puis à la fin de ce même pic. Il faut ensuite cliquer sur « Analyze Now » dans la boîte de dialogue qui apparaît.
# IV/ Maintenance de l’appareil :
1. ## Amorçage des pompes : Bulles d’air dans la tuyauterie :
Avant de commencer une analyse, il est essentiel de vérifier qu'il n'y a pas de bulles d'air dans la tuyauterie des pompes A et B. Le système HPLC utilise normalement trois bouteilles de solvant : une contenant le solvant A (eau) à droite, une contenant le solvant B (acétonitrile) à gauche, et une troisième servant de bouteille poubelle utilisée lors du désamorçage de la pompe. Si vous changez de solvant ou si vous apercevez des bulles d'air, il est impératif de procéder à un amorçage des pompes pour éliminer ces bulles. Voici les étapes à suivre pour amorcer les pompes, en prenant la pompe A comme exemple. Ces étapes devront être répétées pour la pompe B.
Préparation :
- Placez une seringue de 10 ml dans le Prime Port A, situé juste en dessous du levier d'amorçage A.
- Ouvrez le robinet de vidange en tournant complètement le bouchon dans le sens inverse des aiguilles d'une montre. Cela permet de protéger la colonne en changeant le chemin d’élution de la phase mobile, dirigeant ainsi le solvant directement vers la bouteille poubelle sans passer par la colonne.
Amorçage :
- Tournez le levier d'amorçage de la pompe A vers la position Prime Lines.
- Aspirez le solvant dans les tuyaux en tirant lentement sur le piston de la seringue. Continuez à aspirer jusqu'à ce qu'il n'y ait plus de bulles d'air entre la bouteille de solvant et la seringue.
- Remplissez ensuite la seringue de solvant.
- Tournez le levier d'amorçage vers la position Prime Pump et appuyez sur le piston de la seringue pour forcer le solvant à sortir à travers la ligne de drainage vers la bouteille de déchets.
- Lorsque plus aucune bulle d'air n'est observée dans les tuyaux, arrêtez d'appuyer sur la seringue et tournez le levier d'amorçage vers la position Operate.
Finalisation :
- Accédez au panneau de contrôle Direct Control depuis 32 Karat et configurez la pompe A à 100% et la pompe B à 0%, puis réglez le flux à 2 ml/min.
- Faites couler la phase mobile pendant 2 à 3 minutes pour vous assurer qu'il n'y a plus de bulles.
- Répétez exactement les mêmes étapes depuis Préparation avec la pompe B.
Une fois les deux pompes amorcées, vous pouvez refermer le robinet de vidange en tournant complètement le bouchon dans le sens horaire, afin de rétablir le chemin d’élution de la phase mobile vers la colonne. En suivant ces étapes, vous assurerez un bon fonctionnement de votre système HPLC sans présence de bulles d'air dans les lignes de solvant.

2. ## Changement de colonne :
Le changement de colonnes en HPLC est une opération délicate qui nécessite des précautions spécifiques pour garantir la performance de la colonne et la précision des analyses futures. Voici les étapes à suivre et les précautions à prendre pour changer de colonne de manière sûre et efficace.
Arrêt du Flux de la Phase Mobile :
- Avant de déconnecter la colonne, assurez-vous que le flux de la phase mobile est complètement arrêté. Cela évite les éclaboussures et réduit le risque de contamination.
Déconnexion de la Colonne :
- Déconnectez soigneusement la colonne des lignes d’entrée et de sortie. Veillez à ne pas endommager les filetages ni les connexions.
- Notez l'orientation de la colonne (entrée et sortie) pour faciliter le remontage ou le stockage correct.
Rinçage de la Colonne (si nécessaire) :
- Si la colonne doit être stockée pour une période prolongée ou si vous avez utilisé une phase mobile contenant des tampons, rincez-la d’abord avec de l’eau déionisée, puis avec un solvant organique (comme l'acétonitrile ou le méthanol) pour éliminer tous les résidus.
Bouchonnage de la Colonne :
- Précaution essentielle : Fermez immédiatement les extrémités de la colonne avec des bouchons hermétiques pour éviter que la colonne ne sèche. L’exposition à l’air peut entraîner l’évaporation du solvant, ce qui peut causer des dommages permanents à la phase stationnaire.
- Assurez-vous que les bouchons sont bien serrés et que la colonne est correctement scellée.
Stockage de la Colonne :
- Stockez la colonne dans un endroit frais et sec, à l’abri de la lumière directe et des variations de température.
- Étiquetez la colonne avec des informations pertinentes telles que le type de colonne, le dernier solvant utilisé, et la date du dernier usage pour une référence future.
Préparation de la Nouvelle Colonne :
- Avant de connecter une nouvelle colonne, vérifiez les recommandations du fabricant concernant le solvant d’équilibrage et les conditions de démarrage.
Connexion de la Nouvelle Colonne :
- Connectez la colonne en respectant l'orientation indiquée (entrée et sortie). Serrez les connexions fermement mais sans forcer pour éviter d'endommager les filetages.
Équilibrage de la Colonne :
- Rincez la nouvelle colonne avec le solvant de démarrage recommandé pour éliminer les conservateurs et pour équilibrer la colonne avant l’analyse.
- Laissez le solvant circuler à un débit faible pendant quelques minutes jusqu’à ce que la pression se stabilise et que la ligne de base soit stable.
# Réalisation d'un protocole HPLC
### Introduction
##### Principe
La chromatographie est un procédé qui permet de déterminer les différents composant d'un mélange. Il existe plusieurs procédés de chromatographie, et l'une des plus performantes s'appelle CLHP (Chromatographie en phase Liquide à Haute Performance) ou HPLC en anglais (High Performance *ou Pressure* Liquid Chromatography). La méthode HPLC se fait à haute pression **\[1\]**.
Une phase mobile, composée d’acétonitrile, d'eau ou autre, pousse le mélange à analyser dans une "colonne" (voir sur l'image ci-dessous). Dans cette colonne, il y a une phase stationnaire : des grains de très petite taille. En fonction des propriétés des différents composants, et avec un choix judicieux de phase mobile et de phase stationnaire, les composants du mélange sont plus ou moins ralentis au passage de la colonne, et donc sortent de celles-ci à des instants différents **\[2\]**.
Le spectrographe en sortie affichera alors les spectres d'absorption de "chaque" espèce du mélange. Les pics sont alors plus fins (la résolution est augmentée), et le seuil de détection est plus bas que si le mélange avait été placé directement dans un spectrographe **\[2\]**.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-12/4IQwhatsapp-image-2024-12-16-at-15-20-12.jpeg)Photo prise de la machine au fablab
##### Explication
Pour se familiariser avec l'utilisation de la machine à HPLC (chromatographie en phase liquide haute performance ou haute pression) de l'entreprise Beckmann Coulter avec une colonne C18 (ou phase inverse, revert phase, RP), on essaie de retranscrire un protocole simple, reposant sur le matériel que nous avons.
Nos conditions sont les suivantes :
- le protocole doit être simple
- la phase mobile doit être soit de l'eau soit de l'acétronitrile
- la colonne doit mesurer 250 mm \* 4.60 mm (c'est la colonne que nous avons au fablab)
### Protocole
Le protocole choisi permet de déterminer la concentration en caféine dans les suppléments alimentaires pour perdre du poids **\[3\]**.
##### Réactifs
- Caféine comme référence standard
- Acétonitrile
- Eau ultra pure
- Échantillons tests – supplément alimentaire à base de caféine
##### Matériels
- Varian Pro Star HPLC system
- Détecteur UV
- Colonne C18, 4.6 mm
- Thermostat
- Bain à ultrason
- Seringue Hamilton conçue pour injection manuelle dans les ports HPLC (25 ml)
##### Conditions de chromatographie
- Phase mobile 65% d'eau et 35% acétonitrile
- Détection UV : 274 nm
- Débit : 1 ml/min
- Colonne : C18
- Température thermostat : 25°C
Préparation des solutions standards
Dilution dans une solution d’acétonitrile/eau (respectivement 35/65) en ultrasonication pendant 15 min dans un bain à ultrason.
Préparation des échantillons tests
1. Extraction avec de l'acétonitrile/eau, une ultrasonication dans un bain à ultrasons pendant 15 minutes.
2. Peser la capsule pour avoir son poids exacte. Réduire la capsule alimentaire à analyser sous forme de poudre (si on n'utilise de la poudre à café, peser simplement une dose de poudre).
3. Dans un bécher de 50 ml, dissoudre la poudre obtenue dans la phase mobile acétonitrile/eau (35/65). Filtrer sous Buchner.
4. Récupérer le filtrat et le diluer dans la phase mobile en proportion 100/200 (filtrat/phase liquide). Injecter 20 ml de la solution dans l'appareil HPLC à l'aide d'une seringue Hamilton de 25 ml
5. Filtration deux fois pour toutes les solutions et préfiltration pour éliminer les grosses particules des solutions. Filtration plus fine avec des filtres à seringue (taille des pores 0,45 μm).
6. Analyse de tous les échantillons trois fois.
##### Résultats
Les résultats présentés ci-dessous sont ceux de l'étude :[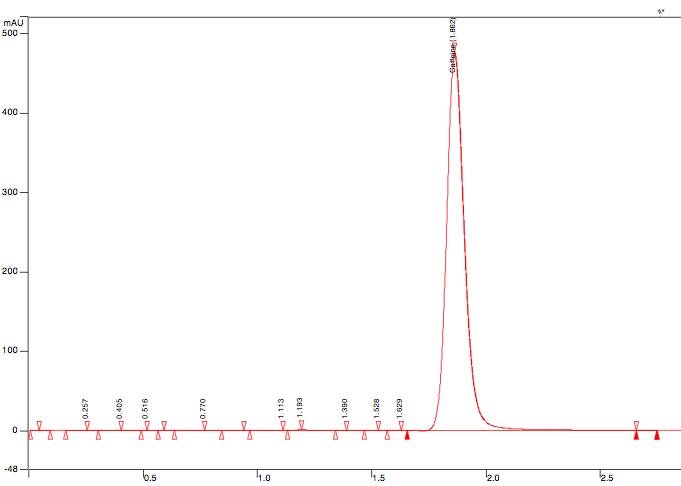](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-12/chromatogram-of-standard-solution-of-caffeine-in-concentration-60-mcg-ml.jpg)**\[3\]**
### Bibliographie
#### Sources
1. [Quelles sont les différentes phases en Chromatographie? AirLiquide](https://fr.airliquide.com/solutions/calibration-et-analyse/chromatographie/quelles-sont-les-differentes-phases-en-chromatographie)
2. [Chromatographie en phase liquide à haute performance, Wikipédia](https://fr.wikipedia.org/wiki/Chromatographie_en_phase_liquide_%C3%A0_haute_performance)
3. L'article utilisé est celui de Stanislava Ivanova, Kalin Ivanov, Melissa Bekyar et de Pavlina Kostova, publié en mai 2020, intitulé [HPLC Method for Determination of Caffeine in Food Supplements for Weight Loss](https://www.researchgate.net/publication/341152830_HPLC_Method_for_Determination_of_Caffeine_in_Food_Supplements_for_Weight_Loss), sur le site [ResearchGate](https://www.researchgate.net/). Voici le pdf du l'étude : [Caffeine-NM2020.pdf](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/1230)
# Inventaire HPLC
| Marque | Ref (Part No) | Quantité | Description | Type de colonne | Matériel | Usage | lien |
| Phenomenex | 00G-4252-e0 | 2 | Luna® 5 µm C18(2) 100 Å, LC Column 250 x 4.6 mm, Ea | Reversed Phase | Fully Porous Silica | Separation of hydrophobic compounds | https://www.phenomenex.com.cn/products/part/00g-4252-e0?fsr=1 |
| Beckman | 235329 | 3 | ULTRASPHERE ODS 235329 5µ 4.6mm X 25cm HPLC COLUMN | Reversed Phase | | | http://www.phenomenex.co.kr/storage/ecatalogue/z1264.pdf |
| Beckman | 237390 | 2 | ULTRASPHERE ODS 235329 5µ 2.0m X 15cm HPLC COLUMN | Reversed Phase | | | |
| Beckman | 727404 | 1 | SPHEROGEL MICRO-PTH 3µ 2mm X 15cm HPLC COLUMN | SEC | | | y'en a pas |
| Waters | 84175 | 4 | µ Porasil, 7.8 \* 300 mm | Phase Normale | | | https://www.waters.com/nextgen/fr/fr/shop/columns/wat084175--porasil-silica-prep-column-125a-10--m-78-mm-x-300-mm-1-pk.html |
| Waters | 86344 | 1 | Novapak C18 3.9 mm \* 15 cm | Reversed Phase | | Mobile phase 68:325(acytonitrile water) | https://www.waters.com/nextgen/fr/fr/shop/columns/wat086344-nova-pak-c18-column-60a-4--m-39-mm-x-150-mm-1-pk.html |
| Beckman | 142301 | 1 | Q HyperD 10, 10µm 4.6 \* 100 mm | Ion Exchange ? | | | |
| Macherey-nagel | 3010140 | 1 | VP 250 /21 Nucleosil 7 C18 | Reversed Phase | | | https://www.mn-net.com/fr/colonne-hplc-vp-preparative-nucleodur-c18-htec-7-m-250x21-mm-762566.210 |
| Macherey-nagel | 721870.46 | 1 | CC 250-4.6 Nucleosil 100-5 | Reversed Phase | | | https://www.mn-net.com/fr/colonne-hplc-ec-analytique-nucleosil-100-5-c18-5-m-250x4.6-mm-720014.46 |
| Macherey-nagel | 721662.40 | 4 | Nucleosil 100-5 C18 5µm 4mm 25cm | Reversed Phase | | Mobile phase 80:20(acytonitrile water) | https://www.mn-net.com/fr/colonne-hplc-ec-analytique-nucleosil-100-5-c18-5-m-125x4-mm-720002.40 |
| TOSOHAAS | 8540 | 1 | TSK Gel G 2000 SWXL 5µm 7.8mm 30 cm | SEC | | | |
| TOSOH | 8542 | 1 | TSK Gel G4000 SWXL 8um 7.8 mm 30 cm | SEC | | | https://www.separations.us.tosohbioscience.com/HPLC\_Columns/id-8327/TSKgel\_G3000SWxl |
| Macherey-nagel | 721870.40 | 1 | CC 250-4 Nucleosil 100-5 | Reversed Phase | | Mobile phase N-heptane | https://www.mn-net.com/fr/colonne-hplc-ec-analytique-nucleosil-100-5-c18-5-m-250x4-mm-720014.40 |
# Disperseur/Emulseur numérique ULTRA-TURRAX T 18 Digital
#### **Fiche technique:**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/fiche-technique.png)
#### **Outils:**
**[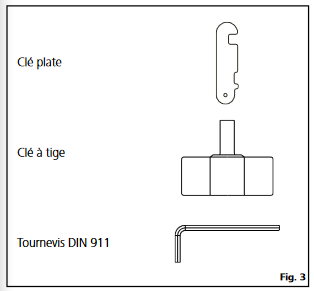](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/outils.png)**
#### **Précautions d'emploi:**
- Portez votre équipement de protection personnel selon la classe de danger du milieu à traiter. Sinon,vous vous exposez à des dangers:
\- pulvérisation et évaporation de liquides,
\- happement de parties du corps, cheveux, habits et bijoux.
- Placez l'appareil en aire spacieuse sur une surface plane, stable, propre, non glisssante, sèche et ininflammable.
- Avant toute utilisation, contrôlez l'état de l'appareil et des accessoires. N'utilisez pas les pièces endommagées.
- L'appareil n'est pas adapté à un fonctionnement manuel.
- Les récipients d’agitation doivent être attachés bien. Tenez compte d’une bonne stabilité de la construction totale.
- Bloquer le bac d'agitation pour l'empêcher de tourner.
- Vérifiez la bonne fixation des poignées rotatives et resserrez-les si besoin.
- Les récipients en verre doivent être toujours assurés contre une rotation au moyen d’un dispositif de serrage. Il est nécessaire d’utiliser des éléments intermédiaires élastiques lors des travaux dans les constructions à rodage afin d’éviter les ruptures du verre.
- Notez le mode d’emploi d'outil dispersant et des accessoires.
- Respectez la vitesse de rotation autorisée de l’outil de dispersion utilisé. Ne réglez jamais une vitesse supérieure.
- L’utilisation du disperseur sans outil dispersant n’est pas autorisée.
- Assurez-vous que l’outil de dispersion se trouve toujours dans le bac d’agitation lorsque l’appareil est allumé.
- Il ne faut jamais utiliser les outils dispersants à sec car le système d’étanchéité et les paliers sont détruits sans le refroidissement des outils par la matière.
- Avant la mise en service de l'appareil, régler la vitesse la plus basse car l'appareil commence à fonctionner à la dernière vitesse réglée. Augmentez doucement le régime
- Avant la mise en marche du disperseur, assurez-vous que la tige de l’appareil est plongée min. 45 mm profondément dans la matière afin d’éviter toute éclaboussure de matière.
- La distance entre l'outil dispersant et le fond du récipient ne doit pas dépasser 10 mm.
- Veiller à ce que le statif ne commence pas à se dérégler.
- En cas de décentrage ou d’apparition de bruits inhabituels
éteignez immédiatement l’appareil.
- En fonctionnement, l'outil de dispersion et la bride d'accouplement peuvent devenir très chauds
- Ne pas couvrir les fentes d'aération servant au refroidisse-
ment de l'entraînement.
- Il peut se produire des décharges électrostatiques entre le milieu et l'arbre de dispersion qui constituent un risque direct.
- Ne traitez que des milieux pour lesquels l'apport d'énergie pendant l'opération ne pose pas problème. Cela vaut aussi pour les autres apports d'énergie, comme la radiation lumineuse par ex..
- Veuillez noter que vous ne soyez pas trop près à la bride pendant la dosage de poudre. La poudre peut être soufflé par de tourbillonnements de l’air de l’entraîne.
- Montez les accessoires uniquement lorsque l'appareil est débranché.
#### **Utilisation conforme:**
**Application :**
L’unité d’entraînement, combinée à un outil de dispersion autorisé, est un disperseur ou émulseur à haute vitesse pour le traitement de milieux fluides ou liquides en fonctionnement discontinu.
Par le terme “disperser”, on sous-entend la division et la répartition d’une phase compacte, liquide ou gazeuse dans un fluide inapte à être entièrement mélangé avec elle.
**Production de :**
Émulsions
Dispersions
Homogénéisation humide
**Mode de fonctionnement :**
Appareil à pied (L'outil de dispersion est orienté vers le bas)
#### **Commande:**
La vitesse de rotation se règle en continu avec le bouton rotatif. L’affichage par DEL permet de lire la vitesse de rotation. Une valeur de 13,6 correspond par exemple à 13 600 rpm.
#### **Montage de l'avant-bras et du support:**
- La tige d'avant-bras doit être montée de la façon suivante (voir fig. 1) :
- Placer la tige d'avant-bras (1) dans la bride.
- Mettre en place la vis à tête cylindrique (2).
- Visser la vis cylindrique (2) avec le tournevis DIN 911
- Les vibrations peuvent entraîner le desserrage de la vis cylindrique (2). Vérifier donc régulièrement pour des raisons de sécurité la fixation de l'avant-bras. Resserrer au besoin la vis cylindrique (2) d’ouverture 4.
- Afin de rendre le travail plus sûr, les unités de commande sont fixées sur le support de plaque R 1826 (5) à l'aide d'un manchon en croix (3)
- L'unité de commande doit être montée le plus proche possible de la tige support afin d'augmenter la stabilité de l'ensemble mécanique.[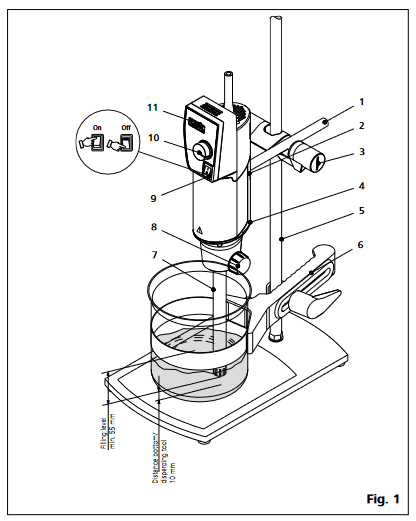](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/fig-1.png)
#### **Travailler avec l'appareil:**
\- Tenez compte des conditions ambiantes listées dans les données technique
**Montage de l’outil dispersant :**
- Ouvrez la vis à poignée (10), de manière que le filetage ne dépasse pas dans l'alésage.
- Insérez l'outil de dispersion (9) jusqu'en butée dans l'unité d'entraînement. Après une légère résistance (bille de pression), la tige s'enclenche de manière audible. L'outil de dispersion est bien monté s'il est aligné sur le rebord inférieur de l'unité d'entraînement.
- Attention: Fixez maintenant l'outil de dispersion en vissant à fond la vis à poignée (10).[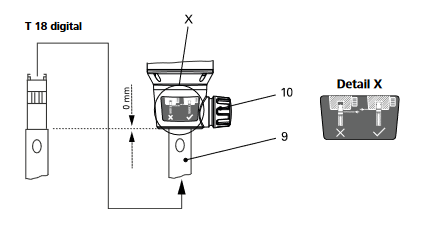](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/BvRimage.png)
Pour éviter l'entrée d'air accidentelle dans le milieu en raison d'importantes turbulences dues à la rotation, l'unité peut être placée de manière légèrement décentrée dans le bac d'agitation.
La vitesse peut être réglée de manière graduelle avec la molette de réglage afin de s'adapter aux exigences du milieu utilisé.
La vitesse de rotation à vide de l’unité d’entraînement peut être réglé entre 3000 – 25000 rpm et lu sur l’affichage par DEL.
Si ces conditions sont remplies, l’appareil est prêt à fonctionner après avoir connecté la prise de secteur.
#### **Entretien et nettoyage:**
- Débranchez la prise secteur pour la nettoyage.
- Pour nettoyer la commande, il faut utiliser uniquement de l’eau avec un produit d’addition au détergent contenant un dérivé tensio-actif ou de l’alcool isopropylique si l’encrassement est plus important (pas pour les pièces plastiques).
- Pour nettoyer l’outil dispersant actionnez-le dans un dissolvant, que peut dissoudre les restes de la substance. En raison de la grande vitesse d’écoulement, rotor et redresseur sont nettoyés jusqu’à un grand degré. L’outil dispersant doit être démonter et nettoyé immédiatement après avoir travaillé, ainsi que des restes de la substance adhérantes cultivent des cultures bactérielles non désirées. Pour le nettoyage on peut démonter l’outil de dispersion avec la clé plate et la clé d’axe (comprises dans le kit d´outils du disperseur)
- Dévissez le rotor (3) de l’axe (2) avec la clé plate (pour fixer le rotor (3)) et la clé d’axe (pour tourner l’axe embrayage-latéral). Tirez l’axe (2) vers le haut du tube d’axe (1). Maintenant sortez le palier annulaire fendu (4) du tube d’axe (1) vers le haut.
[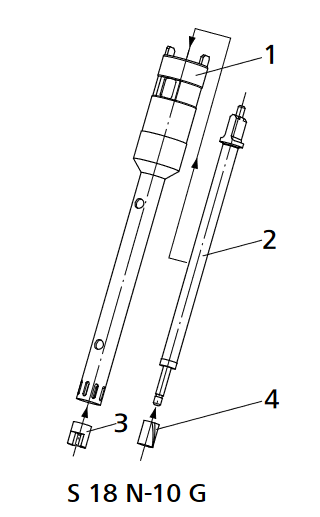](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/od-fig-1.png)
**Liste des procédures permises avec techniques de stérilisation:**
**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/nettoyage-et-entretien-outil-dispersant.png)**
#### **Exemple d'utilisation: broyage de feuille**
[Broyage de feuille pour le dosage des chlorophylles](https://wiki.fablab.sorbonne-universite.fr/BookStack/books/techniques-de-base/page/dosage-des-chlorophylles)
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/AyVimg-2293.jpg)[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/N3iimg-2292.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/NB1img-2303-3.jpg)
# Imprimante résine ELEGOO
# Introduction
Pour les curieux, à voir : **[Stéréolithographie](https://fr.wikipedia.org/wiki/St%C3%A9r%C3%A9olithographie)**
Dans le monde de l'ingénierie d'aujourd'hui, les méthodes d'impression 3D pour la fabrication additive sont généralement divisées en deux, l'une étant réalisée avec des matériaux comme le PLA et l'ABS (composants à base de plastique) ou la résine.
L'impression 3D en résine est généralement préférée car elle permet de réaliser des pièces avec des détails fins, des surfaces lisses, le plus haut niveau de précision et d'exactitude en employant aussi une méthode qui permet de rassurer **l'isotropie** - les imprimantes 3D généralement font des pièces une "couche" à la fois, donc la résitance de l'impression peut dépendre de son orientations dans les axes X,Y,Z du plateau.
Comment ça marche ? Pour l'expliquer avec les termes les plus simples possibles, le processus de l'imprimante résine envoie de la UV dans un réservoir de liquide (de la résine) déclenchant une réaction qui solidifie la résine en un plastique dur.
Vous voulez concevoir un tel projet ? Alors on vous invite à regarder le chapitre intitulé "[Imprimante résine ELEGOO Saturn](https://wiki.fablab.sorbonne-universite.fr/BookStack/books/appareils-biologie-chimie/chapter/imprimante-resine-elegoo)" pour plus d'information sur la machine **Elegoo Saturn** qui fait exactement ça !
# Calibration de la plateforme
Pour procéder à la calibration de la plateforme, il faut:
Matériel:
- la clé allen dédiée: [Clé allen.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/713)
- le papier de nivellement: [Leveling paper.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/714)
Etapes à suivre:
- Allumer l’imprimante
- Enlever la cloche en plastique
- Verifier si la plateforme de construction est bien attachée (avec la vis entourée en vert) et dévisser les vis démarqués en rouge pour permettre a la plateforme (entourée en bleu) de pivoter [Building platform.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/716)
- Dévisser la cuve[ Cuve.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/715)
- L’enlever et placer le papier de nivellement en le calant ainsi [Nivellement.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/717)
- Sur l’écran, appuyer sur « Tool » , puis « Manual » et enfin le logo avec une maison pour remettre la plateforme à la position z0. [Tools.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/718) => [Manual.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/719) => [Home.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/720)
-
- Une fois la position atteinte, verifier l’alignement de la plateforme avec le papier de nivellement [Alignement.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/722), puis, une fois la plateforme remise en position optimale, resserrer les vis à l’aide de la clé allen [Vis plateforme.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/723)
- Une fois la plateforme fixée en position rigide, revenir dans le menu « Tool », « Manual » et sélectionner l’option 0.10mm, puis soulever la plateforme très légèrement jusqu’à ce que le papier de calibration puisse bouger mais en rencontrant toujours une résistance de la plateforme.
- [0.10mm.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/721)
-
- Une fois la bonne position atteinte, revenir dans « Tools », puis « set Z=0 » pour définir cette position comme la position de départ [Set Z=0.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/724)
- Finalement, aller dans « Tool », « Manual » puis sélectionner l’option 10mm et appuyer autant de fois sur la flèche de haut que nécessaire pour remonter la plateforme jusqu’à la position de départ.[10mm.jpeg](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/725)
- Remettre et revisser la cuve.
Lien tuto YouTube: [https://www.youtube.com/watch?v=3AmnRFHuCto](https://www.youtube.com/watch?v=3AmnRFHuCto)
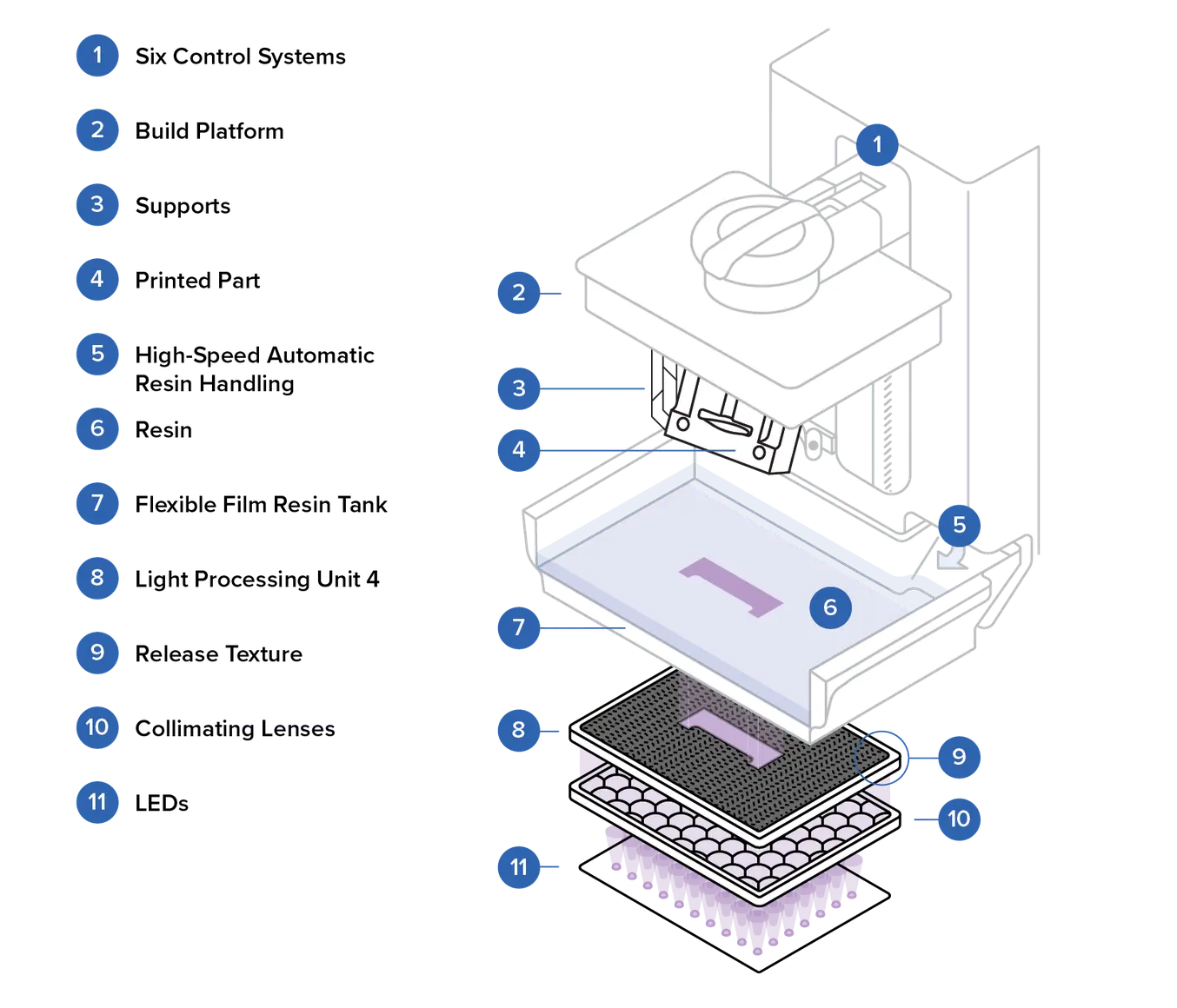
# IMPRIMANTE ELEGO SATURN 2 - GUIDE UTILISATION
## IMPRIMANTE ELEGO SATURN 2
### Guide d'utilisation
#### **1. Généralites**
##### **Principe**
L'imprimante **[ELEGO SATURN 2](https://www.elegoo.com/en-gb/products/elegoo-saturn-2-8k-10-inches-mono-lcd-3d-printer?srsltid=AfmBOoojom5ArIhjoONlSV1V5SzR1oMExcuEs69hRY9ZHbDjxNgATJUl)** utilise une technologie de photo curation appelle **MSLA** (Masked Stereolithography). Cet type d'imprimantes utilisent un ensemble de LED UV (Ultra violet) placé sous un écran LCD (Liquid Crystal Display). L'écran **active** ou **désactive** sélectivement les **pixels**, permettant ainsi à la lumière UV de **durcir** la résine photopolymère dans le bac.
[https://formlabs.com/blog/technology-behind-form-4/](https://formlabs.com/blog/technology-behind-form-4/)
Les résines économiques ont souvent des temps de durcissement inférieurs à 2,5 secondes, tandis que les temps de couche pour les résines d'ingénierie peuvent varier de 3 à 10 secondes.
Une fois la couche durcie, le plateau de fabrication se soulève, séparant l'impression du film FEP ou PFA dans le bac. Le plateau continue de monter jusqu'au niveau spécifié par l'utilisateur, puis redescend pour commencer la couche suivante.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/2Kvimage.png)
##### **Caractéristiques**
- **LCD :** Écran LCD Mono de 10 pouces 8K
- **Poids net :** 11 kg
- **Poids total :** 15,1 kg
- **Précision de l'axe Z :** 0,00125 mm
- **Résolution XY :** 0,0285 mm (7680 x 4320)
- **Dimensions :** 306 x 273 x 567 mm³
- **Système :** EL3D-3.0.1
- **Logiciel de tranchage :** Chitubox
- **Source de lumière :** COB (longueur d'onde 405 nm)
- **Opération :** Écran tactile de 3,5 pouces
- **Électricité :** 100-240V 50/60Hz 24V 4A
- **Résines :** Compatible avec la majorité des résines sur le marché (standard, ABS, à base végétale, à base d'eau, lavable, etc.)
- **Méthode de dissipation de chaleur :** 4 caloducs en cuivre + double ventilateurs
- **Purificateur d'air :** Enfichable
- **Épaisseur des couches :** 0,01-0,2 mm
- **Vitesse d'impression :** 30-70 mm/h
- **Connectivité :** USB
- **Technologie :** Photopolymérisation MSLA
##### **Applications:**
- Imprimantes et résine abordables
- Bonne résolution
- Finition de surface lisse - pas de lignes de couches
- Variété de matériaux - flexible, durable, transparent, céramique, etc.
- Capacité d'imprimer des géométries complexes
- Fonctionnement silencieux de l'imprimante
- Sécurité - nécessite des EPI et une ventilation
- Petits volumes de construction par rapport au prix
- Processus de nettoyage et de post-durcissement étendu
- La résine nécessite une température ambiante chauffée ou chaude, généralement entre 20-30°C
- Retrait en XYZ selon la résine et les réglages
- Déformation possible sur les impressions grandes et mal soutenues
**Note:** Si vous manquez de résine dans l'imprimante pendant l'utilisation, vous pouvez faire pause et en remettre.
4\. Une fois l'impression faite, attendez jusqu'il n'y ait pas de résine qui coule en dessous votre impression.
5\. Enlevez le couvercle, dévissez le système d'ancrage de la plateforme et séparez-la de l'imprimante.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/img-3721.jpeg)
6\. Raclez la plateforme pour séparer le modèle de celle-ci.

7\. Nettoyez la plateforme après chaque impression. S'il y a de la résine restante, filtrez-la et remmetez-là dans la bouteille de résine.
##### **Processus de curation**
1. Plongez le modèle dans un bain d'isopropanol et programmez un cycle de lavage de 5 min.

2\. Sortez le modèle du bain à l'aide du grille spéciale pour les modèles.
3\. Mettez-le a nouveau et programmez une cure de 2 min en appuyant sur le bouton ¨CURE¨.

Bibliographie:
- [https://www.elegoo.com/en-gb/products/elegoo-saturn-2-8k-10-inches-mono-lcd-3d-printer?srsltid=AfmBOoojom5ArIhjoONlSV1V5SzR1oMExcuEs69hRY9ZHbDjxNgATJUl](https://www.elegoo.com/en-gb/products/elegoo-saturn-2-8k-10-inches-mono-lcd-3d-printer?srsltid=AfmBOoojom5ArIhjoONlSV1V5SzR1oMExcuEs69hRY9ZHbDjxNgATJUl)
- [https://4dfiltration.com/resources/3d/what-is-msla?srsltid=AfmBOoqnjaVXMBvbAPJtBlB4GDqqLFUkfWPG6FoLKbuKr79qD2GiuFEA](https://4dfiltration.com/resources/3d/what-is-msla?srsltid=AfmBOoqnjaVXMBvbAPJtBlB4GDqqLFUkfWPG6FoLKbuKr79qD2GiuFEA)
- [https://drive.google.com/file/d/19dcHVP4HL8yb87HJKTQLds1azKqI6sp5/view](https://drive.google.com/file/d/19dcHVP4HL8yb87HJKTQLds1azKqI6sp5/view)
- [https://nexa3d.com/blog/msla-3d-printing/](https://nexa3d.com/blog/msla-3d-printing/)
Pour aller plus loin:
[https://youtu.be/aOt5n1LfRXc](https://youtu.be/aOt5n1LfRXc)
# Imprimante résine ELEGOO Mars 5 Ultra
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/F58image.png)
####
### **N'oubliez pas d'agiter la bouteille de résine avant/après utilisation!**
####
#### **Caractéristiques :**
- Logiciel Slicer : CHITUBOX
- Connectivité : Interface USB & WiFi
- Technologie : Stéréolithographie MSLA
- Source de lumière : COB (longueur d'onde 405 nm)
- XY Résolution: 18x18 um (8520x4320)
- Précision de l'axe Z : 0.02 mm
- Épaisseur de la couche : 0.01-0.2 mm
- Vitesse d'impression : MAX 150mm/H
#### **Principe :**
L'imprimante résine ELEGOO Mars 5 Ultra repose sur la technologie de stéréolithographie (SLA) ou plus précisément sur la méthode de Photopolymérisation par laser (ou MSLA, pour "Masked Stereolithography"). Voici le principe de son fonctionnement :
- **Projections de lumière UV** : L'imprimante utilise un écran LCD monochrome haute résolution pour afficher des images de chaque couche du modèle 3D à imprimer. L'écran agit comme un masque, et un laser UV sous l'écran polymérise la résine photosensible, durcissant la matière couche par couche.
- **Base mobile** : Le plateau de construction, sur lequel l'objet est formé, commence par être plongé dans un bain de résine liquide. Au fur et à mesure de l'impression, le plateau monte progressivement pour permettre à chaque nouvelle couche d'être imprimée.
- **Résine photosensible** : La résine utilisée est un liquide qui durcit sous l'action de la lumière UV, et chaque couche de l'objet imprimé est durcie de manière sélective selon le modèle 3D envoyé à l'imprimante.
- **Précision et détails** : Grâce à l'écran monochrome et la précision du laser, la Mars 5 Ultra offre une haute résolution et longévité, permettant des détails fins et une finition lisse des impressions.
##### **Avant l'impression :**
Veuillez slicer votre modèle 3D au format .stl à l'aide du logiciel CHITUBOX, puis exporter votre fichier slicé .ctb sur une clé USB.
Assurez vous que la plaque de construction et le réservoir de résine sont propres et qu'il n'y a pas de bosses ou de bavures. Si c'est le cas, nettoyez les avec des serviettes en papier et de l'alcool.
#### **Processus d'impression :**
**1)** Allumer l'imprimante (le bouton d'alimentation est situé à droite de l'imprimante)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/MFdimage.png)
**2)** Au démarrage, l'imprimante effectue une **auto-vérification** de l'appareil, notamment des composants matériels clés pour éviter toute panne d'impression due à des dysfonctionnements matériels.
**Ne touchez pas l’imprimante pendant le processus d’auto-vérification.**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/7KSimage.png)
**3)** Remplissez le réservoir de résine à au moins 1/3 de son volume, mais ne dépassez pas la position de la ligne MAX. Si le niveau de résine est insuffisant, l'impression ne pourra pas débuter.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/ujBimage.png)
**4)** Couvrez le capot anti-UV de l'imprimante.
**5)** Insérez la clé USB contenant votre fichier préalablement slicé dans le port USB de l’imprimante.
**6)** Accédez au menu de l’écran tactile. Sélectionnez votre fichier slicé. Vérifiez les paramètres d’impression sur l'écran (type de résine, temps de durcissement, etc).
**7)** Appuyez sur **Démarrer l'impression** pour commencer.
**8)** Pendant l’impression, surveillez l’avancement pour vous assurer que la première couche adhère correctement à la plaque de construction. Si nécessaire, vous pouvez mettre l'impression en pause ou l'arrêter pour ajustez les paramètres.
##### **Une fois l'impression terminée:**
Soulevez la poignée pour retirer la plaque de construction et utilisez une spatule pour enlever délicatement le modèle.
[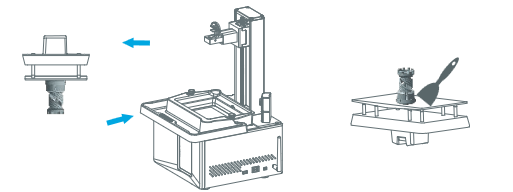](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/iS0image.png)
##### **Post-traitement** :
L'objet doit être nettoyé à l'alcool isopropylique (isopropanol) pour éliminer l'excédent de résine. Ensuite, il est essentiel de durcir l'impression sous lumière UV pendant quelques minutes afin de compléter la solidification.
Enfin, n'oubliez pas de nettoyez la plaque de construction et le réservoir de résine avec des serviettes en papier et de l'alcool.
##### **Caméra IA**
Dans l'interface de gestion de l'imprimante, vous pouvez activer la caméra AI pour observer la situation d'impression en temps réel. Vous pouvez également activer l'option time-lapse avant de commencer une impression. Les vidéos vont être sauvegardées dans l'historique.
Notes :
- La qualité de l'enregistrement peut diminuer sous de mauvaises conditions d'éclairage.
- Time-lapse ne peut être utilisée que lorsque la hauteur du modèle dépasse 50 mm. L'enregistrement de time-lapse commence à une hauteur de 30 mm et nécessite un temps de traitement supplémentaire après la fin de l'impression afin de générer les vidéos time-lapse. Le temps de traitement est directement proportionnel à la hauteur du modèle.
- L'appareil peut stocker jusqu'à 20 time-lapse vidéos. Une fois le stockage plein, les vidéos seront automatiquement remplacées dans l'ordre où elles ont été générées. Par conséquent, veuillez télécharger vos vidéos rapidement.
- Ce n'est que lorsque la hauteur du modèle dépasse 90 mm que la caméra AI détectera des conditions anormales telles que des anomalies sur la plaque de construction ou des bords déformés.
- Avec l'apprentissage continu, la détection et le jugement des anomalies par la caméra IA deviendront plus précis. Veuillez prêter attention aux informations de mise à jour de la caméra pour vous aider à accomplir vos tâches d'impression plus efficacement.
### **Précautions**
- Lors de l'utilisation de l'imprimante 3D, veuillez porter un masque et des gants pour éviter tout contact direct de la peau avec la résine photopolymère.
- Veuillez nettoyer le réservoir de résine avant de changer la résine pour une autre couleur.
- Veuillez ne pas utiliser d'outils tranchants ou pointus pour racler le réservoir de résine afin d'éviter d'endommager le film liner.
- En cas d'urgence lors de l'utilisation, veuillez d'abord éteindre l'alimentation de l'imprimante 3D.
- Si l'impression échoue, vous devez nettoyer l'excès de résine durcie dans le réservoir de résine et changer la résine, sinon cela pourrait endommager l'imprimante.
- Veuillez utiliser de l'alcool éthylique à 95 % (ou plus) ou de l'alcool isopropylique pour laver votre modèle, sauf si vous utilisez une résine lavable à l'eau.
##### **Utilisation de Chitubox (slicer):**
Il faut vérifier si les réglages du slice correspondent aux réglages optimales pour la combinaison résine/imprimante. Pour référence, des indications sont données dans le tableau ci-dessous (information pas infaillible, en fonction de votre modèle des ajustements peuvent être nécessaires)
| **Manufacturer** | **Resin Type** | **Resin Color** | **Layer Height** | **Bottom Layer Count** | **Bottom Exposure Time (s)** | **Exposure Time (s)** | **Light Off Delay (s)** | **Bottom Light Off Delay (s)** | **Lift Speed (mm/min)** | **Lift Distance (mm)** | **Retraction Speed (mm/s)** |
|---|
| **Elegoo** | **Rapid Standard Resin** | **Grey** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **SuperFlex 3DMaterial** | **Flexible Resin** | **Varies** | 0.05-0.1 mm | 4-6 | 40-60 | 5-7 | 2-3 | 2-3 | 50-60 | 4-6 | 5-10 |
| **Anycubic** | **UV Sensitive Resin** | **Black** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Anycubic** | **UV Sensitive Resin** | **High Clear** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Elegoo** | **Standard Photopolymer** | **Translucent** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Elegoo** | **Standard 2.0 Resin** | **Black** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Elegoo** | **Standard 2.0 Resin** | **White** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Elegoo** | **Standard Resin** | **Red** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Elegoo** | **Standard 2.0 Resin** | **Grey** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Esun** | **Standard Resin** | **Mix** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Esun** | **Standard Resin** | **Clear** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Esun** | **Standard Resin** | **Red** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Esun** | **Milky White S200** | **Milky White** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
| **Esun** | **eResin-PLA Clear** | **Clear** | 0.05 mm | 3-5 | 60-80 | 6-8 | 0-2 | 0-2 | 60-80 | 6-8 | 5-10 |
Ces réglages sont à faire de manière suivante:
- Dans Chitubox, après l'avoir configuré en séléctionnant la bonne machine ( si le logiciel n'est pas encore configuré), passer toutes les autres dialogues jusqu'a arriver sur l'image du slice.
- [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/capture-decran-cbox-1.png)
- Dans slice settings, choisir print
- [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/capture-decran-cbox-2.png)
- régler les paramètres en accord avec le tableau
# IMPRIMANTE ELEGOO SATURN 4 ULTRA (résine)
# Guide d'utilisation
L'espace biologie dispose de trois modèles d'imprimante ELEGO en résine : Saturn 2, Saturn 4 ULTRA et Mars 5 ULTRA.Vous trouverez dans ce guide le principe de fonctionnement global de la gamme ELEGO ainsi qu'un tableau comparatif pour orienter votre choix d'imprimante en fonction de vos besoins.
#### Fonctionnement global
L'impression résine est une forme d'impression 3D qui se base sur les propriétés photo-polymérisantes de certaines résines pour modeler des objets 3D. En effet, sous l'irradiation de rayons UV de telles résines, une réaction de polymérisation va s'enclancher : la résine liquide devient solide et se durcit. C'est par irradiation contrôlée de ces résines que nos imprimantes 3D parviennent à construire des objets.
On comprend donc déjà que les imprimantes à résines se composent de 2 éléments essentiels : un bac à résine et une lampeUV.
[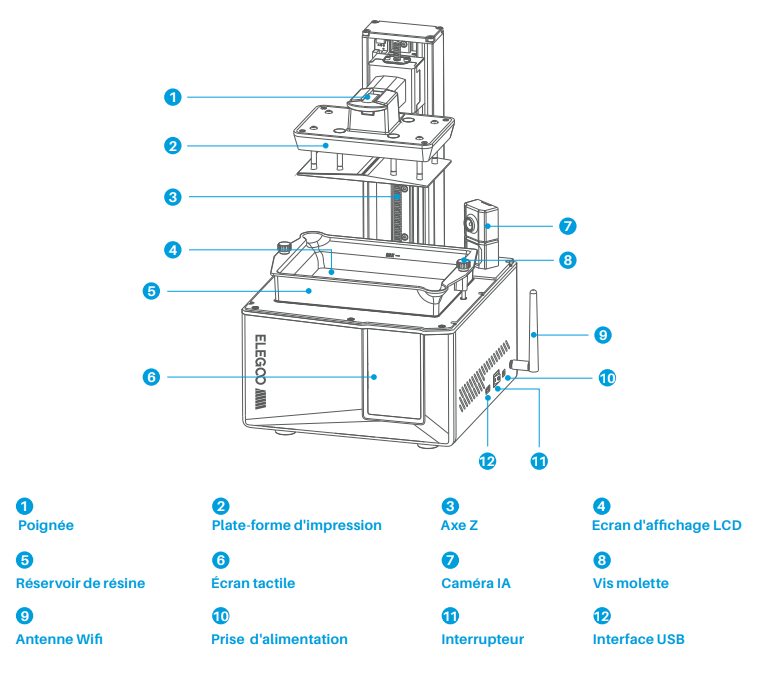](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/RbFimage.png)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/wGzimage.png)
#### Quelle imprimante pour quel besoin ?
La taille, l'esthétisme, la densité ou encore la vitesse de l'impression sont autant de critères à prendre en compte pour l'impression résine. Il est important de bien définir son projet car le choix de la bonne imprimante vous fera économiser du temps ( et de l'argent ). Pour vous guider dans ce choix, voici donc un tableau comparatif des 3 modèles disponibles au FabLab.
|
| ##### **Saturn 2**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/wl1image.png)
| ##### **Saturn 4 Ultra**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/lDpimage.png)
| ##### **Mars 5 Ultra**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/Pb8image.png)
|
| Technologie | Photopolymérisation MSLA | Photopolymérisation MSLA | Stéréolithographie MSLA |
| Type de résine | Compatible avec la majorité des résines sur le marché (standard, ABS, à base végétale, à base d'eau, lavable, etc.) | Soutient la plupart des résines sur le marché (lavage à l'eau, standard, absorbant les abdominaux, à base de plantes, etc.) | Soutient la plupart des résines sur le marché (lavage à l'eau, standard, absorbant les abdominaux, à base de plantes, etc.) |
| Volume d'impression | 218,88 x 122,88 x 250 mm³ | 218,88 x 122,88 x 220 mm³ | 153,36 x 77,76 x 165 mm³ |
| Épaisseur des couches | 0,01-0,2 mm | 0,01-0,2 mm | 0,01-0,2 mm
|
| Vitesse d'impression | max 70 mm/h | max 150 mm/h | max 150 mm/h |
| Précision de l'axe z\* | 0,00125 mm | 0,02 mm | 0,02 mm
|
| Résolution XY\*\* | 0,0285 mm (7680 x 4320) | 19x24 μm (11520x5120) | 18x18 μm (8520x4320)
|
| Suivi Camera | Non | Oui | Oui |
| Logiciel de slicing | Chitubox | Chitubox & Autodesk Fusion | Chitubox |
\*Précision de l'axe z :
\*\*Résolution XY :
#### Lancer sa première impression
Une fois l'imprimante choisie, il est temps de plonger au coeur du sujet : l'impression. Cette impression se fait en trois étapes clés : le slicing, le calibrage et l'impression. A ces trois étapes peut s'en ajouter une dernière qui est le post-processing mais qui n'est pas obligatoire.
Précaution d'utilisation :
Remplir le bac de résine d'au moins 1/3 de son volume mais ne pas dépasser la ligne MAX.
En cas de l'échec de l'impression, il est impératif de nettoyer le bac de résine et de changer de résine pour éviter tout endommagement de l'imprimante.
Porter un masque et des gants à chaque utilisation de l'imprimante/manipulation de la résine afin d'éviter tout contact entre cette dernière et la peau.
Une fois le modèle imprimé, le laver avec de l'alcool éthylique ou isopropylique à 95 % (ou plus), sauf si
il a été fait dans une résine lavable à l'eau.
En cas d'urgence, commencer par couper l'alimentation électrique de la batterie.
#### Sources
[https://eu.elegoo.com/fr/products/elegoo-saturn-2-8k-10-inches-mono-lcd-3d-printer?srsltid=AfmBOoojom5ArIhjoONlSV1V5SzR1oMExcuEs69hRY9ZHbDjxNgATJUl&utm\_source=officiallisting&utm\_medium=referral&utm\_id=eustorefr](https://eu.elegoo.com/fr/products/elegoo-saturn-2-8k-10-inches-mono-lcd-3d-printer?srsltid=AfmBOoojom5ArIhjoONlSV1V5SzR1oMExcuEs69hRY9ZHbDjxNgATJUl&utm_source=officiallisting&utm_medium=referral&utm_id=eustorefr)
[https://eu.elegoo.com/fr/products/mars-5-ultra-9k-7inch-monochrome-lcd-resin-3d-printer](https://eu.elegoo.com/fr/products/mars-5-ultra-9k-7inch-monochrome-lcd-resin-3d-printer)
[https://eu.elegoo.com/fr/collections/saturn-series/products/elegoo-saturn-3-resin-3d-printer-12k](https://eu.elegoo.com/fr/collections/saturn-series/products/elegoo-saturn-3-resin-3d-printer-12k)
[https://download.elegoo.com/04%20LCD%20Printer/22%20Mars%205%20Ultra/ELEGOO%20MARS%205%20Ultra%20User%20Manual%20Version-Multilingual-20240504-V2.pdf](https://download.elegoo.com/04%20LCD%20Printer/22%20Mars%205%20Ultra/ELEGOO%20MARS%205%20Ultra%20User%20Manual%20Version-Multilingual-20240504-V2.pdf)
[https://download.elegoo.com/04%20LCD%20Printer/10%20Saturn%202/Manual/ELEGOO%20SATURN%202-Manual%20Book-English-20220615.pdf](https://download.elegoo.com/04%20LCD%20Printer/10%20Saturn%202/Manual/ELEGOO%20SATURN%202-Manual%20Book-English-20220615.pdf)
[https://download.elegoo.com//04%20LCD%20Printer/20%20Saturn%204%20Ultra/Saturn%204%20Ultra-User%20Manual-20240315-V1.pdf](https://download.elegoo.com//04%20LCD%20Printer/20%20Saturn%204%20Ultra/Saturn%204%20Ultra-User%20Manual-20240315-V1.pdf)
# Imprimante résine ELEGOO Saturn 4 Ultra
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/saturn4ultrafrontview-1220x1220-crop-center.webp)
### **N'oubliez pas d'agiter la bouteille de résine avant/après utilisation!**
#### **Caractéristiques :**
- Logiciel Slicer : CHITUBOX
- Connectivité : Interface USB & WiFi
- Technologie : Stéréolithographie MSLA
- Source de lumière : COB (longueur d'onde 405 nm)
- XY Résolution: 19x24 µm (11520x5120)
- Précision de l'axe Z : 0.02 mm
- Épaisseur de la couche : 0.01-0.2 mm
- Vitesse d'impression : MAX 150mm/H
#### **Principe :**
L'imprimante résine ELEGOO Saturn 4 Ultra repose sur la technologie de stéréolithographie (SLA) ou plus précisément sur la méthode de Photopolymérisation par laser (ou MSLA, pour "Masked Stereolithography"). Voici le principe de son fonctionnement :
- **Projections de lumière UV** : L'imprimante utilise un écran LCD monochrome haute résolution pour afficher des images de chaque couche du modèle 3D à imprimer. L'écran agit comme un masque, et un laser UV sous l'écran polymérise la résine photosensible, durcissant la matière couche par couche.
- **Base mobile** : Le plateau de construction, sur lequel l'objet est formé, commence par être plongé dans un bain de résine liquide. Au fur et à mesure de l'impression, le plateau monte progressivement pour permettre à chaque nouvelle couche d'être imprimée.
- **Résine photosensible** : La résine utilisée est un liquide qui durcit sous l'action de la lumière UV, et chaque couche de l'objet imprimé est durcie de manière sélective selon le modèle 3D envoyé à l'imprimante.
- **Précision et détails** : Grâce à l'écran monochrome et la précision du laser, la Saturn 4 Ultra offre une haute résolution et longévité, permettant des détails fins et une finition lisse des impressions.
##### **Avant l'impression :**
Veuillez slicer votre modèle 3D au format .stl à l'aide du logiciel CHITUBOX, puis exporter votre fichier slicé .ctb sur une clé USB.
Assurez vous que la plaque de construction et le réservoir de résine sont propres et qu'il n'y a pas de bosses ou de bavures. Si c'est le cas, nettoyez les avec des serviettes en papier et de l'alcool.
#### **Processus d'impression :**
**1)** Allumer l'imprimante (le bouton d'alimentation est situé à droite de l'imprimante)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/b9Fimg-20250320-151820.jpg)
**2)** Au démarrage, l'imprimante effectue une **auto-vérification** de l'appareil, notamment des composants matériels clés pour éviter toute panne d'impression due à des dysfonctionnements matériels.
**Ne touchez pas l’imprimante pendant le processus d’auto-vérification.**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/7KSimage.png)
**3)** Remplissez le réservoir de résine à au moins 1/3 de son volume, mais ne dépassez pas la position de la ligne MAX. Si le niveau de résine est insuffisant, l'impression ne pourra pas débuter.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/ujBimage.png)
**4)** Couvrez le capot anti-UV de l'imprimante.
**5)** Insérez la clé USB contenant votre fichier préalablement slicé dans le port USB de l’imprimante.
**6)** Accédez au menu de l’écran tactile. Sélectionnez votre fichier slicé. Vérifiez les paramètres d’impression sur l'écran (type de résine, temps de durcissement, etc).
**7)** Appuyez sur **Démarrer l'impression** pour commencer.
**8)** Pendant l’impression, surveillez l’avancement pour vous assurer que la première couche adhère correctement à la plaque de construction. Si nécessaire, vous pouvez mettre l'impression en pause ou l'arrêter pour ajustez les paramètres.
##### **Une fois l'impression terminée:**
Soulevez la poignée pour retirer la plaque de construction et utilisez une spatule pour enlever délicatement le modèle.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/iS0image.png)
##### **Post-traitement** :
L'objet doit être nettoyé à l'alcool isopropylique (isopropanol) pour éliminer l'excédent de résine. Ensuite, il est essentiel de durcir l'impression sous lumière UV pendant quelques minutes afin de compléter la solidification.
Enfin, n'oubliez pas de nettoyez la plaque de construction et le réservoir de résine avec des serviettes en papier et de l'alcool.
##### **Caméra IA**
Dans l'interface de gestion de l'imprimante, vous pouvez activer la caméra AI pour observer la situation d'impression en temps réel. Vous pouvez également activer l'option time-lapse avant de commencer une impression. Les vidéos vont être sauvegardées dans l'historique.
Notes :
- La qualité de l'enregistrement peut diminuer sous de mauvaises conditions d'éclairage.
- Time-lapse ne peut être utilisée que lorsque la hauteur du modèle dépasse 50 mm. L'enregistrement de time-lapse commence à une hauteur de 30 mm et nécessite un temps de traitement supplémentaire après la fin de l'impression afin de générer les vidéos time-lapse. Le temps de traitement est directement proportionnel à la hauteur du modèle.
- L'appareil peut stocker jusqu'à 20 time-lapse vidéos. Une fois le stockage plein, les vidéos seront automatiquement remplacées dans l'ordre où elles ont été générées. Par conséquent, veuillez télécharger vos vidéos rapidement.
- Ce n'est que lorsque la hauteur du modèle dépasse 90 mm que la caméra AI détectera des conditions anormales telles que des anomalies sur la plaque de construction ou des bords déformés.
- Avec l'apprentissage continu, la détection et le jugement des anomalies par la caméra IA deviendront plus précis. Veuillez prêter attention aux informations de mise à jour de la caméra pour vous aider à accomplir vos tâches d'impression plus efficacement.
### **Précautions**
- Lors de l'utilisation de l'imprimante 3D, veuillez porter un masque et des gants pour éviter tout contact direct de la peau avec la résine photopolymère.
- Veuillez nettoyer le réservoir de résine avant de changer la résine pour une autre couleur.
- Veuillez ne pas utiliser d'outils tranchants ou pointus pour racler le réservoir de résine afin d'éviter d'endommager le film liner.
- En cas d'urgence lors de l'utilisation, veuillez d'abord éteindre l'alimentation de l'imprimante 3D.
- Si l'impression échoue, vous devez nettoyer l'excès de résine durcie dans le réservoir de résine et changer la résine, sinon cela pourrait endommager l'imprimante.
- Veuillez utiliser de l'alcool éthylique à 95 % (ou plus) ou de l'alcool isopropylique pour laver votre modèle, sauf si vous utilisez une résine lavable à l'eau.
##### **Utilisation de Chitubox (slicer):**
Il faut vérifier si les réglages du slice correspondent aux réglages optimaux pour la combinaison résine/imprimante. Pour référence, des indications sont données dans le tableau ci-dessous (information pas infaillible, a prendre comme premiers réglages à modifier lors de
| **Manufacturer** | **Resin Type** | **Resin Color** | **Layer Height** | **Bottom Layer Count** | **Bottom Exposure Time (s)** | **Exposure Time (s)** | **Light Off Delay (s)** | **Bottom Light Off Delay (s)** | **Lift Speed (mm/min)** | **Temperature (°C)** | **Retraction Speed (mm/s)** |
|---|
| **Anycubic** | **Basic** | **High Clear** | 0.05 mm | 5 | 35 | 10 | default | default | 90 | 25 | default |
Ces réglages sont à faire de manière suivante:
- Dans Chitubox, après l'avoir configuré en séléctionnant la bonne machine ( si le logiciel n'est pas encore configuré), passer toutes les autres dialogues jusqu'a arriver sur l'image du slice.
- [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/capture-decran-cbox-1.png)
- Dans slice settings, choisir print
- [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-03/capture-decran-cbox-2.png)
- régler les paramètres en accord avec le tableau
# Impression Résine : Paramètres, Conseils & Astuces
**Pour les Paramètres :**
**Hauteur de couche :** 0.05 en général, pas moins de 0.03 et pas plus de 0.1.
0.1 est bien pour les résines transparentes car elles laissent "trop" passer la lumières pour bien s'imprimer en fines couches.
**Nombre de Bottom Layers :** 4 à 6 (2 à 4 si avec couches de transitions)
**Nombre de Couche de Transitions :** 0 à 8
Normalement les couches de transition ne sont pas nécessaires, sauf pour certaines résines exotiques.
**Exposition des Couches Normales :** à Qualibrer.
Il faut normalement recalibrer dès qu'on change, mixe, ou pigmente des résines.
Cependant on peut approximer en changeant légèrement si on pigmente légèrement par exemple.
Plus la résine est transparente, plus le temps d'exposition doit être long.
Quand les pigments sont légers et blancs/clairs, il dispersent la lumière et on peut donc réduire le temps d'exposition, à l'inverse quand ils sont concentrés et noirs/foncés, ils absorbent trop et il faut garder un temps d'exposition élevé comme pour la résine transparente.
En général Résine Blanche < Colorée / Grise < Noire < Transparente Colorée < Transparente
**Exposition Bottom Layers :** Max 10x l'exposition normale, peut descendre à 4x l'exposition normale dans certains cas.
Étant donné que les premières couches sont celles qui fixent l'impression au plateau, il s'agit surtout de trouver un bon compromis entre "l'impression est bien fixé sur le plateau" et "l'impression n'est pas trop difficile à détacher du plateau".
Donc plus l'impression est petite, plus il est possible de baisser ce paramètre pour que retirer la pièce du plateau ne soit pas un calvaire.
**Rest Time Before Release :** 0.5s
Permet un temps mort à la résine pour arrêter sa polymérisation avant levage.
**Rest Time After Release :** 0.5s
Permet un temps mort au moteur pour bien partir dans l'autre sens.
**Rest Time After Retract :** 2s
Permet à la résine d'arrêter de bouger avant polymérisation.
Les impressions avec une grande section/surface de couche (+ de 5x5cm²) peuvent nécessiter + pour une qualité parfaite.
Plus la résine est visqueuse, plus il faut augmenter.
2 secondes suffisent pour la grande majorité des impressions et résines
Explication Complète : [https://ameralabs.com/blog/light-off-delay-blooming/](https://ameralabs.com/blog/light-off-delay-blooming/)
**Distance de Levage / Lift Distance :** 4 + 3 (7 mm total suffisent largement)
**Distance de Rétractation / Retract Distance :** 5.5 + 1.5 (paramètre pas très important)
**Bottom Lift Speed :** 15 mm/min (+ 1000 mm/min pour vitesse max)
Avoir une levée très lente sur les premières couches coute très peu en temps et permet de s'assurer qu'elles soient bien décollées.
**Lift Speed :** Entre 0 et 60 "safe" OU Entre 180 et 240 (jusqu'à 300 pour film ACF) (+ 1000 mm/min pour vitesse max)
Il faut éviter les vitesses entre
**Retract Speed :** 180 + 60 mm/min "safe" ou 1000 + 300 "rapide"
**Bottom Tolerance Compensation :** b -0.1mm (quand imprimé directement sur le plateau, pour réduire le grossissement des premières couches)
**Anti Aliasing Level :** 4 (Dépend des résines, mais trop long et dur à calibrer, 4 est bien dans la majorité des cas)
Explication Complète : [https://www.liqcreate.com/supportarticles/explained-tested-anti-aliasing-aa-and-blur-in-resin-3d-printing/](https://www.liqcreate.com/supportarticles/explained-tested-anti-aliasing-aa-and-blur-in-resin-3d-printing/)
# Transfert de protéine semi-sec sur membrane
L'immunobuvardage est une technique servant à détecter une protéine. Pour pouvoir réaliser l'immunobuvardage, il est nécessaire dans un premier temps de séparer les protéines présentes au sein du gel et de les transférer sur une membrane. La machine présenté ci-dessous permet de réaliser ces deux tâches.
La séparation des protéines se fait par Electrophorèse. Sous l'effet d'un champs électrique, la séparation des particules se fait en fonction de leur charge et/ou de leur taille. Justement, cet outil permet de créer ce champs électrique.
[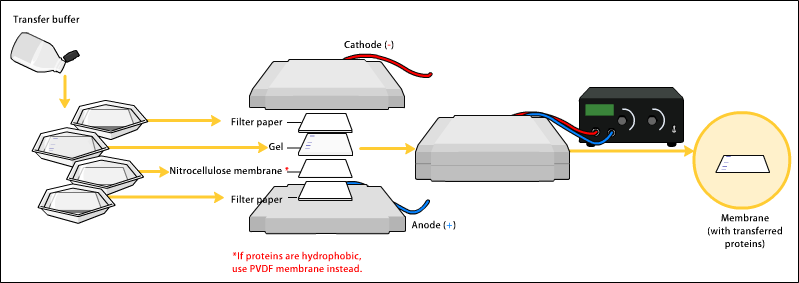](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/kgPimage.png)
Utilisation :
- déposer deux filtre papier entre les deux plaques
- entre les deux papier, déposer la membrane sur laquelle les protéines vont être transférés ainsi que le gel
- bracher la plaque du haut à la borne négative d'un générateur (i.e la masse) et la plaque d'en dessous à la borne positive du générateur.
Attention : il faut faire attention à ne pas dépasser la tension maximal qui est de **200 volts DC** (direct current) et le courant qui est de **200 mA**. Voici une formule du champ électrique vous permettant d'ajuster la tension afin d'avoir le champ souhaité : **E = |U|/d**
**d** : distance entre les deux plaques
**U** : tension parcourant les deux plaques
Le temps de la manipulation peut varier selon le type de gel et de la membrane utilisé.
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/img-5937.JPG)
# Caméra Microscope
# Installation de la caméra sur le microscope
1. Sortir le boitier et l'adaptateur microscope de la boite et les assembler. (Bien penser à enlever les embouts de protections avant d'assembler)
2. inserer la caméra dans la lunette droite du microscope (Se mettre bien perpendiculaire pour ne rien abimer) ou dans la 3ème lunette verticale pour les microscope Optika B-193PL (voir la page "[Microscope Optika B-193PL | Wiki FablabSU](https://wiki.fablab.sorbonne-universite.fr/BookStack/books/appareils-biologie-chimie/chapter/microscope-optika-b-193pl)")
3. Brancher le chargeur de la caméra a une prise secteur.
4. brancher la cable hdmi à écran (ici la télé du labo)
5. brancher l'embout USB de la souris afin de pouvoir intéragir avec l'image envoyée sur la téléarte SD
Quelques exemples de prises de vue :
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/d0Aimg-0005.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0013.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0026.jpg)
cristaux de cuivre II sulfate cristaux de glucose coupe feuille
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0036.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0038.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0040.jpg)
coupe feuille (2), stomates racine (1), poils absorbants racine(2), poils absorbants
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0048.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-03/img-0010.jpg)
cheveux de Maryam Chlamydomonas
# New Page
#
# Présentation de la caméra microscope OPTIKA-CHB
Boîte en carton avec caméra du microscope Optika:
- Caméra
- Adaptateur
- Carte SD (perdue ou volée)
- Lame spéciale pour le microscope (cassée)
- Cable HDMI
- Cable d'alimentation
- Souris spéciale pour le microscope
# Manuel d'instructions
Le manuel d'instructions et les spécifications de la camera est disponible a telecharger sur la page d'optika.
[https://www.optikamicroscopes.com/optikamicroscopes/product/c-hb/](https://www.optikamicroscopes.com/optikamicroscopes/product/c-hb/)
**Cette camera ne peut pas être branchée dans un pc, le cable USB est dessinée pour être utilise uniquement avec le souris.**
# Détecteur à diffusion de lumière évaporative basse température
SEDERE LT-ELSD SEDEX 80LT
# Notice d'utilisation de l'appareil
[https://www.knauer.net/Dokumente/detectors/third\_party/manuals/sedere\_elsd\_80\_manual\_\_rev3.0\_\_release.pdf](https://www.knauer.net/Dokumente/detectors/third_party/manuals/sedere_elsd_80_manual__rev3.0__release.pdf)
# Spectromètre FT-IR, spectrum two (ATR)
##### **1. Généralités**
##### **Principe **
La **spectroscopie d'absorption infrarouge** est une méthode d'analyse principalement **qualitative** qui examine les vibrations moléculaires. Cette technique permet ainsi d'identifier la nature des liaisons chimiques et des groupements fonctionnels présent dans une molécule. Elle est largement utilisée pour la caractérisation et l'identification des molécules organiques et minérales. De plus, la loi de Beer-Lambert s'applique dans le domaine de l'infrarouge, rendant cette méthode également **quantitative.**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-07/XrXimage.png)
**Spectromètre FT-IR, spectrum two (ATR), Perkin Elmer**** (1)**
*(1)http://chimie-sete-iutms.phototendance.com/fiche-technique/24\_spectrometre-infrarouge.pdf*
##### **Caractéristiques **
- **Gamme spectrale :** de 350 à 8300 cm⁻¹
- **Résolution :** 0.5 à 8 cm-1
- **Détecteur :** DTGS (sulfate de triglycéride)
- **Compensation** de Vapeur Atmosphérique (AVC)
- **Analyse :** en transmission (cellule liquide et pastille solide)
- **Analyse :** en ATR, réflexion totale atténuée
- **Logiciel :** spectrum 10
Ce spectromètre utilise la technique ATR (atténuation totale par réflexion), qui repose sur l'utilisation de deux diamants : l'un est légèrement concave et l'autre convexe. Ces deux diamants s'emboitent pour emprisonner et comprimer les liquides ou solides.
##### **Applications **
- **Analyses environnementales :** détermination des hydrocarbures ; des huiles et des graisses dans l'eau et dans les sols
- **Analyses chimiques et matériaux :** caractériser de nouveaux produits ; identifier des contaminants des produits ; vérifier la qualité des matériaux.
- **Analyse agro-alimentaires** : Analyse des constituants majeurs des aliments (eau, protéines, glucides, lipides) ; analyse d'acide gras dans les produits laitiers (lait) ; analyse de l'alcool, des polyphénols, des acides organiques, et des arômes de vin ; analyse des céréales, des viandes et des produits carnés.
- **Analyse pharmaceutique :** identifier et vérifier des matière brutes, intermédiaires et produits formulés ; identifier les contaminants et les impuretés dans les études de sécurité des produits.
**Avantages :** ne nécessite pas de préparation particulière des échantillons. **Inconvénients :** ne permet pas d'analyser les gaz.
##### **2. Procédure d'utilisation du Spectromètre FT-IR, spectrum two (ATR)**
##### **Nettoyage de l'appareil **
Avant toute utilisation, assurez-vous que la surface de l'appareil est propre. Pour cela, nettoyez le diamant avec de l'isopropanol ou du méthanol en effectuant des mouvements circulaires. Séchez ensuite la surface avec un essuie-tout.
##### **Acquisition d'un spectre **
1\. Assurez vous que l'appareil est bien branché en USB sur le PC (voyant vert = allumé).
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/1729171566661.jpg)
2\. Ouvrez le logiciel "***Spectrum IR***" depuis le bureau. Une fenêtre apparaitra, saisissez ensuite l'identifiant et le mot de passe suivant:
*[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/1729170966466.jpg)* **Login :** fablabuser
**Password :** fablabpass
*[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/1729170966444.jpg)*
3\. Vérifier de nouveau que l'appareil est bien connecté à l'ordinateur via la barre de tache en bas a droite.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-03/image-1679046373799.png)4. Faites le background (**sans l’échantillon !** ) en cliquant sur l’icône "**B***a**ckground***".
En spectroscopie IR, le "Background désigne la mesure de l'environnement ambiant sans la présence de l'échantillon, pour obtenir un spectre de référence.
5\. En haut à gauche de la fenêtre, entrer nom de l'échantillon à analyser dans "*Nom de l'échantillon*" et si nécessaire une description dans "***Nom composé***".
*[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/1729170966411.jpg)*
6\. Placez l'échantillon sur la surface de l'ATR. Si vous analysez un liquide peu visqueux, l'utilisation de la jauge de contrainte n'est pas nécessaire. En revanche, celle-ci est indispensable pour l'analyse de solides ou de liquides visqueux. Pour utiliser la jauge de contrainte, déposez l'échantillon sur l'ATR, puis tournez la manivelle (préciser le sens) afin de faire descendre la tige et compresser l'échantillon. Continuez à tourner la manivelle jusqu'à ce que vous entendiez un "***clic***".
*[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/1729170966390.jpg)*
7\. Cliquez une première fois sur "***Analyse***" pour afficher l'aperçu du spectre de l'échantillon, puis une seconde fois pour obtenir le spectre final.
8\. Pour afficher les valeurs des nombres d'ondes correspondant à chaque pic du spectre, cliquez sur "***Pics***".
9\. Enregistrez le spectre sur l'appareil.
##### **3. Précautions**
Ne pas éteindre l'appareil après utilisation. Ne jamais déplacer la jauge de contrainte en position abaissée, au risque de rayer le diamant.
##### **4. Exemple**
Dans cet exemple, nous allons réaliser un spectre IR d'un solvant : l'.
1. Faites le "***Background***".
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-03/image-1679049107399.png)
2\. Déposez quelques gouttes de votre échantillon d'acétone.
3\. Saisissez "***Acétone***" comme nom d'échantillon.
4\. Cliquez une première fois sur "***Analyse***" pour afficher un aperçu, puis une seconde fois pour obtenir le spectre final.
5\. Cliquez sur "***Pics***".
6\. Enregistrez le spectre sur l'appareil.
[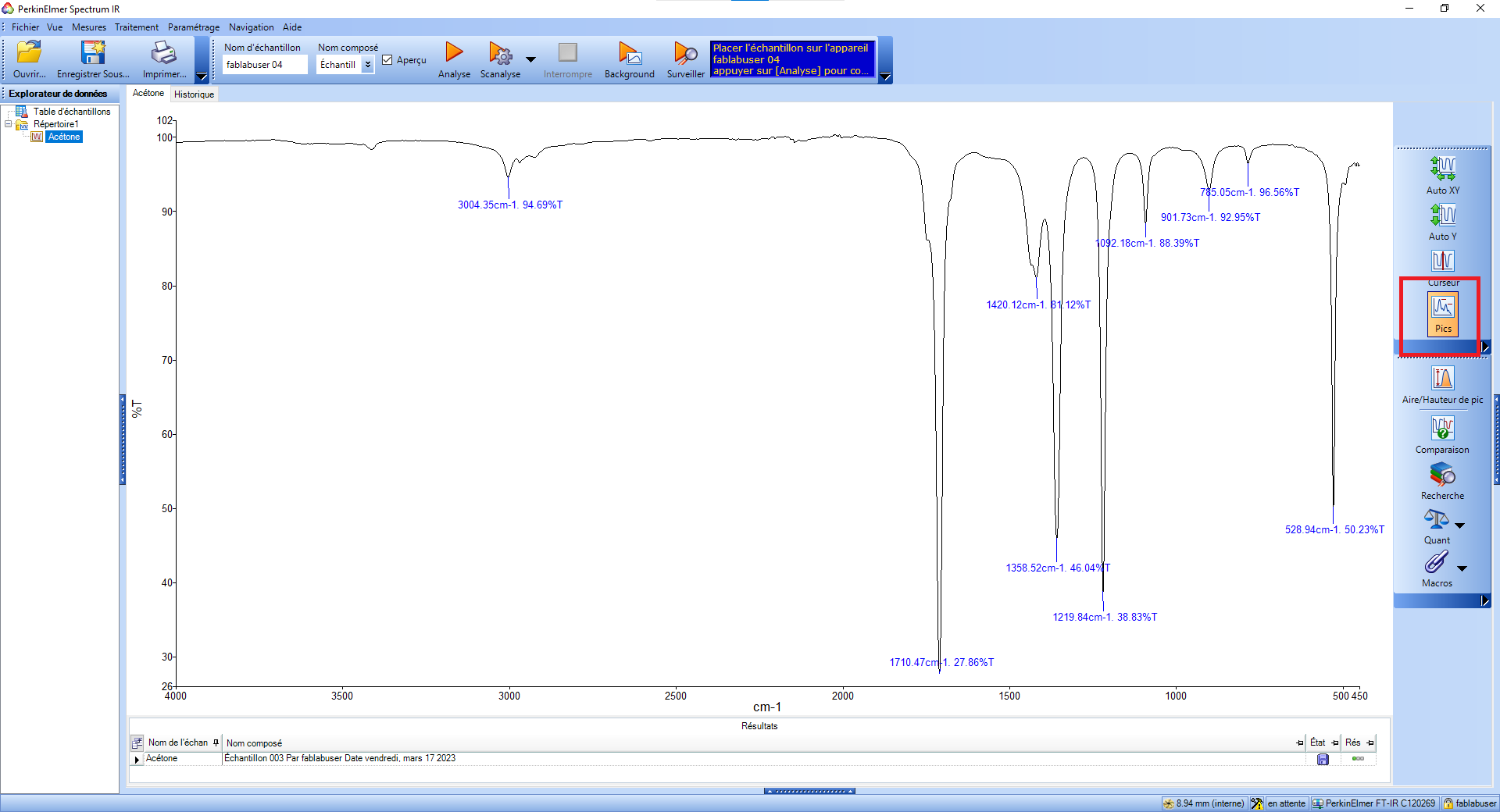](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-03/image-1679047802770.png)***Spectre d'absorption Infrarouge de l'acétone***
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-03/table-ir.jpg)
Pour aller plus loin, voici des exemples de lectures intéressantes :
1. *Interpretation of Infrared Spectra, A Parctical Approach, John Coates, Encyclopedia of analytical Chemistry, [https://doi.org/10.1002/9780470027318.a5606](https://doi.org/10.1002/9780470027318.a5606)*
2. *Analyse chimique, Méthodes et techniques instrumentales : Francis Rouessac et Annick Rouessac, Dunod, 9eme édition*
# Four tubulaire haute qualité - Zetasinter
Le four Zetasinter permet de fritter les objets imprimés en 3D avec les filaments de la marque Nanoé, pour obtenir des objets en céramique ou en métal.
# Essais du four : frittage de pièces cubiques en Zircone
**1. Contexte et objectifs **
Dans le cadre des premiers essais réalisés avec le four tubulaire (Nanoe), une série d’échantillons a été produite par impression 3D, puis soumise aux processus de déliantage et de frittage. L’objectif principal de ces essais était d’évaluer la qualité du frittage de pièces en céramique, en se concentrant notamment sur la densité et la rétraction des pièces finales.
**2. Procédure d’impression des échantillons**
Pour fabriquer les échantillons, nous avons utilisé un filament commercial de zircone YSZ (zirconium stabilisé à l’yttrium) de la marque Zétamix (Nanoe). Ce filament, d’un diamètre de 1,75 mm, est composé à parts égales de poudre YSZ et de liant. (1) Le modèle utilisé pour la fabrication des échantillons a également été fourni par Zétamix, et se présente sous forme de cubes avec des marquages X, Y, Z sur les faces.
Quatre échantillons ont été imprimés, dont deux n’ont pas été entièrement terminés. En effet, comme aucune application spécifique est attendu dans ce contexte, la géométrie des échantillons n’a pas d’importance. Les échantillons ont été fabriqués à l’aide d’une imprimante 3D à dépôt de filament fondu (Raise 3D Pro2) équipée d’une buse de 0,4 mm de diamètre. Une image optique des pièces imprimées, ainsi que les paramètres d’impression utilisés, sont présentés respectivement dans la **figure 1 et 2**.
| 
| 
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/embedded-image-ka3aatbx.png)
| \*[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/embedded-image-wu2jpzug.png)
|
| 
| 
|
| **Corps1**
| **Corps 2**
| **Corps 3 (droite) et 4 (gauche)**
|
***Figure 1 : Image optique des quatre "corps verts" après impression***
| - **Nozzle diameter :** 0.4 mm
- **Layer height :** 0.2 mm
- **Infill pattern :** à chercher
- **Infill density** : à chercher
- **Infill overlap** : à chercher
- **Nozzle temperature** : 180°C
- **Speed :** 10 mm.s-1
- **Heat bed temperature :** 40°C
|
***Figure 2 : Image numérique du modèle de l’échantillon (a) avec les paramètres d’impression (b)***
Après impression, les échantillons ont été laissés à l’air libre pour un séchage initial avant d’être préparés pour les étapes suivantes. A ce stade, les échantillons sont appelés « corps verts », un mélange de poudre céramique YSZ et de liants organiques (polymères). Pour obtenir les pièces finales, deux étapes supplémentaires sont nécessaire : **le déliantage et le frittage**. Ces post-traitements sont cruciaux pour obtenir des pièces finales denses et composées uniquement de céramique.
La première étape, **le** **déliantage**, est particulièrement critique car c'est là que les premières porosités apparaissent dans la pièce. Cette étape permet d’éliminer le liant de la structure et se divise en deux phases : **le déliantage chimique et thermique.** Le déliantage chimique dissout le premier composant (soluble binder) tandis que le déliantage thermique élimine le deuxième composant, appelé "backbone", en le chauffant au-delà de sa température de dégradation, comme illustré dans **la figure 3**.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-09/debinding-3dprinting-ceramic.png)***Figure 3 : Schéma de la composition des corps vert pendant le processus de déliantage (chimique et thermique)
***
**3. Déliantage**
** 3.1 Déliantage chimique**
Le déliantage chimique des échantillons, a été réalisé en utilisant les équipements suivants :
- Un bain à ultrasons avec option de chauffage (Nanoe),
- De l’acétone (WVR Chemicals, pureté 99,8 %)
- Une balance de précision (KERN)
- Les corps verts imprimés en 3D
Chaque échantillon a été pesé à l'aide d'une balance avant d'être immergé dans un bain d'acétone chauffé à 40 °C.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/hPbimg-7392.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/Axeimg-7393.jpg)
**Figure 4 : Images du matériel utilisé pour le déliantage chimique (a) et du corps vert immergé dans un bain d’acétone (b)**
La durée d'immersion des pièces dépend de leur épaisseur, le fabricant recommandant un trempage de 4 heures par millimètre de paroi pleine. Toutefois, l'épaisseur exacte des parois, définie lors de la conception, n'étant pas précisément connue (car réalisé par une autre personne), notamment pour les pièces finies **(corps 3 et 4)**, il a été décidé de les immerger jusqu'à atteindre une perte de masse d'au moins 5 %. Pour suivre cette évolution, des mesures de masse ont été effectuées environ toutes les heures.
Lors de ce processus, des délaminations sont apparues sur les corps 3 et 4. Cela serait probablement dû au fait que :
- Les pièces ont été immergées avant que le bain d'acétone n'ait atteint les 40 °C, et/ou
- Les pièces ont été retirées trop tôt du bain d'acétone pour vérifier la perte de masse, puis remises dans le bain.
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/a95img-7399.jpg)
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/l7zimg-7402.jpg) | [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/w02img-7400.jpg)
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/9nzimg-7401.jpg)
|
***Figure 5 : Image optique du corps vert 4 après déliantage chimique***
**Remarque :** Pour les pièces 3 et 4, les délaminations sont apparues durant la première heure dans le bain d'acétone, sans pour autant avoir été retirées du bain.
**Recommandations du fabricant**
Pour les prochains essais, il faudra être particulièrement attentif à immerger les pièces uniquement lorsque la température du bain d'acétone aura atteint 40 °C. De plus, il ne faudra pas retirer les pièces pour vérifier la perte de masse. Il est préférable de connaître précisément l'épaisseur des pièces et d'en déduire la durée d'immersion nécessaire pour atteindre une perte d'au moins 5 % en masse.
Par ailleurs, en cas de doute, il est recommandé par le fabricant de prolonger le trempage des pièces aussi longtemps que possible, voire jusqu'à ce que l'acétone refroidisse naturellement. Il serait même préférable de laisser la pièce refroidir dans l'acétone pendant une demi-journée avant de la sortir. (3)
| **Corps verts** | **Corps 1**
| **Corps 2**
| **Corps 3**
| **Corps 4 (marqué au crayon à papier)**
|
| **Vinitiale (post-impression)** | 4,937 cm3
| 6,491 cm3
| 8,027 cm3 | 8,214 cm3 |
| **Vfinal (après déliantage chimique)** | N/A
| 6,267 cm3 | 7,864 cm3 | 7.959 cm3
|
| **Delta V (Vinitiale - Vfinal)**
| N/A
| 0,224 cm3 | 0,163 cm3 | 0.255 cm3
|
| **Perte de volume en %
** | N/A
| 3.5 %
| 2.03 %
| 3.1 %
|
| **minitiale (avant déliantage)
** | 9.9936 g
| 13.1396 g
| 18.5592 g | 19.9485 g
|
| **mfinale (aprés déliantage chimique)**
| 9.1783 g
| 12.3107 g
| 17.3486 g
| 18.3885 g
|
| **Delta m (minitiale - mfinale)**
| 0.8153 | 0.8289 | 1.2106 | 1.56
|
| **Perte de masse en %**
| **8.2 %** | **6.3 %**
| **6.5 %** | **7.8 %**
|
**3.2 Déliantage thermique (pré-frittage) et frittage**
Cette opération a été réalisé dans le four tubulaire Zetasinter (Nanoe).
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/img-7361.jpg)
Les pièces ont été déposé sur le creuset. Ce processus a été réalisé dans le four avec la programme suivant :
- **Montée en température :**
- **Maintien à 500°C** : pendant 2 heure pour s’assurer la dégradation complète du liant.
- **Refroidissement :** jusqu’à température ambiante du four (50°C).
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-09/LqIimage.png)
***Figure 4 : Cycle thermique standard (pour les petites pièces) de pré-frittage des pièces en filament de Zircone blanc selon les recommandations du fournisseur ***(2)***
***
Ce cycle thermique a été utilisé uniquement pour l'échantillon 1, car il a rendu la pièce trop fragile, au point qu'elle s'est désintégrée sous une légère pression. Nous avons donc supposé que ce cycle n'était pas approprié, puisqu'il se basait sur une ancienne version du guide des cycles thermiques pour ce type de filament. Pour les échantillons 2, 3 et 4, nous avons suivi les recommandations du fabricant en combinant le déliantage thermique et le frittage selon la version actualisée du guide. Le programme choisit était le suivant :
- **Montée en température :**
- **Maintien à 500°C** : pendant 2 heure pour s’assurer la dégradation complète du liant.
- **Refroidissement :** jusqu’à température ambiante du four (50°C).
[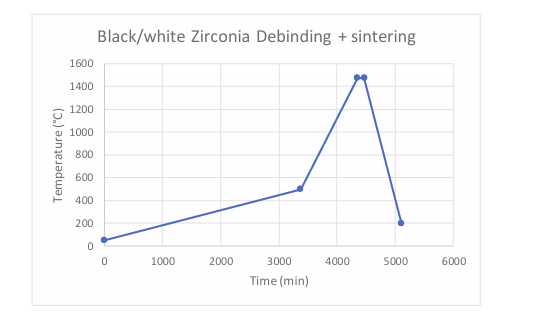](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/msbimage.png)
***Figure 4 : Cycle thermique standard de pré-frittage et frittage des pièces en filament de Zircone blanc selon les recommandations du fournisseur ***(4)
| **Échantillons** | **Échantillon 1**
| **Échantillon 2**
| **Échantillon 3**
| **Échantillon 4 (marqué au crayon)** |
| **V (après déliantage thermique et frittage)** | N/A
|
|
|
|
|
|
|
|
|
|
| **mfinale (après déliantage thermique et frittage)** | N/A
|
|
| |
**5. Résultats**
**5.1 Observation macroscopique**
Comme prévu, les échantillons ont révélé une réduction significative de taille. La surface est devenue lisse et brillante, ce qui témoigne d'un bon niveau de frittage. Cependant, des fissures ont été observées sur les échantillons 3 et 4. En effet, ces fissures, une fois formées, sont irréversibles et restent visibles même après le frittage des pièces.
**6. Conclusion **
Ce procédé, combinant le déliantage et le frittage, se révèle être une méthode prometteuse pour la fabrication de pièces céramiques de haute précision et de haute performance. Cependant, la durée du déliantage (thermique) et frittage reste très longue. De plus, il a été montrer que manipuler un même cycle était préférable
Pour optimiser davantage la qualité des pièces, il serait pertinent d'expérimenter avec différents cycles de déliantage et de frittage.
(1) [https://zetamix.fr/wp-content/uploads/2023/11/Datasheet-Zetamix-White-Zirconia.pdf ](https://zetamix.fr/wp-content/uploads/2023/11/Datasheet-Zetamix-White-Zirconia.pdf)
(2) [https://www.machines-3d.com/images/Image/File/Fiches%20techniques/ACCESSOIRES/NANOE/Furnace-cycles.pdf](https://www.machines-3d.com/images/Image/File/Fiches%20techniques/ACCESSOIRES/NANOE/Furnace-cycles.pdf)
[(3) Fissures/délaminations à la suite du déliantage chimique – Zetamix](https://zetamix.fr/troubleshooting/fissures-delaminations-a-la-suite-du-deliantage-chimique/)
(4) [Furnace-cycles.pdf](https://zetamix.fr/wp-content/uploads/2024/02/Furnace-cycles.pdf)
| **Pièce cubique en Zircone**
| **Volume du cube**
**(après déliantage thermique et frittage)**
|
| **Masse finale en g (après déliantage thermique et frittage)** |
| **Pièce cubique 1**
|
|
|
|
| **Pièce cubique 2**
| 327 cm3
| 322.1 cm3
|
|
| **Pièce cubique 3**
|
|
|
|
| **Pièce 4 (marqué au crayon)**
|
|
|
|
# Mise en route
Opérations réalisées par **C. Simon, 22/11/2023.**
Dès la mise en route, en branchant le four, on entend une turbine qui se met en action.
Un voyant vert "Power" s'allume en façade, mais le contrôleur de température reste éteint. Il faut basculer l'interrupteur "Lock" pour pouvoir enclencher l'alimentation du contrôleur.
Les documentations originales de Nanoé sont ici :
[zetasinter tubular operation manual.pdf](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/446)
La documentation n'est pas difficile à suivre, et il est inutile de la reprendre ici. C'est à peine plus compliqué qu'un programmateur de four domestique.
La première mise en fonction nécessite un traitement de la chambre à 300°C pour 2h.
Le programme de chauffe est indiqué dans la notice : je crois comprendre que la montée va durer 85 min (période t01).
On observe le chauffage progressif, par impulsions inférieures à 1s de 80 à 90A sous 20V, la ligne de base du courant s'élevant progressivement (20-30 A sous 10V lorsqu'on atteint 85°C par exemple). Chaque impulsion provoque des vibrations audibles (au niveau de la turbine pré-citée ?).
A 90°C, l'ensemble de la carcasse est restée froide. L'ensemble des éléments métalliques accessibles (gainage du tube, bouchons) restent froids. Le dessus du four est également à température ambiante, sauf peut-être au centre (circulation d'air ?)
A 150°C, la grille qui ceint le tube tiédit, du côté droit uniquement. Le côté gauche reste à température ambiante (pourquoi ?).
Après 30 min à 300°C, on prend les clichés suivants :
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/iri-20231122-200623.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/iri-20231122-200606.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/iri-20231122-200555.jpg)
(images prises avec une caméra PC210 Guide-IR de la plateforme de physique. La plage de mesure est limitée à 550°C)
On voit que la grille monte plus haut à droite qu'à gauche, mais reste non-brûlante. Le cordon d'alimentation électrique étant moins sollicité, sa température se stabilise autour de 30°C.
Ultérieurement, lors de la baisse de température, une nouvelle prise montre que la grille de droite est montée à 80°C, ce qui peut présenter un risque de brûlure. Il faudra donc prévoir une signalétique appropriée.
La différence de température droite/gauche s'explique peut-être par le fait que l'introduction du gaz de balayage est censé se faire par la droite. **A vérifier**.
La première montée à haute température (au-delà de 400°C) nécessitera une passivation des éléments chauffants, en montant à 1200°C pour 2h. Elle est prévue pour le lendemain, 23/11. Ce sera également l'occasion de tester certains paramètres de qualité de l'air.
Opération réalisée par **F. Zouhir, le 27/05/2024.**
Pour la mise en service du four, deux cycles thermiques doivent être réalisés. Le premier cycle, à 300°C, permet de conditionner le tube d'alumine, suivi d'un second cycle à 1200°C pour passiver les éléments chauffants (résistances en siliciure de molybdène MoSi2). L'intérêt étant d’éviter tout endommagement de ces éléments.
Le premier cycle à 300°C a été effectué le 22/11/2023, et le second cycle à 1200°C devait suivre le jour suivant (23/11/2023) mais n’a pas été réalisé. Par précaution, il a donc été décidé de refaire ce premier cycle.
**Étape 1 : Cycle de cuisson "baked cycle"**
Au cours de cette étape, le four est chauffé pendant 2 heures à 300°C. Le cycle comprend 4 étapes. Tout d'abord, le programme commence à 50°C (température ambiante du four). Ensuite, le four monte de 50°C à 300°C (étape 1). Cette montée en température dure 85 minutes, avec une rampe de chauffage de 2.9°C/min, soit 176°C/h. La température est ensuite maintenue à 300°C pendant 120 minutes (étape 2). Après 2 heures à 300°C, le four redescend à 100°C en 65 minutes (étape 3) et avec une rampe de refroidissement de 3.3°C/h, soit 200°C/min.
| Cycle | Étapes | Code | Durée totale
|
"baked cycle" | 1 | C01 | 50°C | 4h30 |
| t01 | 85 min |
2 | C02 | 300°C |
| t02 | 120 min |
3 | C03 | 300°C |
| t03 | 65 min |
4 | C04 | 100 °C |
| t04 | -121 |
[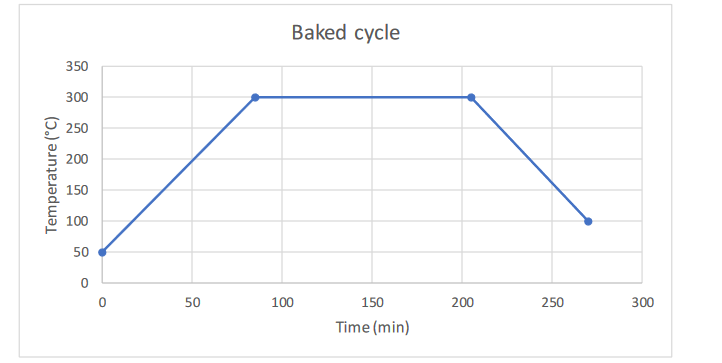](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/k8iimage.png)
Le chauffage se fait de manière progressif avec des impulsions toutes les secondes à 80-90 A sous 20V. De plus, chaque impulsion génère des vibrations. A environ 100°C, la carcasse et les grilles du four sont accessible au touché (froides).
A 300°C, la carcasse est chaude mais reste encore accessible au touché (néanmoins prévoir une signalétique adéquate pour des température supérieure à cette température°C).
Voici quelques clichés prise avec la caméra thermique fluke.
Concernant, le deuxième cycle (passivation des éléments chauffants). Elle est prévue demain, le 29/05/2024.
Opération réalisée par **F. Zouhir, le 29/05/2024.**
Comme prévu, le deuxième cycle de passivation des éléments chauffants a été lancé.
**Étape 2 : Cycle de passivation "passivation cycle"**
Tout comme le premier cycle, le four est chauffé pendant deux heures mais cette fois-ci à 1200°C. Le cycle comprend également 4 étapes et dure 14h30. Le programme commence à 50°C (la température ambiante du four) puis monte à 1200°C pendant 385 min (étape 1) soit durant 6h41. La rampe de chauffage est 179°C/h. Ensuite, le four est maintenu a cette température pendant 120 min (étape 2). Après 2h à 1200°C, le four redescend à 100°C. La durée de la descente est de 365 min, soit environ 6h (étape 3). La rampe de refroidissement est de 181°C/h pour cette étape.
| Cycle | Étapes | Code | Durée totale
|
"Passivation cycle" | 1 | C01 | 50°C | 14h30 |
| t01 | 385 min |
2 | C02 | 1200°C |
| t02 | 120 min |
3 | C03 | 1200°C |
| t03 | 365 min |
4 | C04 | 100 °C |
| t04 | -121 |
[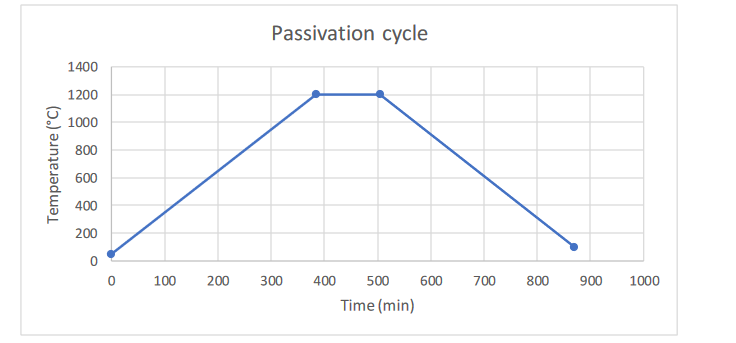](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/7yDimage.png)
| Température du four (°C)
| Intensité (A)
| Tension (V)
| Température de la salle (°C)
|
| 250
| 80-90
| 10
| 20.6
|
| 650
| 80-90
| 20-30
| 20.6
|
| 850
| 70-80
| 30-40
| 20.6
|
| 900
| 65-70
| 40-50
| 20.8
|
| 950
| 65-70
| 50
| 20.9
|
| 1050
| 70
| 50-60
| 21.1 |
| 1200
| 70
| 70
| 21.4
|
La carcasse du four est très chaude. La grille droite est plus chaude que la grille gauche (??)
Les programmes de chauffe "baked et passivation cycle" sont disponible dans le guide d'utilisation à l'adresse suivante : [https://zetamix.fr/wp-content/uploads/2024/02/ZETASINTER-TUBULAR-OPERATION-MANUAL.pdf](https://zetamix.fr/wp-content/uploads/2024/02/ZETASINTER-TUBULAR-OPERATION-MANUAL.pdf)
Le fabricant conseille d'installer ce four sous un système d'extraction adéquat (hotte) en raison des vapeurs produites par la décomposition des polymères utilisés comme liants. Il est donc nécessaire de prévoir l'installation d'une hotte pour le four.
# Confection des objets de référence
Le déliantage et le traitement thermique sont annoncés comme causant une contraction de l'objet imprimé à la fois reproductibles et isométrique.
Il est important de le vérifier et mesurer ce facteur de contraction.
Le mieux est probablement de repartir de l'idée du cube aux faces marquées X-Y-Z, et de le produire de plusieurs tailles, pour obtenir une abaque contraction/taille. Mais la chambre est cylindrique, et tous les objets n'auront pas une enveloppe cubique. Il semble donc utile de prévoir également un objet de référence allongé.
# Compteur automatique de colonies
VWR®Auto lite
EUROPEAN CATALOGUE NUMBER: 710-2072
Cet appareil permet de compter automatiquement le nombre de colonies présentes dans un échantillon donné, grâce à un algorithme.
# Présentation de l'appareil
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/w65image.png)
Le compteur de colonies vous permet d'obtenir une approximation du nombre de colonies présentes dans une boîte de Pétri, grâce à l'utilisation d'un logiciel Autolite affilié et d'une caméra présente dans l'appareil. Celle-ci vous permet d'obtenir des images en directes de vos colonies. Les paramètres mesurés sont ensuite fournis sous la forme d'un compte-rendu, directement fourni par le logiciel.
Pour plus d'informations sur ce modèle, vous pouvez vous rendre sur le site du fabricant [ici](https://fr.vwr.com/store/product/34973691/vwr-auto-i-lite-i-compteur-automatique-de-colonies "Lien fabricant Autolite")
Cet appareil présente des avantages :
Permet une estimation rapide du nombre de colonies d'un échantillon
Permet d'effectuer cette estimation avec les mêmes paramètres sur un grand nombre d'échantillons
Permet d'obtenir des résultats déjà formatés
Mais aussi des inconvénients :
Ne fonctionne que pour les colonies contrastées
Ne produit qu'une aide au comptage, et non un comptage parfaitement précis
Tous ces paramètres sont à prendre en compte au moment des mesures.
# Guide d'utilisation de la machine
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/img-0178.jpg)
Si vous avez besoin de plus de renseignements que ceux présents sur cette page, vous pouvez consulter le manuel d'utilisateur en anglais [ici](https://fr.vwr.com/assetsvc/asset/fr_FR/id/35416263/contents/manual-vwr-colony-counter-auto-lite-en-200521.pdf "Manuel d'utilisation")
#### 1. Allumage de l'appareil
- Brancher la prise d'alimentation de l'appareil
- Brancher la machine à l'ordinateur via son câble USB
- Brancher la clé USB produit (violette) sur l'ordinateur pour faire démarrer le logiciel.
- Ouvrir le logiciel avec clic droit **exécuter en tant qu’administrateur** en demandant gentiment le code au Fabmanager
- Éclairer la zone en sélectionnant un des 3 modes d’éclairage à l’aide de l’unique bouton noir sur la face avant
- Placer la boîte de pétri fermée
#### 2. Comptage :
##### a. d'une nouvelle série
- Créer une nouvelle série
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/eF4capture-decran-2025-01-30-161600.png)
- Sélectionner le type de lot approprié : ''Boîte ensemencée en masse'', ''Boîte ensemencée en spirale'' avec ou sans dilution
[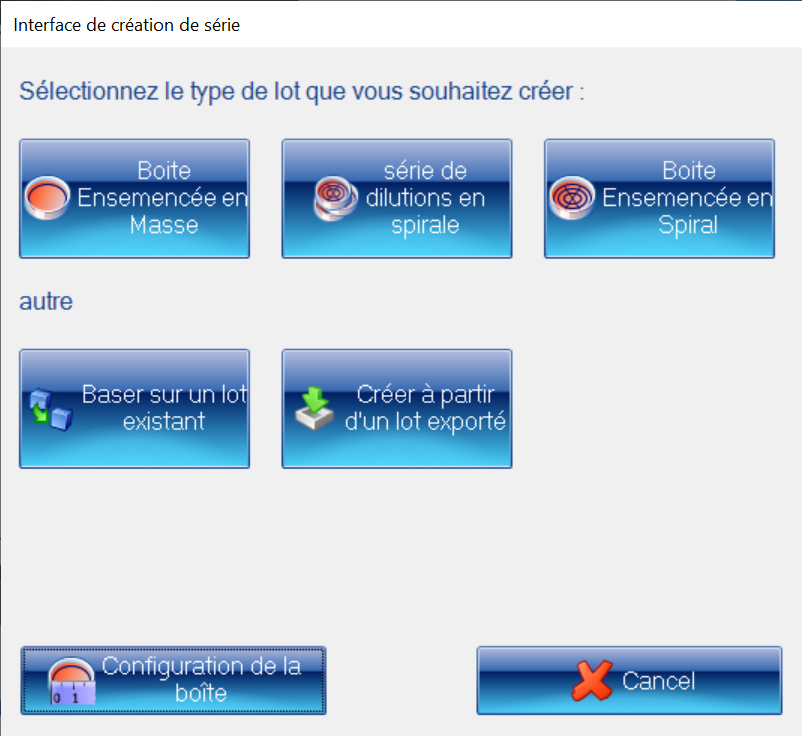](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173257.png)
- Calibrer l’échelle dans ''Configuration de la boite'' avec une distance connue (avec une règle ou avec le diamètre de la boite) ainsi que les facteurs de dilution en spirale ou la taille maximale des colonies
[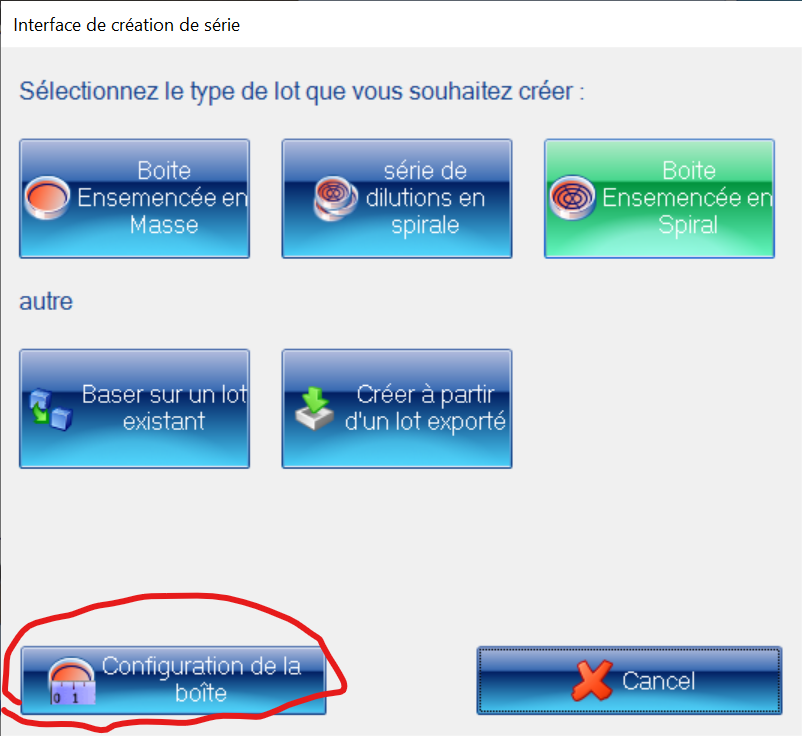](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173140.png)[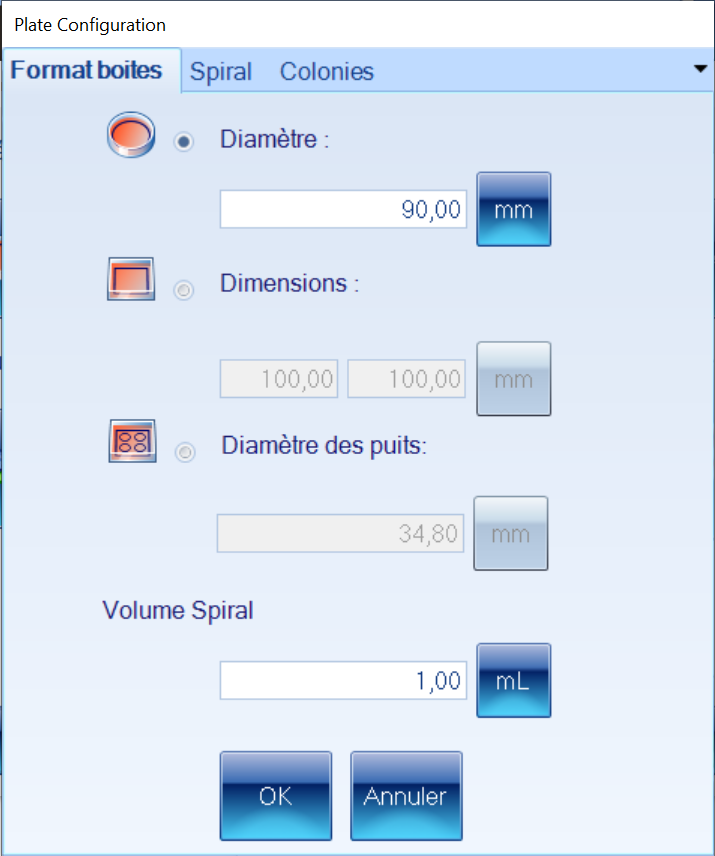](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173209.png)
- Régler l'exposition avec le curseur dans l'onglet ''Image''
[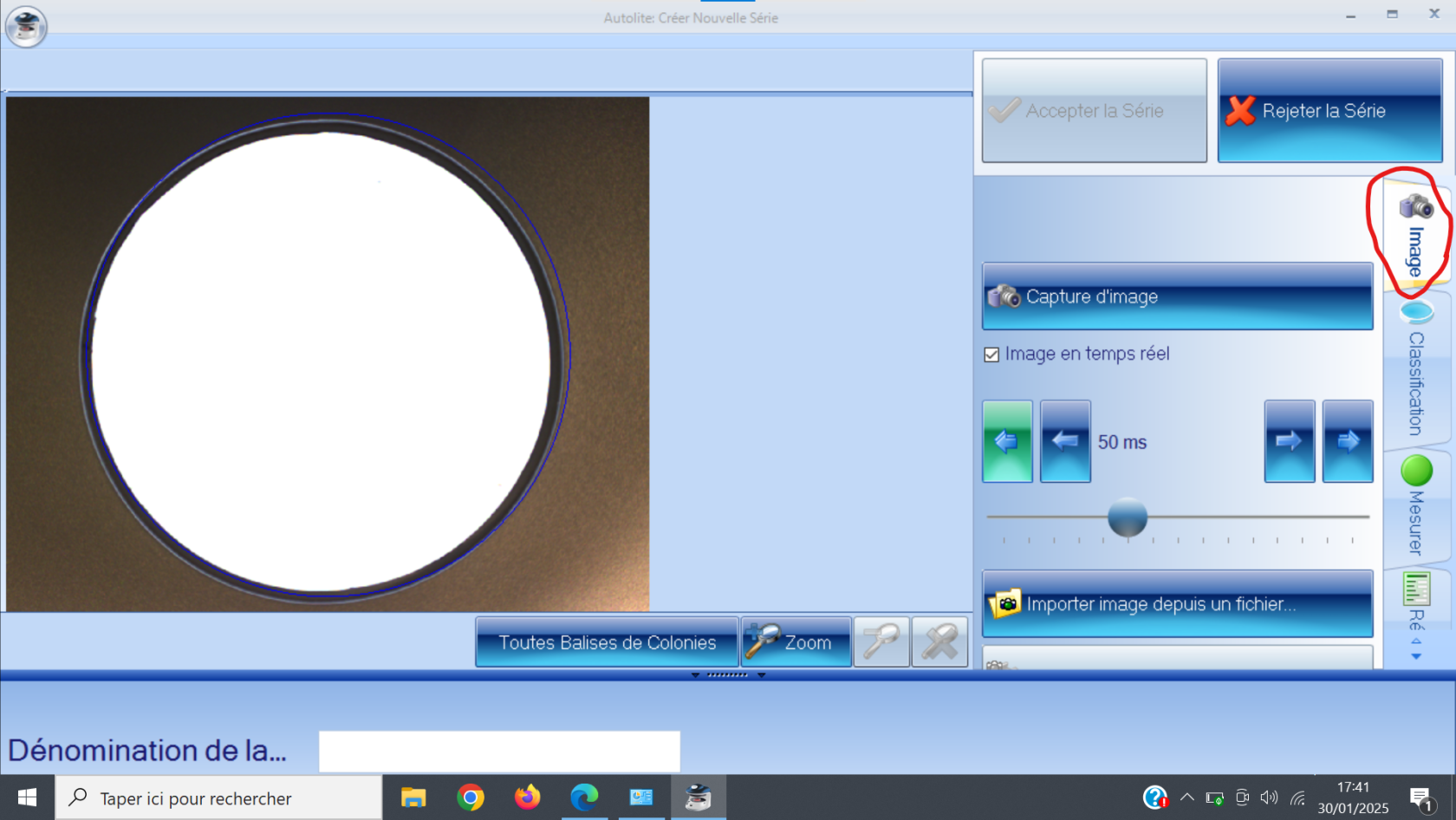](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/rsbcapture-decran-2025-01-30-174123.png)
- Régler le cadre de la boite dans l'onglet "Classification"
[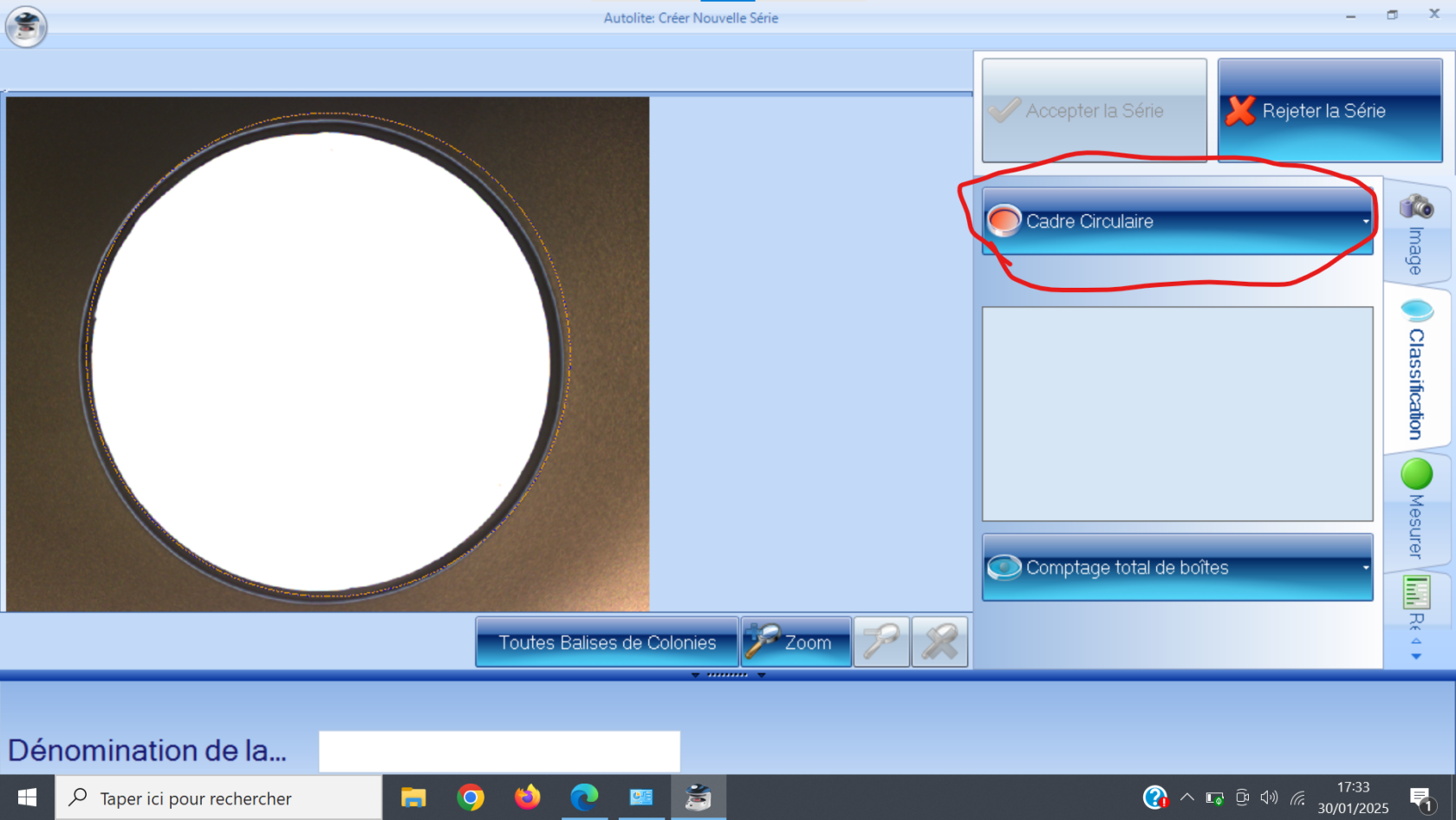](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173321.png)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173209.png)
- Cliquer sur “Comptage total de boîtes” dans l'onglet ''Classification'' pour choisir si les colonies sont plus/moins claires que le fond (utiliser le disque noir si besoin pour augmenter le contraste.
[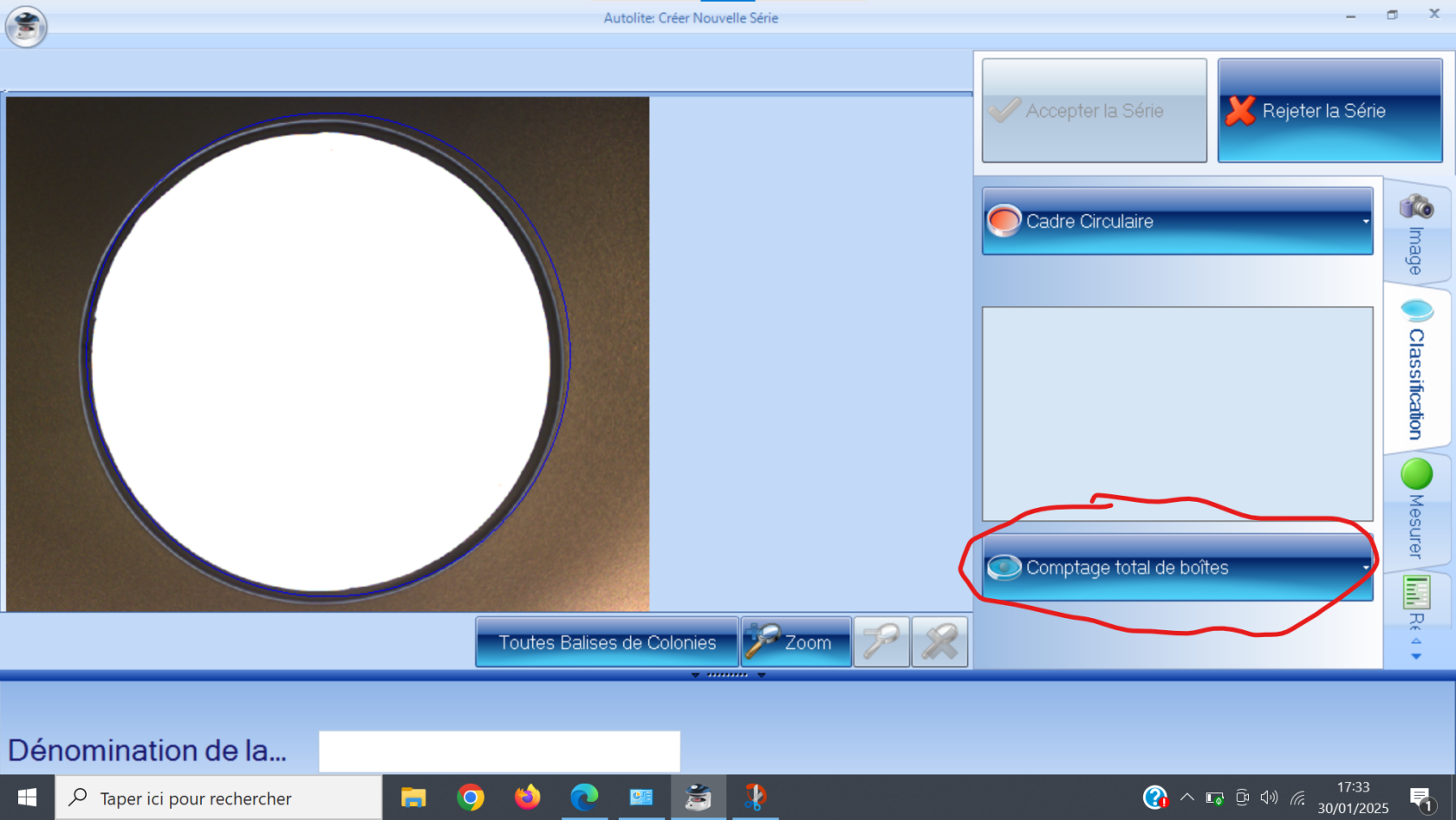](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173409.png)
- Une fois la création de la série validée, vous ne pourrez plus modifier ce paramètre
- Ajuster la sensibilité et la taille minimum des colonies mesurées dans la même fenêtre avec les curseurs-> Vous pouvez alors visualiser les colonies marquées par le logiciel, et choisir la couleur ou les balises permettant de repérer les colonies
[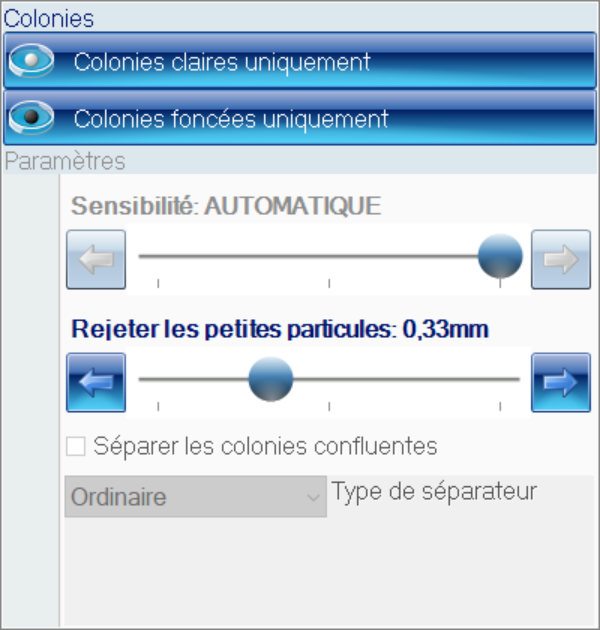](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173353.png)
Pour être précis, il faut baisser le curseur "Rejeter les petites particules: 0,33mm". Dans la négative, des petites particules (bactéries) inférieures à 0,33mm, ne seront pas prises en compte dans notre étude.
- Nommer votre boîte de Pétri de référence dans l'onglet ''Mesurer''
[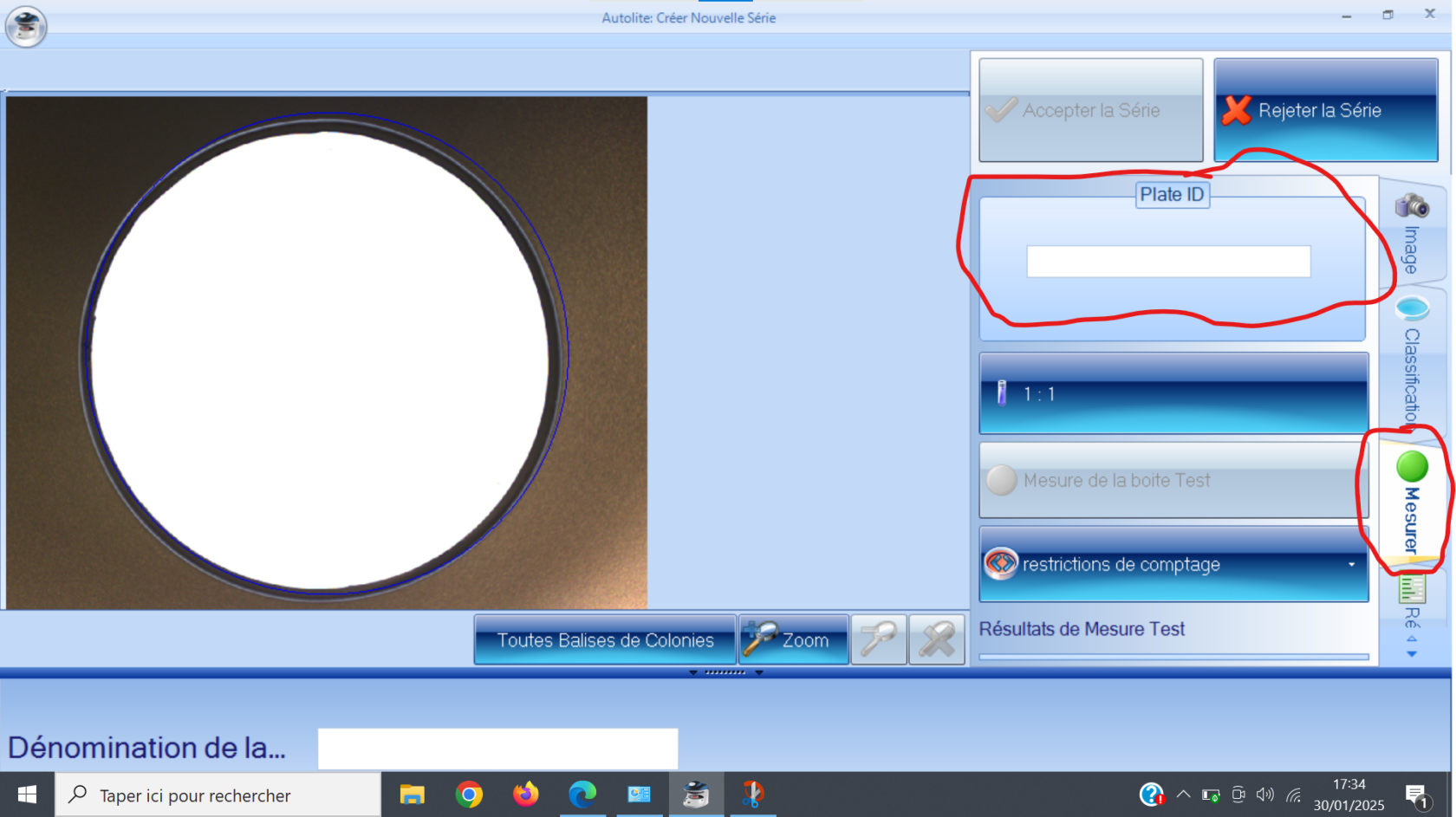](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173454.png)
- Modifier le facteur de dilution selon vos besoins dans la case ''Plate ID''[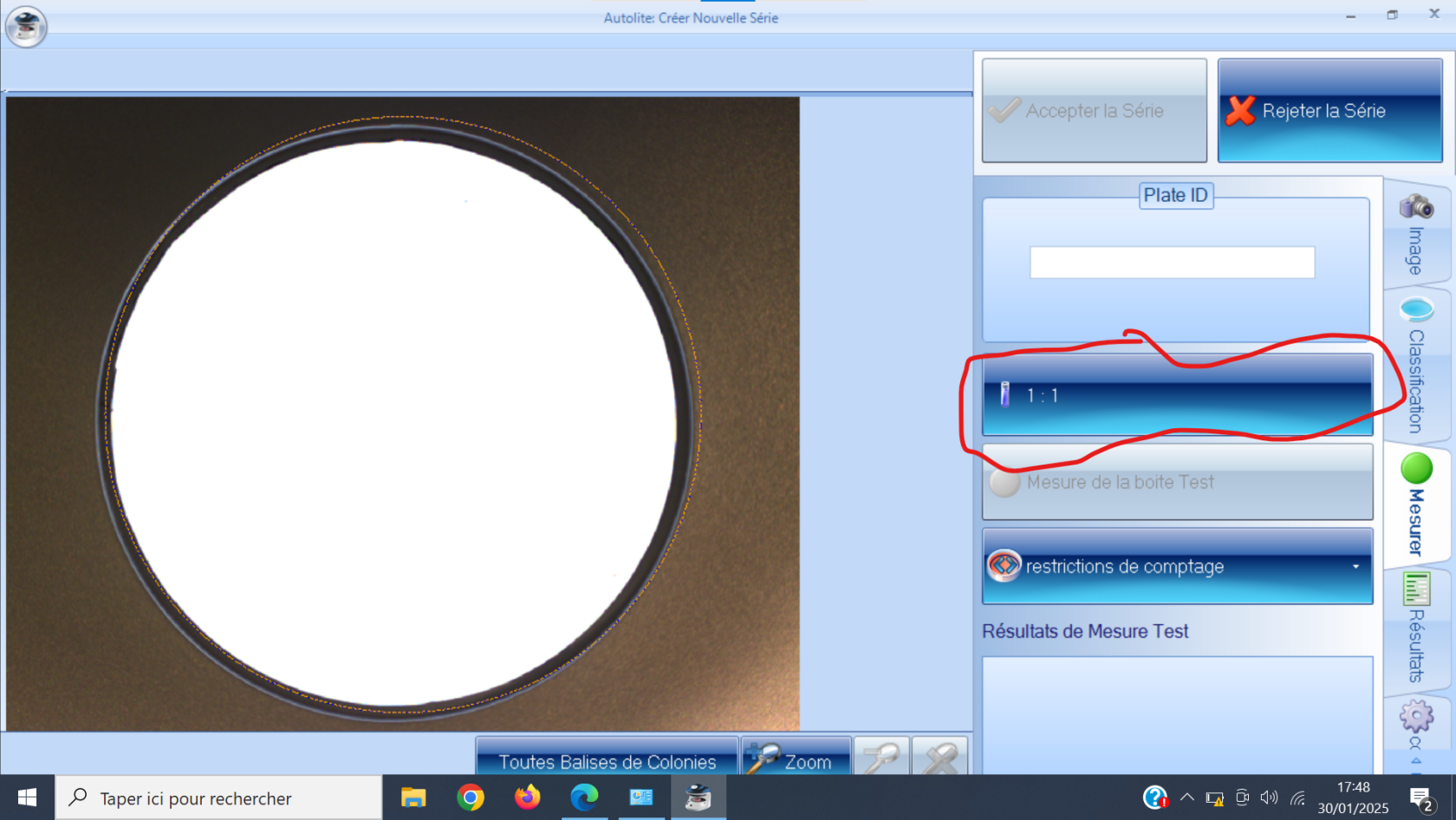](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-174910.png)
- Effectuer une mesure test pour vérifier que le logiciel identifie bien toutes les colonies en appuyant sur l'icône ''Mesure de la boîte Test"
[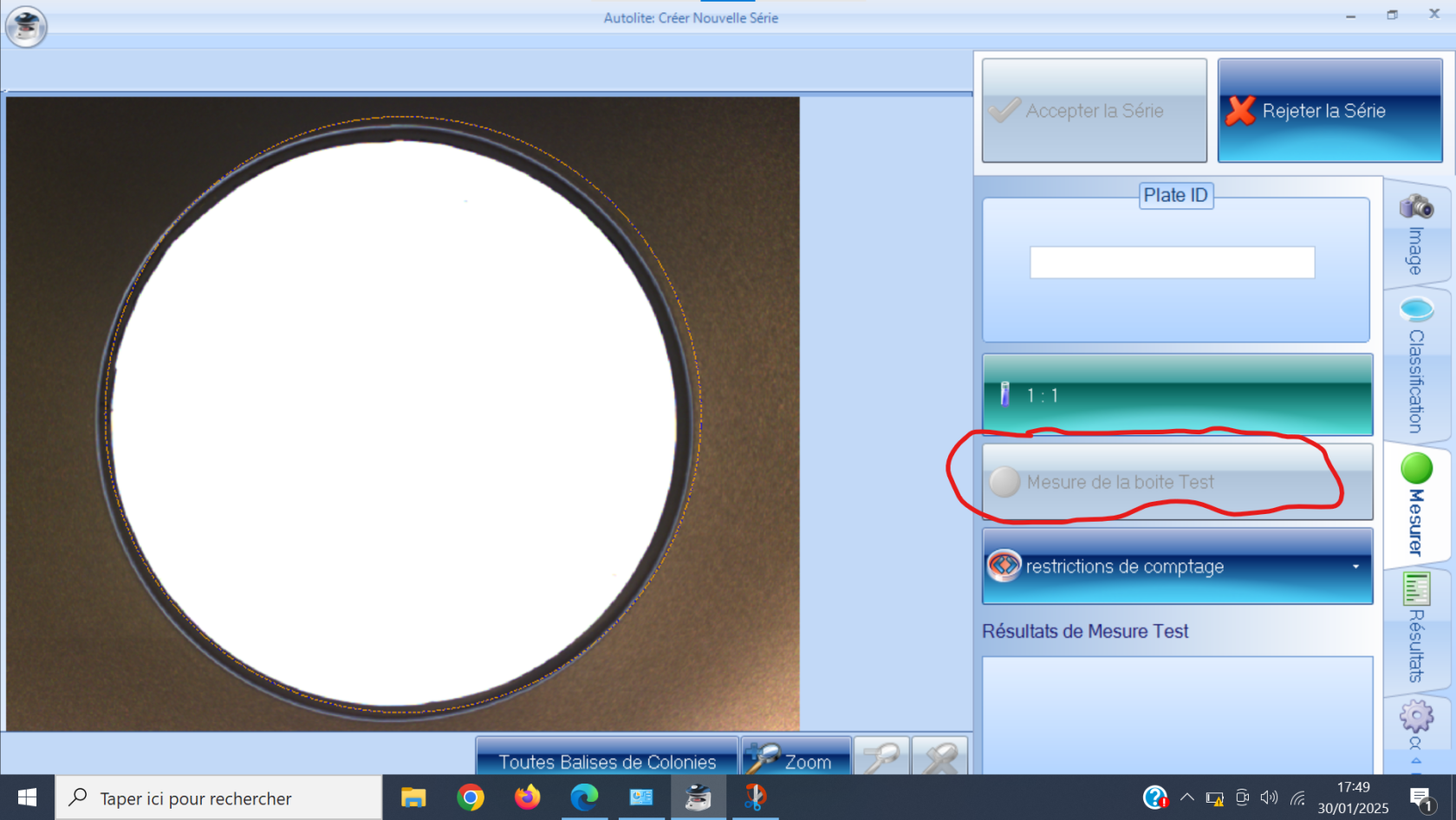](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-174954.png)
- Dans l'onglet ''Résultats'', vous pouvez sélectionner les paramètres retenus
[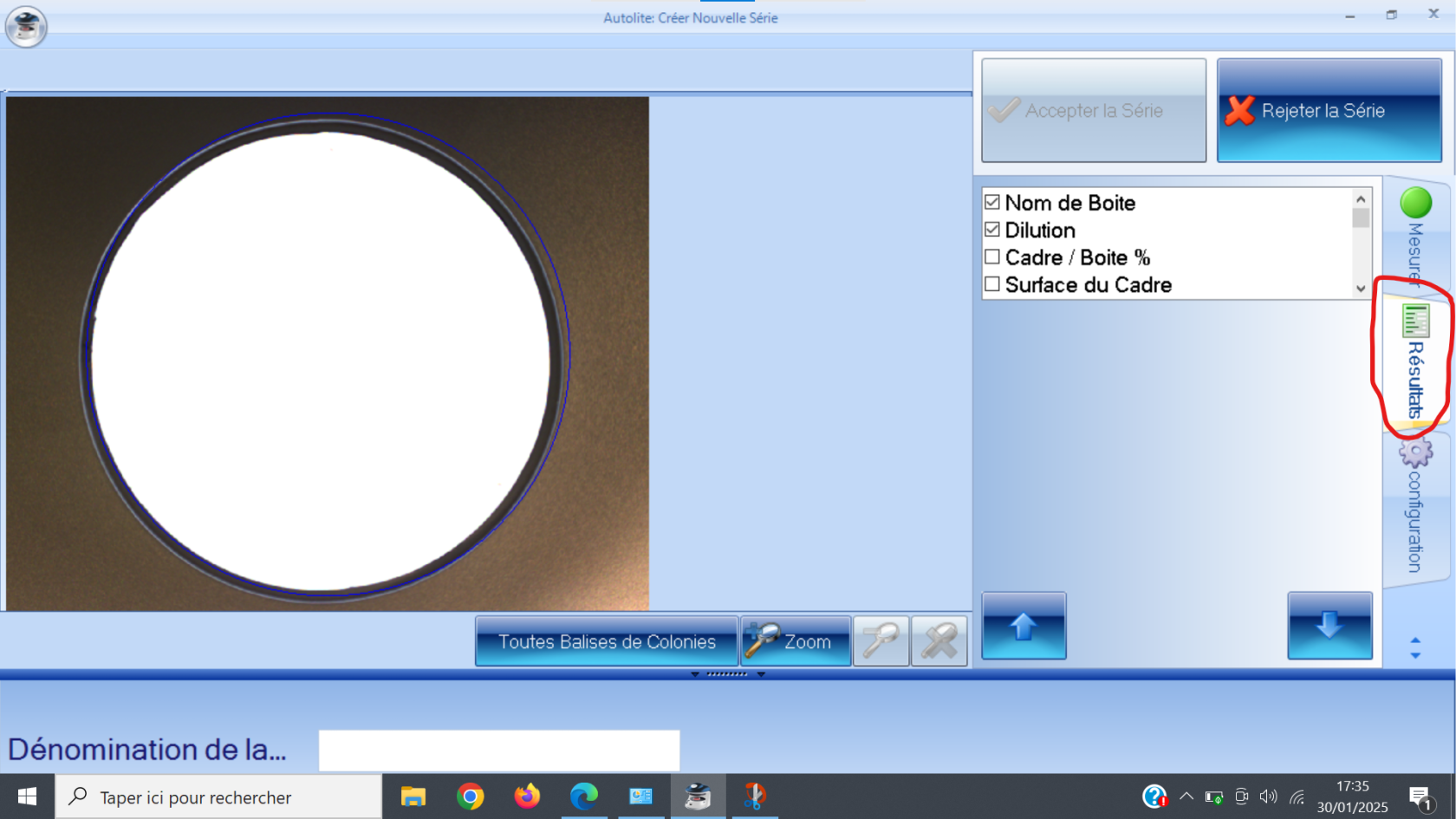](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-173543.png)
- Dans l'onglet ''Configuration'', vous pouvez définir le mode de dénomination des différentes boîtes : par incrémentation, par code-barre ou d'après une liste d'échantillons pré-existante
[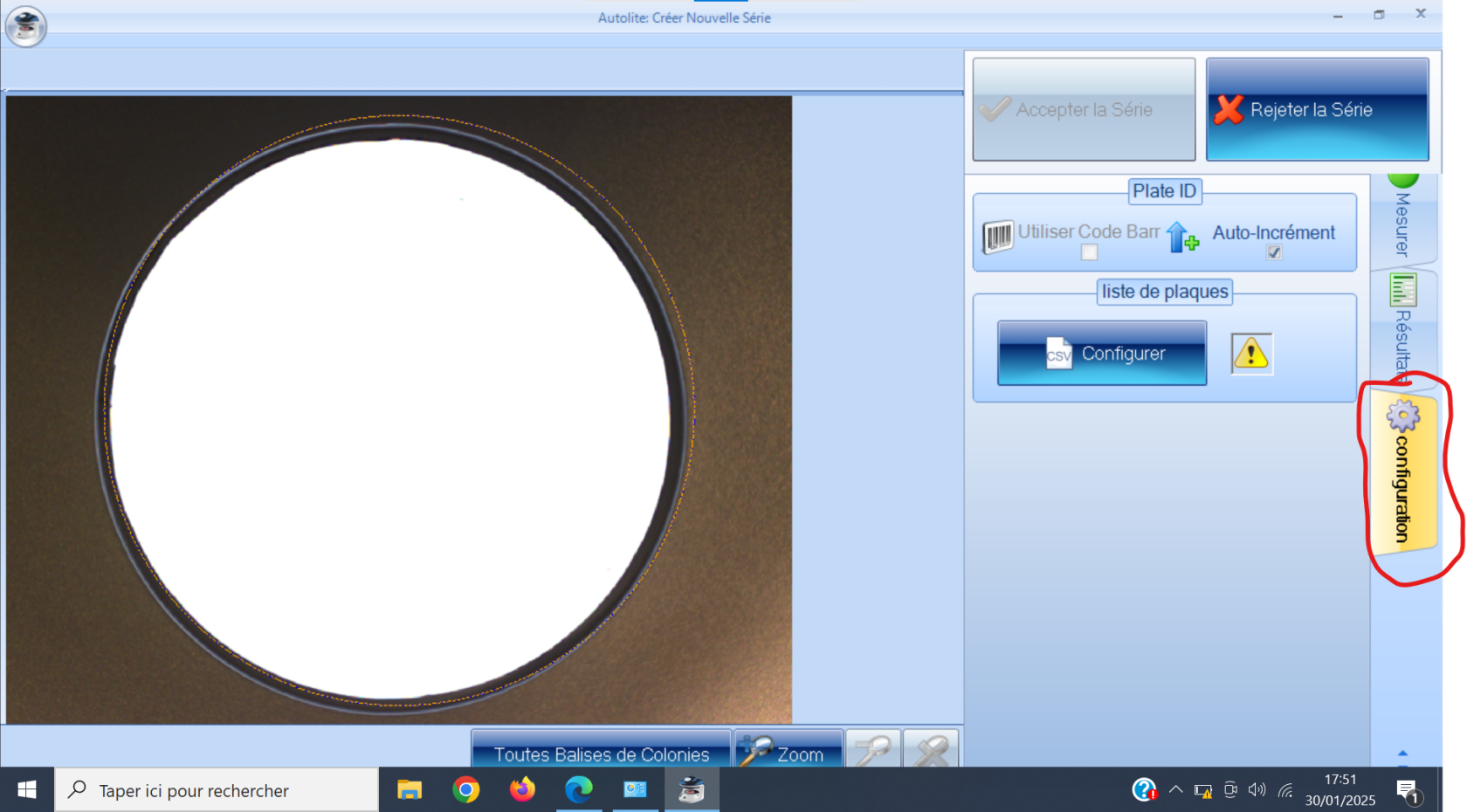](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-175147.png)
- Pour finaliser la création de la série, lui donner un nom dans le rectangle ''Dénomination de la série''
Sans nom, vous ne pourrez pas créer votre série
- Cliquer sur ''Accepter la série''
##### b. d'une série préexistante
- Cliquer sur ''Ouvrir série"
- Sélectionner la série de votre choix
- Reprendre le comptage où vous l'aviez laissé
- **A la fin de l'utilisation** : fermer votre série dans le gestionnaire de série et aller dans réglage --> quitter Autolite
#### 3. Résultats
Si vous le souhaitez, le logiciel peut conformer pour vous les résultats sous la forme d'un compte-rendu. Pour cela :
- Aller dans le menu ''Autolite'' en haut à gauche
- Sélectionner ''Exporter les données''
- Choisir le dossier d'arrivée et exporter vos données
# Guide d'installation du software
Avant d'utiliser le programme Auto Lite, il faut d'abord procéder à l'installation du software. Pour ce faire, quelques prérequis:
- Être connecté sur un profil administrateur sur le PC
- La clé USB "YOUR IMAGING SOFTWARE"
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/img-0606.jpeg)
- La clé USB d'authentification
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/img-0607.jpeg)
Insérer la clé USB "YOUR IMAGING SOFTWARE", la trouver dans l'explorateur des fichiers:
I/ Vérifier l'installation de Microsoft .NET Framework:
- Aller dans AutoLite-1-3-14>Support>Framework, ouvrir l'exécutable "SetupFramework". Si le programme est déjà installé, le message "Microsoft .NET Framework 4.0 is already installed" s'affichera. Dans le cas échéant suivre les instructions à l'écran et compléter l'installation.
II/ Installer SQL Server:
- Aller dans AutoLite-1-3-14>Support>Database, ouvrir l'exécutable "SetupA3SqlServer":
- S'il y a seulement un utilisateur sur le PC, choisir l'option "SQL LocalDB" sur la première page de l'assistant d'installation. Suivre les instructions à l'écran pour terminer l'installation.
- Si l'on souhaite donner accès au programme à plusieurs profils utilisateurs sur le même ordinateur, choisir l'option "SQL Server Express" sur la première page de l'assistant d'installation. Suivre les instructions à l'écran pour terminer l'installation.
- Redémarrer l'ordinateur.
III/ Installer le programme Auto Lite:
- Ouvrir le dossier AutoLite-1-3-14, ouvrir l'exécutable "Setup". Suivre les instructions à l'écran.
- Redémarrer l'ordinateur.
IV/ Ajout des autorisations pour les profils utilisateurs concernés:
- Ouvrir le panneau de configuration.
- Aller dans Panneau de configuration>Système et sécurité>Outils d’administration, puis ouvrir "Gestion de l'Ordinateur".
- Trouver l'onglet "Utilisateurs et groupes locaux" dans la colonne tout à gauche de la fenêtre qui s'ouvre, puis choisir "Groupes".
[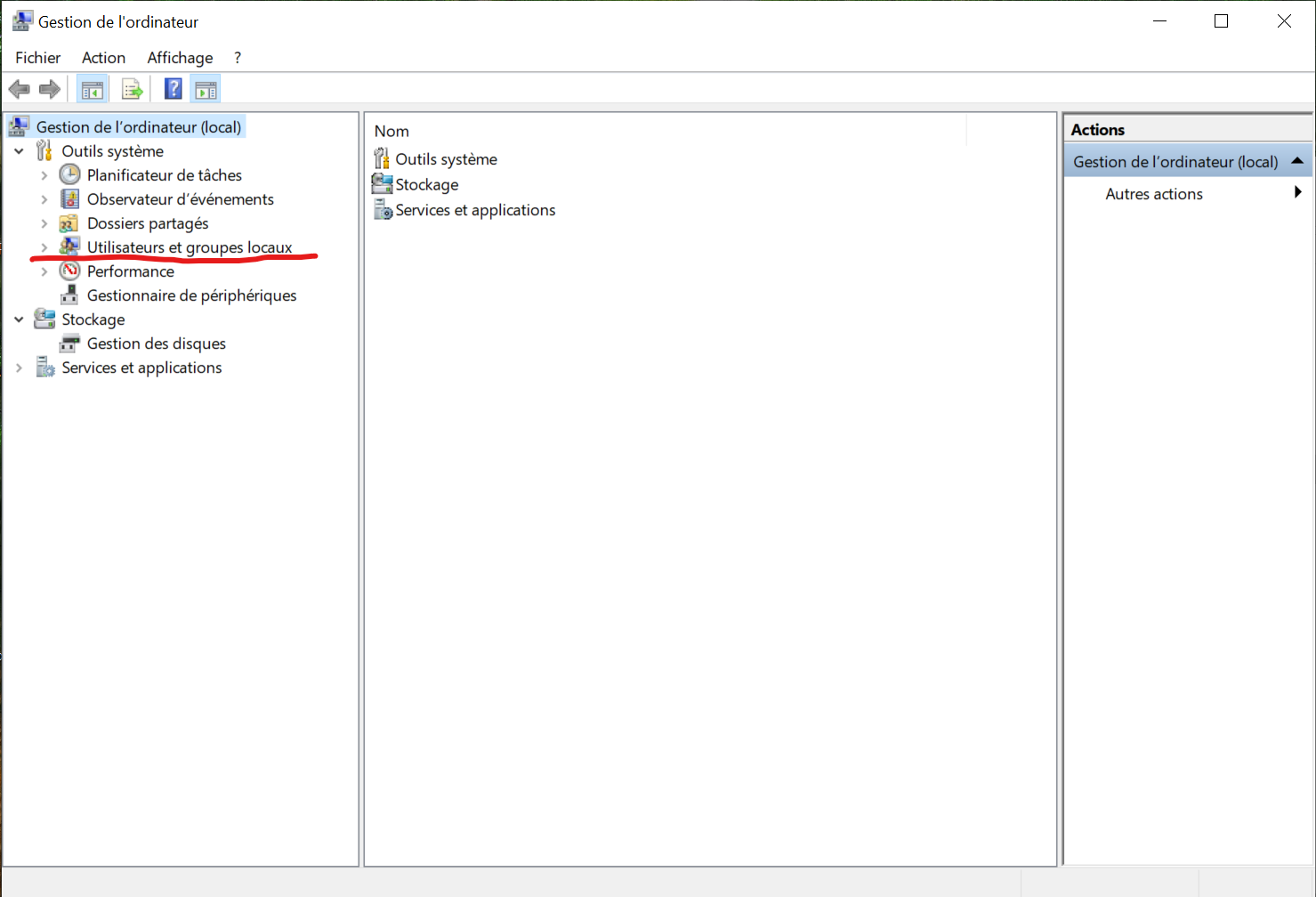](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-161357.png)[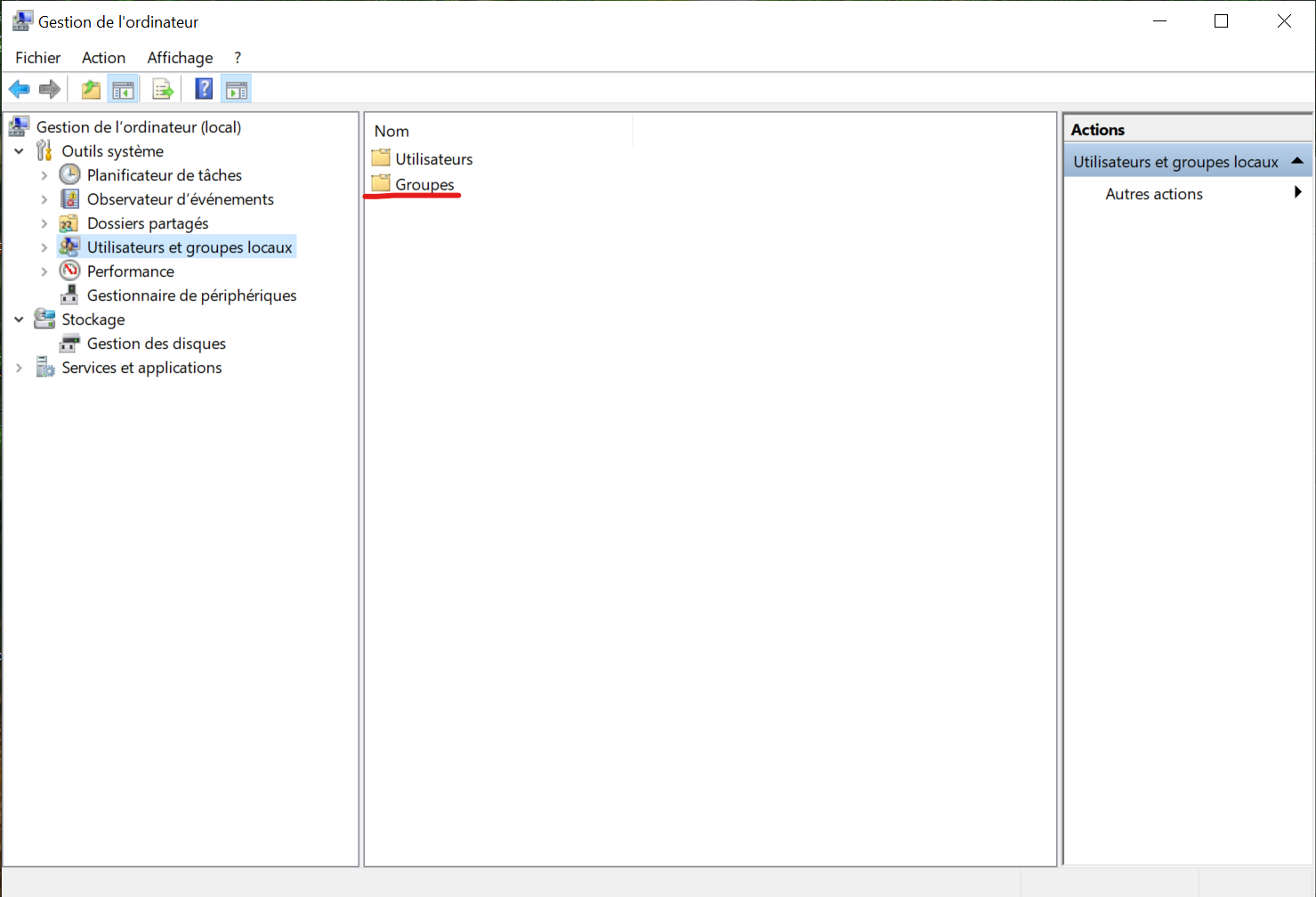](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-161437.png)
- Trouver "Autolite Users", et l'ouvrir.
[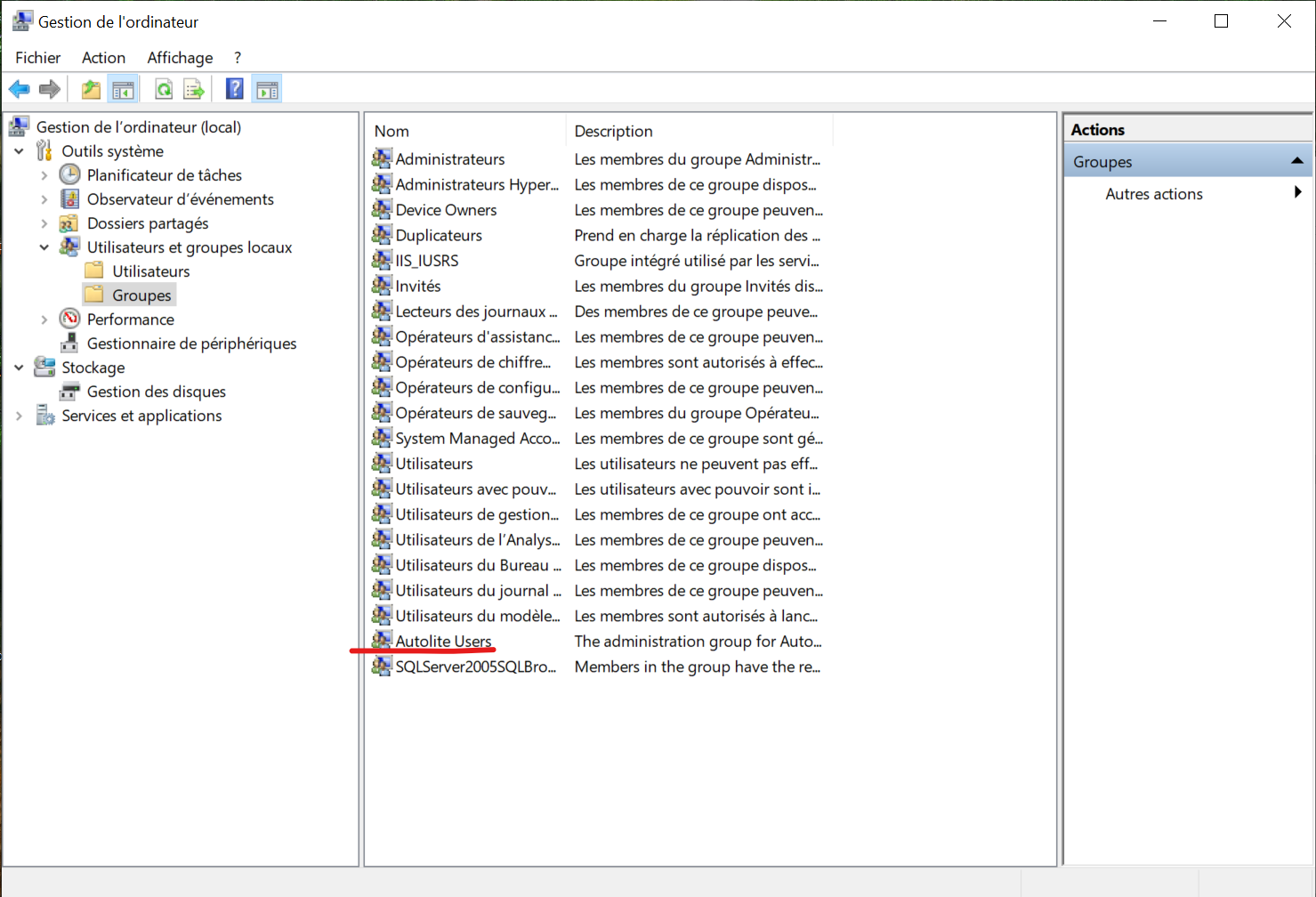](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-161503.png)
- Dans la fenêtre qui s'ouvre, cliquer sur "Ajouter"
[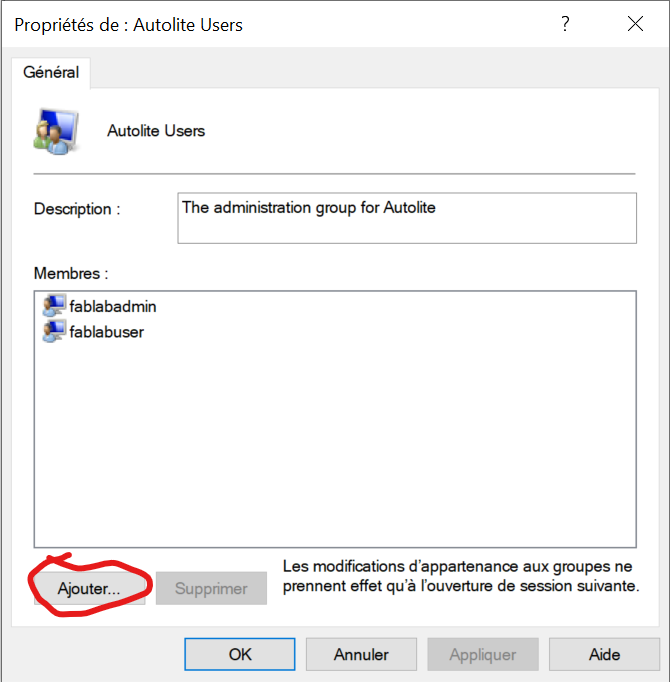](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-161526.png)
- Dans la nouvelle fenêtre ainsi ouverte, entrer le nom du profil utilisateur concerné, ou les noms si l'on souhaite donner accès au programme à plusieurs utilisateurs (exemple: fablabuser sur les ordinateurs du fablab), puis cliquer sur "Vérifier les noms"
[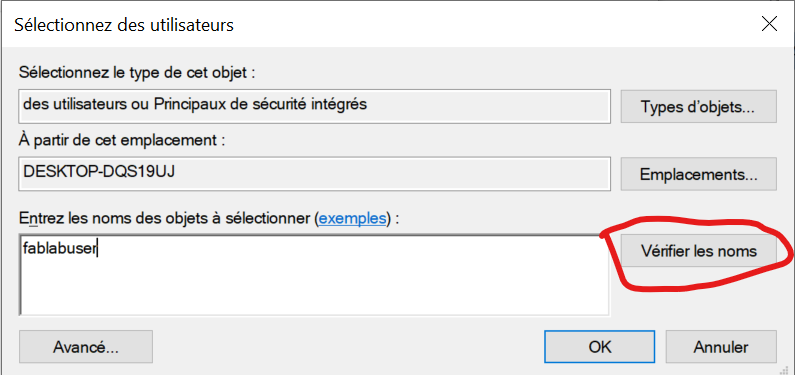](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/capture-decran-2025-01-30-161600.png)
- Cliquer sur "Appliquer", puis sur OK.
V/ Lancement du programme
- Brancher l'appareil au secteur
- Le brancher à l'ordinateur via le cable USB.
- Insérer la clé USB de licence, le programme ne s'ouvre pas le cas échéant.
- Lancer Auto Lite.
# Humidimètre
Appareil à dessication forcée permettant la détermination des concentrations en eau par pesée.
# Dessiccateur MB23 - OHAUS
### Mode d'emploi du dessiccateur MB23 :
Cette machine détermine le taux d'humidité de l'échantillon donné en fonction de sa perte de poids lors de son séchage par réchauffement.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/dessiccateur-mb23-702427-1-7b20.webp)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/dessiccateur-mb23-702427-2-4fb2.webp)
**!! Vidéo explicative de 2 mins pour bien utiliser la machine :** [**https://youtu.be/01EYK0ypvTo?si=5Yrel350pfWEViba**](https://youtu.be/01EYK0ypvTo?si=5Yrel350pfWEViba)
#### Consigne
Port de gants, blouses de chimie, lunettes de sécurité et masques respiratoire est nécessaire lors de l'utilisation de la machine
Évitez les espaces avec des changements de température ou de fortes températures, un fort taux d'humidité, des courants d'air, des vibrations ou de champs électromagnétiques lors de l'utilisation de la machine.
**Certains échantillons demandent des soins spéciaux !!!** Dans ces cas là ne laissez pas la machine sans surveillance
- **Incendie ou explosion** : Substances contenant des solvants ou des vapeurs explosives ou inflammables en cas de chauffement !! Avec ce type d'échantillons travaillez à des températures de séchage suffisamment basses pour éviter la formation de flammes ou d'explosion.
- **Empoisonnement ou brûlure** : Les substances contenant des composants toxiques ou caustiques doivent être séchées uniquement dans une hotte.
- **Corrosif** : Les substances dégageant des vapeurs corrosives une fois chauffées doivent être testées en petites quantités
L'échantillon à mesurer doit être supérieur à 0,5g ! (**>0,5g**)
#### Opération :
Commandes :
Installation
1. Installez le pare-vent de forme cylindrique au fond de la machine
2. Installez le support du plateau par dessus. Le tournez jusqu'à ce qu'il s'enfonce bien
Branchez la machine si possible 15 min avant son utilisation.
Un plateau d'échantillon amovible est à disposition pour les mesures.
**Mode de fonctionnement : **
- **Mesure du taux d'humidité d'un échantillon**
1. Allumez la machine
- Un appui long sur le bouton Marche/Arrêt l'éteindra
- Un appui court la mettra en veuille
2. Placez un plateau d'échantillon vide sur le support de plateau et tarez la balance (bouton →T←). Le poids qui s'affiche sur l'écran est nul.
3. Retirez le plateau d'échantillon. Répartissez l'échantillon de manière uniforme sur le plateau et le replacer. L'échantillon doit être supérieur à 0,5g ! (!!Pensez à faire un test d’essai....se référer a la fin de la page!!)
- **Mode d'édition de la température**
1. Temps : appuyez rapidement pour le réglage de température
2. Régler : pour augmenter ou diminuer la valeur de la température
3. Tare : appuyez longuement pour valider la nouvelle valeur et revenir sur le mode de pesée
(Attention !! après 5s d'inactivité la valeur est enregistré et passe en mode de pesée)
- **Mode d'édition de la durée**
Ce paramètre peut-être réglé sur une duré spécifique ou sur AUTO (le test prend fin lorsque l'Analyseur détecte la fin de perte de poids)
1. Appuyez rapidement sur le bouton de durée pour activer le réglage du temps
2. Appuyez rapidement sur le bouton de durée pour pour permuter entre AUTO et une valeur de durée spécifique
3. Appuyez sur tare (→T←) pour valider le mode choisi
Il n'y a rien d'autre à faire si le mode AUTO a été choisi
Sinon :
1. Utiliser les boutons ▲▼ pour régler le temps de séchage
2. Appuyez rapidement sur tare pour valider le temps choisi
(Appuyez rapidement sur le bouton démarrer pour ne pas enregistrer les modifications)
- **Mode d'exécution**
1. Marche/Arrêt : appuyez rapidement pour exécuter
2. %g : pour changer d'unité si besoin (poids, humidité ou solide)
3. Si besoin, appuyez sur arrêt pour interrompre le test
4. Cliquer sur imprimer pour envoyer la valeur afficher au RS232
A la fin du test l'affichage clignote le résultat
- **Préparer un test d'essai :**
1. Régler la température à 120°
2. Durée =AUTO
3. Échantillon 3g d'eau
4. Placer un tampon en fibre de verre sur le plateau test
5. Appuyer Tare pour mettre à 0
6. Ajouter les 3g d'eau au tampon fibre
7. Appuyer sur démarrer pour lancer le test
Le résultat parfait doit être : 0g 100% d'humidité et 0% de solide
##### Optimisation du test :
La qualité des mesures obtenues reposent sur différents paramètres. Il est donc recommandé de **faire plusieurs essais en variant ces paramètres** pour déterminer leur configuration optimale :
- température de séchage
- durée de séchage
- poids de l'échantillon
- préparation de l'échantillon
- type d'échantillon
- **Température**
Sélectionnez une température de séchage qui **ne décompose ni ne change la structure chimique** de l'échantillon. (Mais une température basse prolonge inutilement le temps de séchage).
Certains échantillons peuvent donner divers taux d'humidité pour différentes températures. Les écarts peuvent être compensés en changeant la température de séchage.
- **Durée**
Le test doit avoir une durée de plus de 30 secondes pour être valide.
La durée de séchage peut-être établie :
- Manuellement en appuyant sur le bouton stop
- Automatiquement (lorsque la machine détecte une perte de poids <1mg en 60 sec)
- Par durée limitée avec un temps de séchage préréglé
- **Poids de l'échantillon**
Pensez à la durée de la mesure et la reproductibilité des résultats lors du choix du poids. (Plus c'est lourd moins c'est rapide, plus c'est léger moins c'est précis)
Valeurs recommandées : **3g ~< échantillon ~< 20g**
Un tableau pour vous aider à choisir :
| **Poids de l'échantillon**
| **Reproductibilité**
|
| 0,5 g
| ±
1,0 %
|
| 1 g
| ±
0,6 %
|
| 2 g
| ±
0,3 %
|
| 5 g
| ±
0,12 %
|
| 10 g
| ±
0,06 % |
- **Préparation de l'échantillon**
Les différents échantillons doivent êtres uniformes et représentatifs de la quantité totale. La couche de l'échantillon sur le plateau de test doit être une couche mince et uniforme.
- **Types d'échantillons**
En cas de doute sur la dangerosité d'une substance, exécutez toujours une analyse détaillée des risques et ne laissez pas la machine sans surveillance.
Substances volatiles !! :
- Une **application rapide** de l'échantillon sur le plateau test est recommandée afin de limiter l'évaporation de l'humidité.
Substances empoisonnées et toxiques !! :
- Ces substances doivent être séchées uniquement **DANS UNE HOTTE !!**
Substances corrosives !! :
- Les substances dégageant des vapeurs corrosives une fois chauffées, comme les acides, doivent être testées **EN PETITES QUANTITÉS !!**
Substances poisseuses contenant de la graisse et fondantes :
- Utilisez un **filtre en fibre de verre** pour augmenter la surface de ces échantillons.
Substances liquides :
- Un **filtre en fibre de verre** permettra de repartir le liquide sur une surface plus grande.
Substances sensibles à la température et formant une peau :
- Un **filtre en fibre de verre couvrant l'échantillon** permet un chauffage plus doux et avantageux.
Substances contenant du sucre :
- Assurez vous que la couche appliquée est fine et uniforme et que la **température sélectionnée est moyenne**. Un filtre en fibre de verre peut aussi être utilisé.
# Réfractomètre
Zuzi modèle 325 - mesure de l'indice de réfraction d'un milieu
# Tableaux de valeurs
# Réalisation d'une mesure
L'appareil étalonné, il devient possible de réaliser différentes mesures avec des liquides ou des solides, transparents ou translucides.
Le protocole varie en fonction de la nature de l'échantillon testé.
Attention : Le réfractomètre n'est utilisation qu'en présence de liquide/solides transparents et translucides, dès que le liquide/solide est sombre ou fortement colorée la mesure sera faussée
#### Mesure d'un liquide transparent ou translucide
- Déposer quelques goutes de votre liquide sur le prisme de réfraction à l'aide d'une pipette de manière homogène sur le prisme puis fermer ce dernier
- Ouvrir le cache-prisme (1.4) situé sur le dessus du prisme et fermer celui situé en dessous (1.6)
- Regarder dans l'oculaire où se positionne la ligne horizontale par rapport à la croix.
L'objectif de la manipulation qui suit est de positionner la ligne au centre de la croix
- Tourner la molette inférieure droite afin de positionner correctement la ligne horizontale.
- Regarder l'indice de réfraction
- Se référer aux courbes de valuers préexistantes
#### Mesure d'un solide transparent
- Le solide mesuré doit être lisse et avoir une face polie ( au moins celle mise en contact avec le prisme)
- Comme lors de l'étalonnage, placer une à deux gouttes de monobromide de naphtalène sur le prisme,
- Nettoyer la surface de l'objet mesurée et le positionner sur le prisme
- Fermer le plus possible le sans forcer le prisme
- Fermer le cache-prisme (1.4) situé sur le dessus du prisme et celui situé en dessous (1.6)
- Regarder dans l'oculaire où se positionne la ligne horizontale par rapport à la croix.
L'objectif de la manipulation qui suit est de positionner la ligne au centre de la croix
- Tourner la molette inférieure droite afin de positionner correctement la ligne horizontale.
- Regarder l'indice de réfraction
#### Mesure d'un solide translucide
- Le solide mesuré doit être lisse et avoir une face polie ( au moins celle mise en contact avec le prisme)
- Comme lors de l'étalonnage, placer une à deux gouttes de monobromide de naphtalène sur le prisme,
- Nettoyer la surface de l'objet mesurée et le positionner sur le prisme
- Fermer le plus possible le sans forcer le prisme
- Fermer le cache-prisme (1.4) situé sur le dessus du prisme et ouvrir celui situé en dessous (1.6)
- Regarder dans l'oculaire où se positionne la ligne horizontale par rapport à la croix.
L'objectif de la manipulation qui suit est de positionner la ligne au centre de la croix
- Tourner la molette inférieure droite afin de positionner correctement la ligne horizontale.
- Regarder l'indice de réfraction
#### Mesure concentration en sucre d'une solide
- Déposer quelques goutes de votre liquide sur le prisme de réfraction à l'aide d'une pipette de manière homogène sur le prisme puis fermer ce dernier
- Ouvrir le cache-prisme (1.4) situé sur le dessus du prisme et fermer celui situé en dessous (1.6)
- Regarder dans l'oculaire où se positionne la ligne horizontale par rapport à la croix.
L'objectif de la manipulation qui suit est de positionner la ligne au centre de la croix
- Tourner la molette inférieure droite afin de positionner correctement la ligne horizontale.
- Regarder l'indice de réfraction
- Dans ce cas, la concentration de sucre peut-être déterminée via l'échelle Brix (allant de 0 à 90%) située au dessus de la ligne de réfraction.
Tableur %sel / indice de réfraction :
[%sel / indice de refraction](https://docs.google.com/spreadsheets/d/1fg0MCjjeL93Ekl8hGXk1hLTAGDIjVLmzlqrITzqh6dA/edit#gid=0)
# Etalonnage
Avant chaque utilisation, il faut calibrer le réfractomètre à l'aide de l'étalon fourni, un bloc solide avec son indice de réfraction indiqué à sa surface, et une solution de monobromide de naphtalène.
Voici le protocole d'étalonnage du Réfractomètre :
#### Sécurité et Installation :
1. Mettre gants, blouse et lunettes de protection (le monobromide de naphtalène est irritant pour les yeux et toxique quand ingéré)
2. Installer le réfractomètre sur un paillasse correctement éclairé afin d'avoir un éclairement optimal et obtenir une mesure parfaite
3. Ouvrir la partie supérieure du réfractomètre avec la mollette sur la gauche pour exposer le prisme
4. Prélever 2 gouttes de monobromide de naphtalène avec une pipette pasteur et les placer sur le prisme
5. Placer par dessus le solide fourni, indice de réfraction vers le haut
6. Refermer le prisme au maximum
Ne pas forcer pour fermer la partie supérieure du réfractomètre, dans ce cas-ci l'observation se réalise sans
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/img-0886.jpg)
Solide d'étalonnage Flacon de monobromide de naphtalène
#### Manipulation sur l'appareil :
1. En plaçant votre œil dans l’oculaire, vous observez normalement un cercle séparé en deux moitié, une claire et une sombre, ainsi qu'une échelle en dessous, l'échelle d’indice de réfraction
2. Régler la dispersion avec la mollette supérieure droite pour que la partie claire et la partie sombre soit séparées par une ligne nette
3. Régler l'indice de dispersion sur l'échelle sur celui indiqué sur l'étalon (nD=1.51663)
4. Si la ligne de démarcation entre les deux moitié, sombre et claire, ne se fait pas au centre de la croix visible, régler la vis de calibrage (voir la page Présentation) avec le tournevis fourni.
5. Nettoyer le prisme, le solide et le prisme supérieur si entré en contact avec le monobromide de naphtalène, avec de l'alcool pur et du coton
Ne pas racler le prisme, au risque de l'abîmer, mais plutôt le tapoter
Après le calibrage, ne plus toucher à cette vis. Si la mesure semble fausse, étalonner à nouveau.
# Présentation
Le réfractomètre Zuzi, modèle 325 permet de mesurer des indices de réfraction de 1.3000 à 1.7000 nD, de 0 à 95% °Brix, avec une précision de ± 0.0005 nD et de ±0.25% °Brix. La mesure est possible pour un échantillon entre -50 et 70°C, et ne nécessite pas de source de lumière additionnelle.
Le réfractomètre est composé de nombreuses pièces :
Schéma des différents composants du réfracteur
# Principe de fonctionnement et utilisations
Le réfractomètre est un appareil permettant de déterminer l'indice de réfraction d'une solution ou d'un solide. Cette mesure permet ensuite d'obtenir de nombreuses informations, comme par exemple, la concentration, la pureté ou encore les particularités optiques du milieu considéré.
Lorsque de la lumière passe dans un espace compris entre deux milieux différents (air et eau, liquide et solide, etc), celle-ci est divisée en deux rayons : un premier rayon est réfléchi, le second est dévié dans le second milieu. Ce rayon voit alors sa vitesse et son angle de réfraction modifiés. Ces deux modifications sont mesurées grâce à l'indice de réfraction. Chaque milieu en possède un qui lui est propre.
[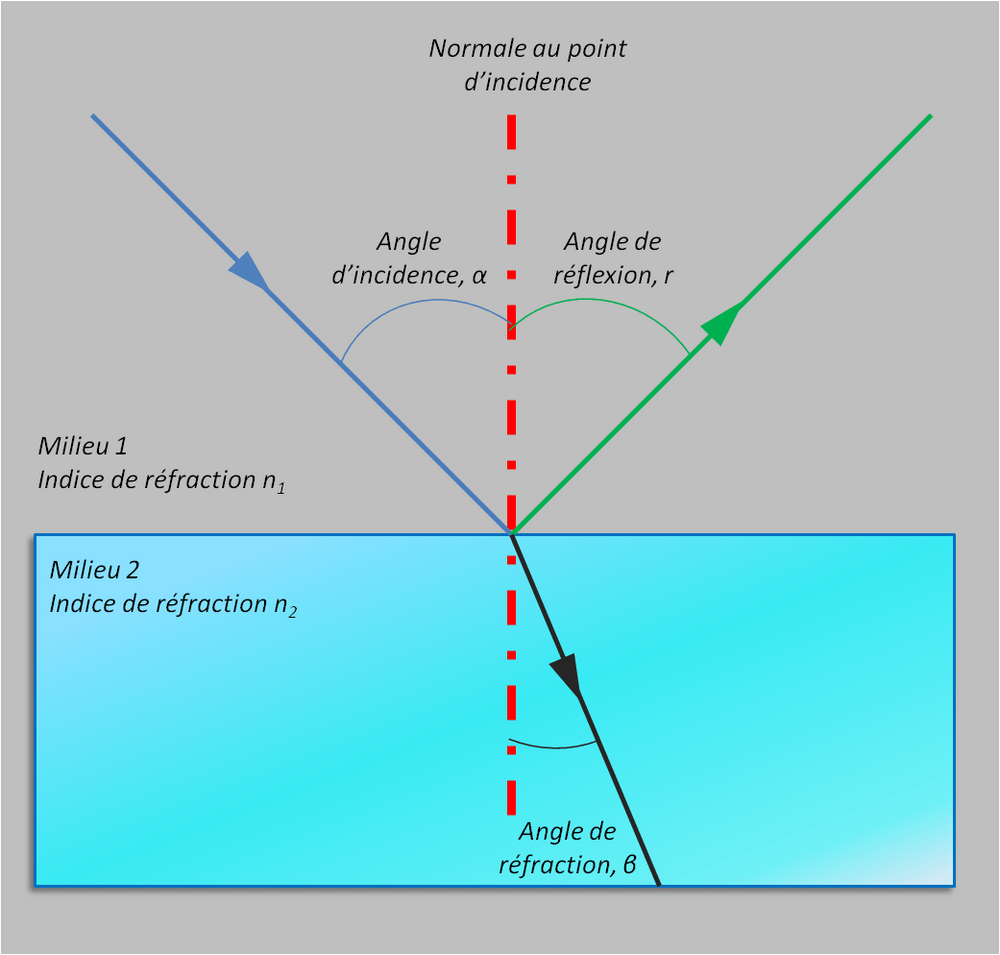Schéma de la réfraction de la lumière entre deux milieux](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-01/eivdw-schemasnelldescarte1-min.png)
L'indice de réfraction est calculé en fonction de la masse, de la charge et du nombre de particules dans le médium traversé par la lumière.
Cet appareil fonctionne donc selon un principe purement physique, et ne nécessite ainsi aucune alimentation électrique.
# LabSwift-aw - appareil de mesure de fraction d'eau libre
#### **Description générale**
LabSwift-aw est un appareil de mesure de fraction d'eau libre. La fraction est l'activité de l'eau (aw - water activity). La valeur de aw est comprise entre 0 (absolument sec) et 1 (absolument humide). Afin de déterminer aw l'équilibre hygrométrique est mesuré à travers la cellule électrolytique résistive intégré dans le capteur de aw. Le signal mesuré est également associé à une mesure de la température par IR (infrarouge).
#### **Aperçu**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-12/labswift.jpg)
Il y a 3 touches de fonctions :
**1. Touche "Menu"** :
Mode Mesure : allume/éteint appareil (presser longtemps), accès aux menus
Mode Menu : accès aux paramétrages, passage du mode menu au mode mesure (presser longtemps)
**2. Touche "Actual/Stable"**
Mode Mesure : passage de la valeur mesure à la valeur stable
Mode Menu : descendre au mode menu, décrémenter
**3. Touche "Start/Stop"**
Mode Mesure : démarrage de la mesure, interruption de la mesure en cours, protocole de la mesure (presser longtemps)
Mode Menu : monter au mode menu, décrémenter
**Affichage**
Actual - Le symbole apparaît pendant une mesure.
Stable - Le symbole apparaît quand la mesure est stabilisée.
SD rec - Apparaît quand la fonction enregistrement est activée.
Ne jamais retirer la carte SD quand le symbole apparaît !
#### **Démarrage de l'appareil**
1. Vérifier les tensions d'alimentation secteur
2. Brancher le câble d'alimentation de votre LabSwift-aw
3. Appuyer ensuite sur la touche de mise en route
4. Le système montre (S TST) ; auto-test
5. Attendre 2-3 minutes (WARM UP)
6. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-12/cv4image.png)
7. Mettre l'échantillon dans une coupelle (remplir au 2/3, ne pas mettre en contact avec la cellule de mesure), placer la coupelle dans la chambre de mesure sans le couvercle et fermer l'appareil
8. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-12/1Auimage.png)
9. Démarrer la mesure : soit presser **la touche "Start/Stop"** soit programmer l'autostart dans le menu soit fermer le capot (la mesure va se démarrer automatiquement)
10. Lors de la mesure l'appareil affiche "Analyse", le symbole Actual apparaît pendant une mesure.
11. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-12/JFpimage.png)
12. Ensuite on entend un "beep" qu'on peut éteindre avec **la touche "Start/Stop"**
13. Le symbole Stable apparaît quand la mesure est stabilisée.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-12/Nheimage.png)
La température et la valeur de aw apparaissent
*\*Pour sélectionner le mode d'affichage de mesure presser **la touche "Actual/Stable"***
Pour optimiser le temps de mesure, il est possible de choisir entre trois facteurs de stabilité :
**Accéder au menu --> Choisir à l'aide des flèches marquées sur les touches Start/Stop et Actual/Stable \*STAB --> Appuyer sur la touche menu --> Changer de mode avec les flèches --> Appuyer encore une fois sur la touche menu pour sauvegarder**
Pour sortir : Appuyer sur le flèches pour trouver EXIT --> Choisir EXIT et appuyer longtemps sur la touche "Menu" pour sortir
S Lent, temps de mesure : 6 minutes
A Moyen, temps de mesure : 4 minutes
F Rapide, temps de mesure : 2 minutes
0 le temps de mesure peut être programmé dans le menu "OBSTIME" (valeurs de 1 à 30 minutes)
#### **Calibration de l'appareil avec les sels SAL-T**
**Il y a 3 types de sel SAL-T**
Sel SAL-T **11**, Sel SAL-T **58** et Sel SAL-T **84**
1. Mettre **le facteur de stabilité en mode S** (Accéder au menu --> Choisir à l'aide des flèches marquées sur les touches Start/Stop et Actual/Stable \*STAB --> Appuyer sur la touche menu --> Changer de mode avec les flèches --> Appuyer encore une fois sur la touche menu pour sauvegarder)
2. Placer le sel SAL-T standard dans la chambre (avec/sans couvercle ?)
3. Fermer le capot
4. Attendre 45 minutes
5. Accéder au menu
6. Sélectionner \*CALIB **à l'aide des flèches marquées sur les touches Start/Stop et Actual/Stable** et ensuite CALXX
La déviation entre la valeur actuelle mesurée et la valeur de référence choisie "Point étalon" est visualisée. L'appareil reconnaît automatiquement l'étalon. Avec les touches d'autres points de calibrage peuvent être choisis.
6. Pressez ensuite **la touche "Menu"** pour valider le calibrage
Pour sortir : Appuyer sur le flèches pour trouver EXIT --> Choisir EXIT et appuyer longtemps sur la touche "Menu" pour sortir
*\*Pour effacer un ou tous les points de calibrage mémorisés --> CLR Cxx = effacer un seul point déterminé et ALL = effacer tous les points*
*\*\*Pour activer le mot de passe de 4 chiffres pour protéger le calibrage --> SET PSW (le code usine : 8808)*
#### **Paramétrages : System settings --> \*LCD**
**Accéder au menu --> Choisir \*LCD à l'aide des flèches marquées sur les touches Start/Stop et Actual/Stable \*STAB --> Appuyer sur la touche menu -->Changer de mode avec les flèches --> Appuyer encore une fois sur la touche menu pour sauvegarder**
Pour sortir : Appuyer sur le flèches pour trouver EXIT --> Choisir EXIT et appuyer longtemps sur la touche "Menu" pour sortir
CONTRA - contraste (de 0 à 9)
UNIT H - humidité/aw : valeur de aw ou d'hummidité %RH
UNIT T - température : °C ou °F
#### **Paramétrages : SD-Card --> \*SD LOG**
**Accéder au menu --> Choisir \*SD LOG à l'aide des flèches marquées sur les touches Start/Stop et Actual/Stable \*STAB --> Appuyer sur la touche menu -->Changer de mode avec les flèches --> Appuyer encore une fois sur la touche menu pour sauvegarder**
Pour sortir : Appuyer sur le flèches pour trouver EXIT --> Choisir EXIT et appuyer longtemps sur la touche "Menu" pour sortir
S NUMB - Des chiffres libres "de 0000-9999" qui vont s'incrémenter de 1 en 1 permettent de stocker les mesures
S INT - Les données seront sauvegardées à un intervalle de temps défini dans ce menu; pour des mesures standards préconisez un enregistrement toutes les 10 secondes
Tous les paramètres peuvent être **remis en configuration usine**, excepté les valeurs de calibrage stockées dans la cellule de mesure CM-2. Pour réinitialiser l'appareil, appuyer simultanément sur "ON" et la flèche du haut. "FA SET" apparaît, sélectionnez "YES" pour confirmer le retour en configuration usine.
#### **Consignes à respecter**
**• Ne laissez jamais tomber la cellule de mesure. Ne la nettoyez jamais**
**• N'effectuez pas de mesures sans avoir monté le filtre de protection**
**• Utilisez les filtres de protection adaptés aux produits mesurés (acides, alcools ou arômes)**
**• Les capteurs non utilisés doivent être conservés dans un endroit propre, dans des conditions de température et d'humidité ambiante**
**• Une chambre de mesure non utilisée doit rester vide et fermée**
**• Ne connectez pas le capteur à un multimètre ; cela aurait pour conséquence de le dégrader et ne serait pas couvert par la garantie**
# Agitateur magnétique
Appareil permettant l’homogénéisation d'une solution via l'agitation par un moteur à vitesse variable d'un barreau aimanté
# Guide d'utilisation agitateur magnétique sans potence
#### **Présentation des appareils**
| Heidolph / Hei-Mix-S
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/heidolph-agitateur-magnetique.jpeg)
**Plage de vitesse de rotation** **:** jusqu'à 2200 tours/minute
**Précision de la vitesse :** ± 5 %
**Capacité volumique d'agitation :** jusqu'à 5L
| Prolabo / SR100
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/prolabo-sr100-agitateur-magnetique.jpeg)
**Plage de vitesse de rotation :** jusqu'à 1000 tours/minute
**Capacité volumique d'agitation :** jusqu'à 500mL-1L
| Hanna instruments / Magnetic stirrer HI 190M
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/hanna-instruments-agitateur-magnetique.jpeg)
**Plage de vitesse de rotation :** 100 à 1000 tours/minute
**Capacité volumique d'agitation :** jusqu'à 1L
|
| Prolabao / agitateur magnétique
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/prolabo-agitateur-magnetique.jpeg)
| IKA MINI MR
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/jk-agitateur-magnetique.jpeg)
| Barreaux aimantés et tige de récupération
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/localisation-barreaux-aimantes-et-tige-2.jpeg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/v04barreaux-aimantes.jpeg)
Barreaux aimantés de différentes tailles qui supportent l'autoclave
|
#### **Mode d'emploi**
1. Poser sa solution sur l'appareil selon la capacité volumique de celui-ci
2. Choisir une taille de barreau aimanté et le mettre dans la solution nb: le barreau supporte l'autoclave
3. Brancher l'appareil à une prise
4. (Passer cette étape si utilisation appareil IKA ou Hanna Instruments ) : Allumer l'appareil en appuyant sur le bouton on- Heidolph : noir- Prolabo SR100 : vert power- Prolabo : rouge secteur (le voyant s'illumine)
5. Choisir la vitesse de rotation
6. Une fois la solution homogénéisé, mettre la vitesse de rotation sur 0
7. (Passer cette étape si utilisation appareil IKA ou Hanna Instruments ) Mettre l'appareil sur off
8. Débrancher l'appareil
9. Le barreau aimanté est à retirer avec la tige de récupération blanche
10. Laver le barreau aimanté et la tige de récupération utilisés avant de les ranger
# Incubateur BRE240
Enceinte thermostatée qui permet le maintien de condition optimale pour les milieux de culture
# Cuve d'électrophorèse
La cuve d’électrophorèse est utilisée dans l'électrophorèse sur gel d'agarose. Elle permet de contenir le tampon de migration.
# Cuve d'électrophorèse avec visualisaton en direct de la migration
#### Appareil d'électrophorèse en temps réel
Le modèle VWR® Real Time Electrophoresis System permet de couler un grand gel ou deux petits gels d'agarose en même temps, puis de faire migrer vos extraits d'acides nucléiques (ADN, ARN), tout en les visualisant grâce à un appareil transilluminateur, emboîtable en dessous de la cuve de migration.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/28359938.jpg)
#### Consignes
L'appareil doit être branché à un réseau de 100~120 VCA. Sinon il faut utiliser le transformateur pour un réseau de 220 VCA !!!
Ne pas manipuler l'appareil avec les mains humides
Ne pas exposer l'appareil à l'eau ou un fort taux d'humidité
Ne pas exposer l'appareil directement au soleil ou aux lumières fortes
Ne pas exposer la machine au feu ou à de fortes sources de chaleur
Ne pas exposer exposer la machine à des gaz corrosifs ou de fort champs magnétiques
Ne pas exposer la machine à la poussière
Ne pas cogner ou déplacer l'appareil lors de son fonctionnement
Ne pas mettre ses mains ou un quelconque objet dans la cuve de migration lors du fonctionnement de la machine
Ne pas débrancher la cuve lorsqu'elle est allumée
#### Matériel
#### Mode d'emploi
##### 1. Couler les gels
La première étape consiste à couler les gels dont vous aurez besoin pour effectuer votre migration. Ce kit permettant d'effectuer des migration d'extraits d'acide nucléiques; les gels coulés sont donc uniquement des gels d'agarose, coulés à l'horizontal. Selon le pourcentage d'agarose du gel, celui-ci retiendra plus ou moins les petits fragments de matériel génétique. Un gel à 0.5% d'agarose permet ainsi l'analyse de fragments compris entre 30 000 et 1000 paires de bases, tandis qu'un gel à 2% d'agarose permet plutôt l'analyse de fragments de 2000 à 50 paires de bases. En fonction de vos fragments, vous pouvez donc choisir le bon pourcentage d'agarose.
Selon le nombre d'échantillons à faire migrer, vous pouvez choisir les peignes à 12 ou 22 dents; de même, selon la durée de vote électrophorèse ou sa résolution, vous pouvez couler votre gel dans les petites plaques (10.5x6 cm) ou la grande plaque (10.5x10 cm), et placer le diviseur de plaques amovible dans la fente correspondante.
- Placer le support de coulée de gel sur une surface plane et rajouter le séparateur de manière approprié afin d'éviter des fuites. On peut le placer dans l'encoche centrale si on veut deux petites plaques de gel ou dans une encoche latérale si on veut une grande plaque de gel.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/separateur.jpg)
- Déposer un des plateau transparent selon la quantité de gel à couler.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/cuves.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/cuve.jpg)
- Placer le peigne sur la plaque. Si on utilise le peigne à 22 dents veiller à ce que l'encoche des dents soit tournée vers la direction opposée à celle de la migration.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/peigne.jpg)
- Mixer et chauffer la solution d'agarose pour en faire un gel (prévoir 25mL de gel). Laisser le refroidir jusqu'à 60°C.
- Verser le gel sur le plateau de manière à former approximativement une couche de 4mm d'épaisseur et attendre environ 20 min que le gel se solidifie.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-04/gelatine.jpg)
- Soulever délicatement le peigne pour le retirer. Les petits trous formés par le peignes doivent restés propres et nets.
- Retirez délicatement la plaque de gel avec le gel du support et la placez le dans la cuve de migration dans la bonne direction (les échantillons d'ADN migrent du – vers le +).
##### 2. Préparation du réservoir
Assurez-vous que la machine soit bien installée sur une surface plane!
- Déposer le plateau contenant le gel au centre de la plaque transparente. Si vous avez choisi le grand plateau, il devrait recouvrir l'entièreté de la plaque transparente. Si vous avez choisi le petit plateau, des petites encoches vous aideront à correctement le placer.
- Verser délicatement une solution tampon appropriée d'une épaisseur de 2 mm au dessus de la surface du gel (~200 mL).
D'après le constructeur, il est recommandé d'utiliser du TAE ou du TBE avec une concentration de 0.5
- Brancher l'alimentation au réservoir de migration.
##### 3. Ajout des échantillons d'ADN au gel
- Utiliser une pipette appropriée pour disperser des échantillons dans l'épaisseur du gel. (La solution tampon doit être mixée aux échantillons d'ADN pour qu'ils coulent au fond du puits)
- Descendre avec précaution le couvercle de sûreté. Le filtre orange doit être en parfait contact avec la solution tampon de façon à ce qu'il n'y ait pas de bulles. Si le niveau de la solution est trop bas, retirer le couvercle et ajouter plus de solution tampon.
- Glisser la lampe LED bleue sous le bassin à gel.
##### 4. Lancement de l'électrophorèse
- Brancher le générateur ET la lampe LED.
- Presser ▲▼ pour définir le temps de fonctionnement de la machine. Pour faire fonctionner la machine en continu, mettre le temps à ''00''. Sélectionner la tension sortante appropriée.
- Lancer l'opération avec le bouton RUN/STOP. La LED indiquant la tension sortante clignotera pour indiquer qu'une opération est en cours. Pour indiquer la fin d'une opération, l'alarme sonne 3 fois et l'écran affiche Ed pour END.
(Il suffit d'appuyer sur une touche quelconque pour faire disparaître « ED » et lancer une nouvelle opération).
- Pour stopper une opération en cours, appuyer sur RUN/STOP pendant 3 sec. La LED de voltage s’arrêtera de clignoter.
- Pour retirer le gel à la fin d'une électrophorèse, éteindre la machine et retirer le couvercle et le plateau de gel.
##### 5. Visualisation de l'électrophorèse en cours
- Allumer la lampe LED grâce au bouton ON/OFF
- Il peut être nécessaire de diminuer ou éteindre la lumière ambiante, pour de meilleurs résultats.
- La lumière s'éteindra automatiquement après 5 minutes.
##### 6. Photographie du processus en utilisant un smartphone
- Pour prendre une photographie avec son téléphone, mettre le cache photographique sur le couvercle.
- Insérer le filtre orange sur la plate-forme supérieure et aligner la caméra du téléphone avec le filtre.
- Zoomer et faire la focale si nécessaire pour optimiser l'image et prendre des photos.
# Teslamètre
Un appareil permettant de mesurer l’intensité du champs magnétique selon 2 axes
# Jeulin Bi-axiale
Permet la détection et la mesure de champs magnétiques de 0,1 mT à 100mT. ( champs crée par des courants de 2 à 10 A). Sa sonde bi-axiale mesure selon deux axes orthogonaux grâce à deux capteurs à effets de Hall.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-09/image.jpg)
Protocole :
- Brancher le cordon secteur
- Mettre l’interrupteur sur « Marche » (témoin allumé en rouge)
- Attendre que le témoin passe au vert pour la stabilisation thermique
- Sélectionner la commande magnétique à afficher ( bouton noir )
- sélectionner le calibre desiré ( bouton rouge)
- [la valeur affiché sur l’écran est en mT](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-09/img-2717.jpeg)
# Ultrasonic cleaner
Un nettoyeur ultrasonic est basé sur l’effet de cavitation causé par la vibration d’onde ultrasonique haute fréquence dans un liquide. Il permet de former des bulles microscopiques qui explosent violemment et « décapent » la surface d’un objet. Les bulles sont suffisamment petites pour pénétrer dans des surfaces poreuses et nettoyer en profondeur. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-09/tATimage.jpg)
Fonctionne entre 20-80°C
Temps d’utilisation 0-20min
Utilisation intensive à 40KHz
Pour l’utiliser :
- Placer la machine sur une surface plane et propre
- verifier que le ventilateur de refroidissement est intacte et adéquat
- verifier que toutes les commandes sont éteintes et que le robinet de vidange soit fermé
- Assurer vous que le fil d’alimentation soit bien branché et surtout pas en contacte avec l’humidité
- remplir de 7 cm environ le contenant avec un solvant
Types de nettoyage :
general : utilisez de l’eau et une temperature d’environ 50°C
Amélioré : vous pouvez utiliser du savon ou une autre solution de nettoyage **(non acide)**
Approfondi : Pour enlever le ternissement, le carbone et la rouille des métaux non plaqués, il est recommandé d’utiliser des solvants spécifiques au nettoyeur à ultrason.
**ATTENTION**
**ne pas faire fonctionner la machine plus d’une heure !**
matériaux possibles (listes non exhaustives) :
- Bijoux : Or, platine et argent
- piece de monnaie
- PCB Board
- piece de moteur
- composant électrique
- tète d’imprimante
- équipements chirurgicales
- couteaux
Non recommandés :
- perle, émeraude, tanzanite, malachite, turquoise, lapis, corail
**Protocole:**
1. Remplir le reservoir avec le solvant
2. mettre les elements dans le panier
3. brancher le fil d’alimentation
Pour l’utilisation ultrasonic :
1. faire pivoter le bouton « Timer » vers la gauche sur « ON » pour une utilisation continue sinon choisissez la durée du programme
2. Faire pivoter sur « OFF » pour éteindre
Pour une utilisation avec la température :
1. Choisissez une température ( en general les meilleurs temperatures de nettoyages sont entre 40 et 80°C)
2. Pivotez sur « OFF » pour éteindre la machine
Prenez vos elements et nettoyer la machine avec un chiffon sec en attendant le refroidissement
NE PAS VIDER L’EAU TANT QUE LA TEMPÉRATURE N’EST PAS REDESCENDU CELA ABÎMERAIT LA MACHINE !
# Banc Kofler
Un appareil permettant de déterminer le point de fusion d'un élément chimique
# Banc Kofler
#### Présentation de l'appareil
Le banc Kofler est un appareil permettant la détermination du point de fusion (passage de l'état solide à l'état liquide) d'un élément chimique avec une précision à 2 degrés près. Pour cela, l'appareil va chauffer un banc métallique grâce à des résistances thermiques selon un gradient de droite à gauche, du moins chaud au plus chaud. Ce banc Kofler peut s'utiliser pour déterminer des points de fusion d'éléments chimiques compris entre 50 et 260°C.
#### Matériel
#### Consignes de sécurité
- - Ne pas porter de **gants** (ils risqueraient de fondre)
- Le banc Kofler est **chaud** lors de son utilisation : il faut donc faire attention à ne pas se brûler, y compris avec la spatule
- Vérifier les **pictogrammes** des éléments étudiés : certains éléments peuvent libérer des fumées dangereuses lors de leur évaporation. A ce moment-là, il faudra utiliser le banc Kofler sous la sorbonne (enceinte ventilée qui protège l'utilisateur des fumées néfastes)
- Porter une **blouse** tout le long de la manipulation
#### Utilisation de l'appareil
- Pour allumer l'appareil, le brancher et appuyer sur l'interrupteur : quand il est rouge, l'appareil est allumé :[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-09/20230926-155013.jpg)
- L'appareil est chaud quand le voyant vert **clignote** :
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-09/20230926-155015.jpg)
#### Étalonnage de l'appareil
Avant toute mesure et **entre** chaque mesure, l'appareil doit être étalonné, afin d'avoir une meilleure précision dans la détermination du point de fusion du produit d'intérêt.
Dans le cas où la température de fusion du produit est inconnue, il faut déterminer vers quelle température il fond, afin de choisir le bon étalon. Ainsi, avant d'étalonner proprement le banc, on suit les cinq premières étapes du protocole ci-dessous. Une fois que la gamme de température de fusion du produit a été déterminée, on peut étalonner l'appareil. Pour cela, on choisit l'étalon dont la température de fusion connue est la plus proche de la gamme que l'on vient de déterminer et on suit le protocole suivant et ce, jusqu'à la fin :
1. Nettoyer le banc Kofler et la spatule à l'aide d'un chiffon imbibé d'éthanol
2. Sélectionner le bon étalon : l'étalon doit avoir un point de fusion proche mais toujours inférieur à celui attendu pour l'échantillon. (Les étalons sont à demander aux responsables du FabLab - Steve Hubert ou Simon Lanis)
Dans ce cas-ci, le point de fusion de l'échantillon est attendu aux alentours de 120°C : on va donc choisir l'étalon à 113.9 °C.
3. Prélever une très petite quantité de l'étalon avec la spatule et la mettre du côté le plus froid du banc (le côté droit)
4. Former une diagonale fine avec la spatule et la faire glisser lentement vers la gauche
5. Lorsque l'étalon commence à fondre, s'arrêter et pointer la température correspondante avec l'aiguille (pas besoin de pointer avec l'aiguille s'il s'agit de déterminer la gamme de température de fusion)
6. Ajuster la petite aiguille jusqu'à la température connue de l'échantillon. Ici, c'est 113, 9°C (donc arrondi à 114°C)
7. Avec la pissette d'éthanol et un chiffon, nettoyer (sans se brûler) le banc, la spatule et l'aiguille.
8. Le banc est prêt à être utilisé ! :)
#### Déroulement de la mesure
Après le nettoyage du banc, de l'aiguille et de la spatule, de même qu'avec l'étalonnage, on peut prélever une petite quantité de l'élément à tester avec la spatule, former une fine diagonale avec l’élément et la décaler jusqu'à observation de sa fusion. Ensuite, on peut faire glisser la grande aiguille pour qu'elle pointe la limite entre les états liquide et solide de l'élément. La température affichée par la petite aiguille est celle recherchée.
Après utilisation du banc, faire attention à nettoyer de nouveau le matériel, à froid.
# Chlorophyll meter SPAD-502Plus
Chlorophylle mètre
# Mode d'emploi
#### **Présentation de l’appareil**
**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/chlorophyll-meter.jpeg)**
Cet appareil permet de mesurer la teneur en chlorophylle de feuilles de plantes.
Unité utilisé : SPAD
Conversion : 2 SPAD = 0.9960 +-6% nmol/cm^2 ou 0.9809 +-6% nmol/mg de chlorophylle
Zone de mesure : 2mm x 3mm
Épaisseur max. : 1.2mm
#### **Mode d'emploi**
Allumage :
1- Tourner le bouton sur "on" et attendre que l'appareil affiche "calibrage"
2- Faire une mesure à vide pour calibrer et en cas de problème répéter l'opération
3- Faire ses mesures
Autres fonctions utiles :
Utiliser le butoir :
\- Retirer le butoir et le remettre dans l'autre sens
\- Régler la profondeur souhaiter suivant les besoins
Insérer une compensation :
\- Appuyer sur "average" et "data recall" à l'allumage
\- Régler la compensation souhaité avec les boutons "all data clear" et "1 data delet"
\- Appuyer sur "average" pour valider
\- Éteindre et rallumer l'appareil
\- Faire ses mesures normalement
Pour retirer la compensation : la régler sur 0.0
Vérifier que l'appareil fonctionne correctement :
\- Appuyer sur "data recall" et "1 data delete" à l'allumage pour lancer le "check mode"
\- Retirer le butoir
\- Insérer le témoin
\- Faire quelques mesures
\- Vérifier en appuyant sur "average" que la valeur se trouve dans la marge d'erreur du témoin
# Spectrophotomètres
# Spectrophotomètre Biochrom Libra
**Manuel avancé d'utilisation du spectrophotomètre (en anglais)** : [https://www.aquaterra.hu/upload/document/catalog\_data/21257/biochrom\_libra\_s50\_s60\_s70\_s80\_user\_manual\_v2.pdf](https://www.aquaterra.hu/upload/document/catalog_data/21257/biochrom_libra_s50_s60_s70_s80_user_manual_v2.pdf)
#### **INTRODUCTION AU SPECTROPHOTOMÈTRE BIOCHROM LIBRA S60
**
**Le Biochrom Libra** est un spectrophotomètre - dispositif optique conçu pour faire passer l'énergie lumineuse à travers un échantillon. La réduction de la transmission de l'énergie lumineuse et des pics d'absorbance correspondants sont utilisés pour **déterminer la composition de l’échantillon** ou, par comparaison avec des étalons de concentration connus, pour **déterminer le** **concentration d'un échantillon.**
Le Biochrom Libra permet des études dans la gamme **de 190 à 1100 nm** - c'est un spectrophotomètre UV/visible.
#### **Description du spectrophotomètre**
| [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-05/img-7289.jpg) | [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-05/QkPimg-7290.jpg)
|
Le spectrophotomètre permet de **mesurer plusieurs cuves simultanément**. Sur la photo de gauche, on peut voir le compartiment où on place notre cuve d'échantillon à analyser à gauche. Sur la photo de droite, l'emplacement de la cuve la plus éloigné correspond à l'emplacement du blanc d'absorption. Les 5 autres compartiments correspondent à l'emplacement des cuves avec l'échantillon.
Il faut faire attention à l'emplacement des cuves et le sens du faisceau lumineux. Orientez le côté transparent de vos cuves sur le bord droit du spectrophotomètre.
#### **Fonctionnement de l'équipement: Contrôles et indicateurs**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/ZPRimage.png)
L'indicateur en haut à gauche : **LED USB** indique que l'instrument enregistre sur la clé USB. La clé ne doit pas être retirée tant que ce voyant est allumé.
L'indicateur en bas : **état de l'instrument**
- **Orange - **pendant le démarrage et la calibration
- **Vert -** l'instrument est allumé et a passé les tests de calibration de démarrage
- **Rouge -** l'instrument est allumé et a échoué aux tests de calibration de démarrage
**Si le voyant sous l'écran est rouge au démarrage, rallumez la machine. Si le problème persiste, signalez l'anomalie à un membre du personnel.**
#### **Comment utiliser le BIOCHROM LIBRA S60**
##### **Démarrage**
1. **Commencez par allumer l'appareil.** Appuyez sur le bouton d'alimentation à gauche de la machine au niveau du câble d'alimentation. Le spectrophotomètre effectuera ensuite une série de test pendant 5mn. Vous pouvez commencer à l'utiliser dès que le voyant sous l'écran apparait vert. Les meilleures performances sont obtenues si l'instrument **est allumé pendant** **au moins 30 minutes avant d’être utilisé** .
2. **Reliez l'appareil à l'ordinateur.** Rendez-vous sur le logiciel "Spectro" sur le bureau de l'ordinateur après avoir ouvert le spectrophotomètre. La connexion devrait se faire automatiquement.
3. **Préparez les échantillons à blanc (des références)**
4. **Préparez les solutions des échantillons.** La solution échantillon comprend normalement l'échantillon à tester dissous dans la solution de référence. Lorsque vous placez les cellules dans l'équipement, assurez-vous que la cellule est orientée de manière à ce que la lumière passera par la cellule.
Vous pouvez aussi directement utiliser l'interface du spectrophotomètre sans passer par l'ordinateur et extraire vos donnés directement du spectrophotomètre grâce au port USB présent sur le bord gauche de la borne de l'écran. De là vous pourrait confortablement poursuivre le traitement de vos donnés sur votre propre terminal.
##### **Interface**
Une fois la machine opérationnel, une fenêtre avec 6 icônes apparait. Pour effectuer vos mesures, appuyez sur l'icône **Applications**, plusieurs options s'offre à vous :
- - **Longueur d'onde unique** Mesure l'absorbance à une longueur d'onde spécifique.
- **Balayage de spectre** Mesure l'absorbance entre 2 longueur d'onde choisi par l'utilisateur entre 190 et 1100 nm.
- **Cinétique** Mesure simultanément plusieurs absorbance sur le temps.
- **Courbe étalon** Mesure de la concentration à une longueur d'onde donné par la génération d'une courbe de calibration standardisé.
- **Éditeur d'équation** Méthode de mesure personnalisé.
- [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-05/92Zimage.png)
#### **TEST**
Pour effectuer un test du spectrophotomètre on peut utiliser **l'érythrosine et le vert de méthyle**, qui sont des colorants de synthèse rouge et vert respectivement souvent utilisés comme standard dans des expériences de spectrophotométrie. Ils sont très soluble dans l'eau . Le **pic d'absorbance de l'érythrosine est de 530 nm** dans l'eau.
#### Matériel et Réactifs
1. **Érythrosine** (colorant alimentaire rouge)
2. **Solvant** ( l'eau distillée)
3. **Cuves de spectrophotométrie** et **verrerie de laboratoire** (béchers, fioles jaugées)
#### Préparation des Solutions
- **Préparer la solution mère d'Érythrosine** :
- Dissolvez une quantité précise d'Érythrosine dans de l'eau distillée pour obtenir une concentration connue de la **solution mère à 0,1 mg/mL** .
- **Préparer une série de solutions diluées et la solution de blanc :** :
- Préparez une série des solutions de concentrations décroissantes (par exemple, on a pris des solutions de **0,01 mg**/mL, 0.001 mg/mL ) en diluant la solution mère. Ces solutions serviront à établir une courbe d'étalonnage.
- Utilisez de l'eau distillée comme solution de blanc.
- **Remplir les cuves** :
- Remplissez chaque cuve avec les différentes solutions préparées : une cuve pour la solution de blanc, et les autres cuves pour les solutions d'Érythrosine de différentes concentrations.
- **Placer les cuves dans le spectrophotomètre** :
- Placez chaque cuve dans le compartiment de l'échantillon du spectrophotomètre
- **Calibrer le spectrophotomètre** :
- Utilisez la solution de blanc pour calibrer le spectrophotomètre en appuyant sur le bouton "**Take Reference**". Cela permettra d'établir la référence zéro.
#### Préparation de la solution aqueuse du vert de méthyle
#### Matériel et réactifs
- Balance de précision
- Pigment de vert de méthyle
- Eau distillée
- Pipettes
- Fioles jaugées de 100 ml
1. **Pesée du pigment**:
- Peser précisément 10 mg de pigment de vert de méthyle à l'aide d'une balance de précision.
2. **Préparation de la solution mère**:
- Dissoudre les 10 mg de pigment dans 100 ml d'eau distillée.
- La concentration massique de cette solution mère est de 0,01 mg/ml.
3. **Dilution de la solution mère**:
- La solution obtenue est très concentrée. Pour obtenir une solution moins concentrée, procéder à une dilution au dixième.
- Prélever 1 ml de la solution mère (0,01 mg/ml) et ajouter 9 ml d'eau distillée.
- La concentration de la solution diluée est alors de 0,001 mg/ml.
4. **Préparation des solutions étalons**:
- Réaliser des dilutions en série pour obtenir une gamme de solutions avec des concentrations différentes à partir de la solution mère.
- Conserver les concentrations suivantes :
- Solution mère : 0,01 mg/ml
- Première dilution (C1) : 0,001 mg/ml
- Deuxième dilution (C2) : 0,0001 mg/ml
Attention : l'emplacement de l’échantillon numéro 1 est situé vers le bas de l'appareil.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/image.jpeg)
Appuyez sur le bouton de **prise de mesure**.
**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/Vykimage.png)**
**La mesure de référence sera automatiquement soustraite de la mesure de l'échantillon.** L'écran affichera un tableau sous l'analyse avec les paramètres mésures. Pour ajouter manuellement un pic ou une vallée au tableau, placez le curseur sur la caractéristique souhaitée en touchant la caractéristique ou en utilisant les curseurs gauche et droit et appuyez sur une cellule vide du tableau.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/TVIimage.png)
##### **Mode SINGLE WAVELENGT - Longueur d'onde unique**
L'application Single Wavelength permet d'effectuer des mesures simples d'absorbance (A) et de pourcentage de transmission (%T) sur des échantillons, en mesurant la quantité de lumière qui a traversé l'échantillon par rapport à la longueur d'onde par rapport à une référence.
**PARAMÈTRES DE MESURE**
Régler le mode sur Absorbance ou %T. La longueur d'onde, le temps d'intégration et le mode lampe peuvent être réglés selon les besoins. Le nom de l'échantillon ***(Sample Seed***) saisi sous ***Sample*** sera le nom de fichier utilisé pour tout fichier de données sauvegardé automatiquement.
**EFFECTUER UNE MESURE**
Pour prendre une mesure, insérez une cuve contenant le solution de référence (de l'eau distillée) dans le porte-cuve de référence (en haut de l'appareil) et des cuves contenant l'échantillon dans les supports. Appuyez sur le bouton de **prise de mesure**. **La mesure de référence sera automatiquement soustraite de la mesure de l'échantillon.**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/xnGimage.png)
L’écran affichera le paramètre mesuré sur votre échantillon (vérifier bien que le régime "*monocuve*" est choisi pour conduire la mesure sur un seul échantillon).
### Utilisation du logiciel Spectro
##### **Lancement**
Une fois démarré, le logiciel devrait détecter automatiquement le spectrophotomètre Libra S60.
Si ce n'est pas le cas, allez dans le menu "Paramètres" ou "Appareil" et sélectionnez manuellement le Libra S60 dans la liste des appareils disponibles.
##### **Navigation**
Le menu de l'application s'ouvre en cliquant sur [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/npYimage.png)
**Resolution** comporte quatre onglets principaux qui permettent d'accéder à toutes les options de l'application.
- **Setup** - Configuration. Contient des boutons pour les tâches courantes (par exemple : copier, coller, options d'affichage des courbes, etc.).
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/4eUimage.png)
- **Applications - Affiche les différents types de mesure qu'il est possible de réaliser
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/zXHimage.png)
- **User Methods** - Méthodes utilisateur
- **Help** -Donne accès au manuel détaillé sur l'utilisation du logiciel
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/i6Bimage.png)
Lorsque les fichiers de données contiennent des informations graphiques (par exemple, Quick Scan, Wavelength Scan,
les données sur les étalons en analyse quantitative et en cinétique), il existe des options de manipulation des données
de données graphiques.
- Outils graphiques : Design
- Outils graphiques : **Layout** - Mise en page
#### **Applications**
Les applications de mesure suivantes sont disponibles :
- **Applications rapides :**
Quick Read
Balayage de base de l'échantillon qui vous permet d'effectuer un contrôle rapide de l'échantillon à une longueur d'onde spécifiée et de déterminer une valeur de concentration rapide en utilisant un facteur prédéfini.
Pour effectuer une lecture rapide d'une acquisition :
1\. Affichez la fenêtre Quick Read
2\. Sélectionnez l'onglet Acquire
[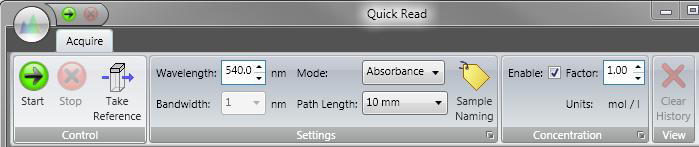](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/EgHimage.png)
3\. Entrer la longueur d'onde pour laquelle la lecture rapide doit être effectuée.
Si la longueur d'onde est réglée en dehors de la plage autorisée pour le banc optique actuel, elle est automatiquement changée pour la limite de ce banc optique.
4\. Sélectionnez le mode d'acquisition ( Absorbance ou transmission) et autres des autres paramètres que vous souhaitez régler.
5.Cliquez sur **Prendre la référence [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/LDgimage.png)ou ALT, Q, R**. Une référence est utilisée pour toutes les acquisitions d'échantillons ultérieures dans la session en cours.
6\. Cliquez sur **Start** [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/qfoimage.png) (Démarrer) ou **ALT, Q, S**
L'acquisition est lancée, avec la dernière lecture et tous les échantillons précédents et l'historique de référence affichés dans la fenêtre.
[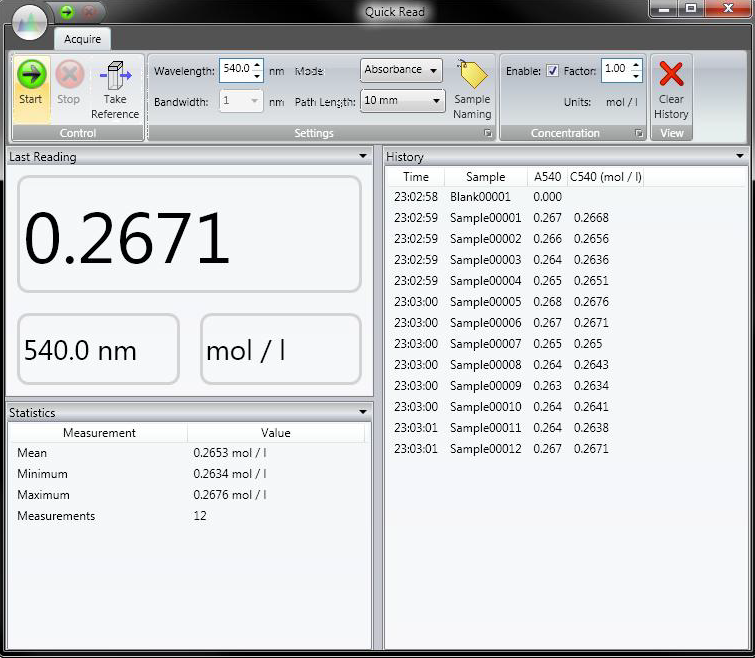](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/wmPimage.png)
**Dénomination des échantillons :**
1\. Cliquez sur **Sample Naming**
2\. Sélectionnez la méthode de désignation. Les options sont les suivantes
- **Automatic naming** - L'échantillon et toutes les références acquises sont nommés en fonction de la série et du nombre spécifiés.
- **Prompt for name** - Vous serez demandé d'entrer le nom de l'échantillon pour chaque référence et chaque échantillon avant l'acquisition.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/6GDimage.png)
3\. Cliquez sur **OK**
**Conversion de concentration :**
1\. Cochez l'option **Enable** (Activer) dans le module **Concentration** (n'est disponible que si le mode est réglé sur Absorbance.)
2\. Saisir un facteur de concentration
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/53Vimage.png)
Pour configurer les paramètres de concentration cliquez sur le lanceur de la boîte de dialogue **Concentration.**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/3SPimage.png)
Cochez l'option Enable (Activer) et sélectionnez le type de concentration et les unités de concentration et cliquez sur **OK.**
**Effacer l'affichage :**
1\. Sélectionnez le bouton **Acquire**.
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/bgjimage.png)
2\. Cliquez sur Clear History (Effacer l'historique)
3\. Cliquez sur **Yes** sur l'onglet
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/2Ubimage.png)
L'affichage des résultats est effacé
Quick Scan
L'application **Quick Scan** vous permet d'effectuer un contrôle qualitatif rapide de l'échantillon et de surveiller l'échantillon pour déterminer sa stabilité.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/Cotimage.png)
**Utilisation de Quick Scan**
1\. Afficher la fenêtre d'analyse rapide
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/oOGimage.png)
2\. Sélectionnez l'onglet **Acquire** et entrez les longueurs d'onde **Low** et **High** pour définir la plage sur laquelle effectuer le balayage rapide
Si la longueur d'onde basse ou haute est réglée en dehors de la plage autorisée pour le banc optique actuel, elle est automatiquement remplacée par la limite pour ce banc optique.
3\. Sélectionnez **Interval** parmi les options disponibles dans la liste déroulante.
( la plage de balayage sélectionnée doit être divisible par l'intervalle sélectionné pour que les réglages soient valides )
4\. Sélectionnez la largeur de bande, le mode d'acquisition, la vitesse de balayage et la longueur du chemin.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/kDKimage.png)
5.Cliquez sur **Prendre la référence [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/LDgimage.png)ou ALT, Q, R**. Une référence est utilisée pour toutes les acquisitions d'échantillons ultérieures dans la session en cours.
6\. Cliquez sur **Start** [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/qfoimage.png) (Démarrer) ou **ALT, Q, S.**
[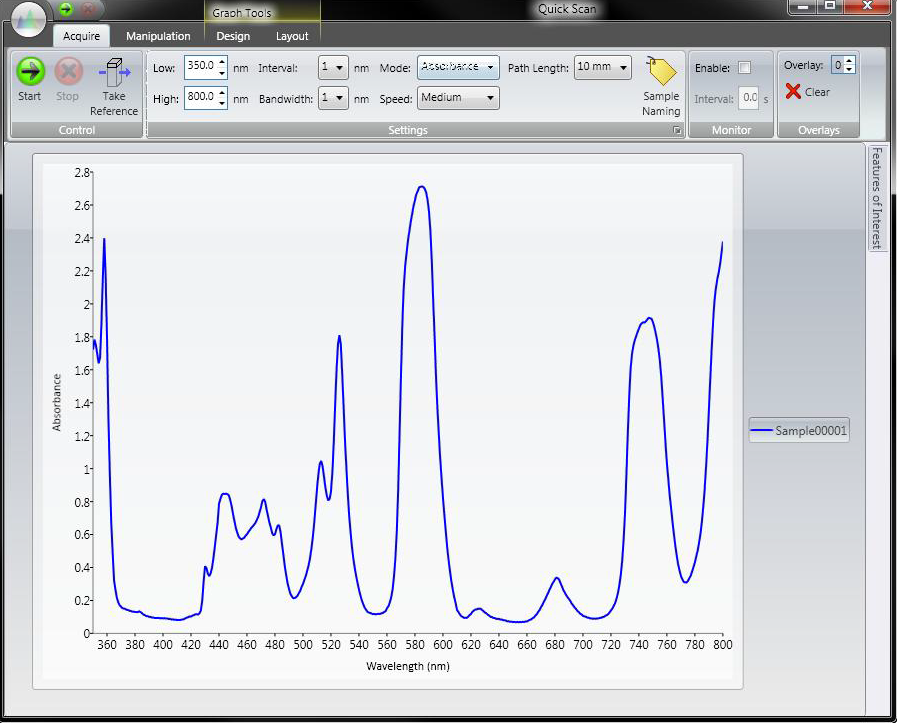](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/kJpimage.png)
Après l'acquisition, vous pouvez visualiser les données de référence acquises et identifier les caractéristiques des spectres. Vous pouvez également utiliser les différents outils d'affichage et de manipulation graphiques.
**Dénomination des échantillons :**
1\. Cliquez sur **Sample Naming**
2\. Sélectionnez la méthode de désignation. Les options sont les suivantes
- **Automatic naming** - L'échantillon et toutes les références acquises sont nommés en fonction de la série et du nombre spécifiés.
- **Prompt for name** - Vous serez demandé d'entrer le nom de l'échantillon pour chaque référence et chaque échantillon avant l'acquisition.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/6GDimage.png)
3\. Cliquez sur **OK**
**L'acquisition en continu :**
1. Cochez l'option **Enable** dans le **Monitor**
2. Saisissez un intervalle (en secondes) est le temps entre le début d'une acquisition et le début de la suivante.
Pour prendre des spectres consécutifs avec un délai minimal entre la fin d'une acquisition et le début de la suivante, réglez l'intervalle sur '0'.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/IZWimage.png)
**Spécifier le nombre de superpositions :**
Utilisez la commande **"Overlay spin-control"** pour configurer le nombre de superpositions à afficher
La valeur "0" indique qu'une seule trace sera affichée sans superposition.
Pour effacer toutes les superpositions en cours, cliquez sur **Clear (Effacer).**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/B8Rimage.png)
**Enregistrer les résultats de l'analyse rapide :**
Vous pouvez enregistrer les résultats de l'analyse rapide une fois que l'acquisition a été arrêtée.
#### Manipulation Rapide des Données d'Analyse
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/8Bjimage.png)
**- Pour visualiser les courbes de référence avec les données acquises: **
1. Sélectionnez l'onglet **Format**
2. Cliquez sur** Show References**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/rQWimage.png)
La ou les références correspondent aux données acquises sont affichées sur l'afficheur. Les l'ordre des légendes reflète l'ordre d'acquisition.
- Pour trouver automatiquement les caractéristiques
1. Sélectionnez l'onglet **Format**
2. Cliquez sur **Find Features**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-06/Yg9image.png)
NB :
- Il n'est pas possible de modifier les paramètres d'acquisition lorsque l'acquisition des données est en cours
- Si la longueur d'onde, le mode ou la largeur de bande sont modifiés, une nouvelle référence est nécessaire.
( Start ne sera pas sélectionnable).
- Lorsqu'une acquisition est lancée après avoir modifié l'un des paramètres, les résultats précédents affichés dans la fenêtre sont supprimés. Si vous souhaitez conserver les résultats actuellement affichés, vous devez les sauvegarder avant de lancer l'acquisition.
- **Applications :**
o **Longueur d'onde fixe** - Mesure de l'absorbance ou du %T à 1 à 10 longueurs d'onde différentes
o **Balayage de longueur d'onde** - Réalisation d'un balayage d'échantillon, manipulation et comparaison de spectres
o **Analyse quantitative** - Mesure de l'absorbance et détermination de la concentration à l'aide de courbe étalon. Permet des mesures à plus d'une longueur d'onde et plus d'une courbe de concentration pour déterminer des courbes à longueurs d'onde multiples.
o **Cinétique** - Absorbance en fonction du temps
#### Instructions pour la prise de mesure d'absorbance
#### Matériel et réactifs
- Spectrophotomètre
- Cuvettes
- Solution de référence (zéro)
- Solution d'échantillon
1. **Préparation des cuvettes**:
- Remplir une cuvette avec la solution de référence (zéro).
- Remplir une autre cuvette avec la solution dont l'absorbance doit être mesurée.
2. **Insertion des cuvettes**:
- Insérer la cuvette contenant la solution de référence dans la cellule de référence isolée du spectrophotomètre.
- En même temps, insérer la cuvette contenant la solution d'échantillon dans la cellule de mesure.
3. **Prise de mesure**:
- Appuyer sur le bouton "take measurement" pour lancer la mesure.
- La mesure de référence sera automatiquement soustraite de la mesure de l'échantillon, assurant ainsi une mesure précise de l'absorbance de l'échantillon.
4. **Mesure d'un seul échantillon**:
- Si vous souhaitez effectuer une mesure d’un seul échantillon, réglez le paramètre "monocuve - oui" sur le spectrophotomètre.
**Spectrophotomètre UV-1605 SHIMADZU**
Sur la photo de droite, on peut voir le compartiment où on place notre cuve d'échantillon à analyser (celui du devant) et la référence est placé derrière.
*N.B: Il faut faire attention à l'emplacement des cuves et le sens du faisceau lumineux. (Suivre les flèches sur la machine)*
##### **Liste des tâches**
**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-162058.jpg)**
- Appuyer sur le bouton alimentation qui se trouve sur la gauche de la machine afin de la mettre en route
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-165021.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/VXx20171206-162203.jpg)
- Après la mise en route de la machine, attendre environ 5 minutes pour que cette dernière puisse faire la vérifications de certains paramètres. On sait que c'est bon lorsque toutes les étoiles sont blanches, comme sur la photo ci-dessus (à droite).
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-174834.jpg)
- Une fois le spectrophotomètre fonctionnel, la fenêtre ci-dessus apparait. Pour effectuer les réglages sûr les 4 anglets, du bas de la fenêtre en appuyant sur F1 , F42…
Par exemple sur F1 on change de l'absorbance vers la transmittance:
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-175725.jpg)
- En appuyant sur le bouton bleu “MODE”, on peut choisir ce que l'on veut faire avec le specto.
**Exemple:** Pour avoir le spectre d'Absorption on appuie sur le bouton “2”:
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-175734.jpg)
- Une seconde fois sur “2” pour changer la gamme de la longueur d'onde que le spectro va balayer et qui vous intéresse pour l'analyse: Avec le clavier numéroté pour pour entrer la longueur d'onde et “Entrer” pour sauvegarder la valeur.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-175739.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-175807.jpg)
- Une fois les réglages concernant l'analyse sont faits, appuyez sur le bouton “ START” pour lancer l'analyse:
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-175926.jpg)
- Un bip sera émit lorsque l'analyse sera terminée, et le spectre d’absorption apparaitra.
- On peut effectuer un“ZOOM” en appuyant sur “F1” ou faire apparaitre le tableau des valeurs d’absorbance avec “F2”
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-175954.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/20171206-180004.jpg)
# Spectrophotomètre UV-visible (Jenway)
Présentation
Spectromètre à cuve permettant des mesures dans des liquides en spectre continu de l'UV-visible .
A savoir:
Il existe plusieurs types de cuve suivant l'échantillon.
La transmittance T est définie par : T = It,λ / I0,λ. On l’exprime en pourcentage.
L’absorbance A se calcule par : A = log(I0,λ / It,λ) = - logT. C’est une grandeur positive.
**Ici on va mesurer l’absorbance en fonction de différentes longueurs d'ondes en nanomètre.(ponctuel)**
**Aller dans le menu « Photometrics »**
1. Choisir ses paramètres de mesures : longueur d’onde (nm)
2. Faire la calibration avec le bouton "Blank"[ en utilisant la même longueur d’onde prévue pour la mesure (l’absorbance doit être à 0.00 et la transmittance à 100%)](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-04/jenway.JPG)
3. Insérer l’échantillon et exécuter la mesure avec la touche "sample"
**Il est également possible d’effectuer un spectre d’absorption en fonction de plusieurs longueurs d’ondes. (Continu)**
**Aller dans le menu « Spectrum »**
1. choisir ses paramétrer de mesures: intervalle du spectre ( « » et la « fin » de la mesure souhaitée); la fréquence des mesures souhaitées
2. Faire la calibration avec « Blank » .
3. Insérer l’échantillon et exécuter avec « sample »
4. relever le spectre
Calcul de la concentration moléculaire du D-Mannitol:
c = m/(M\*V)
M = 182.17 g/mol
m = 0.5 g
V = 1 mL
c = 2,74 mol/L
On va faire une dilution
On utilise l'équation C1V1=C2V2
C1 = 2,74
V1 = 1mL
V2 = 10mL (On veut un volume final de 10mL)
on cherche C2
# Roto-évaporateur
Appareil d'extraction des solvants.
# Evaporateur rotatif
#### Présentation de l'appareil
Cet appareil permet l'évaporation du solvant après une synthèse, grâce au principe de la distillation. Le solvant, étant en général plus volatil que le produit de synthèse, est facile à faire évaporer, en jouant sur la température et la pression. En effet, en abaissant la pression et en augmentant la température, on peut faire passer le solvant de l'état liquide à l'état gazeux.
L'évaporateur rotatif est composé de plusieurs parties:
- - - un bain thermostaté, afin d'être à température constante
- un réfrigérant pour liquéfier les vapeurs de solvant
- une pompe à vide pour abaisser la pression
- une entrée d'eau
- un ballon pour récupérer le solvant
- un moteur permettant la rotation du ballon contenant le produit en solution
*photo*
#### Mode d'emploi
Selon le solvant que l'on souhaite évaporer, il n'est pas forcément nécessaire de mettre en route la pompe à vide pour diminuer la pression. Dans le cas où on se met à faible pression, la température du bain-marie pourra être diminuée. Ainsi, pour faire évaporer notre solvant, on suit le protocole suivant:
- - - allumer le bain-marie et le régler à la température désirée
- ouvrir l'entrée d'eau pour le réfrigérant
- remplir le ballon avec le produit d'intérêt en solution et le fixer à la bague rotative (faire attention à ce que la taille du goulot du ballon et de l'appareil correspondent)
- mettre en route la rotation du ballon
- allumer la pompe à vide
- fermer l'entrée d'air
- abaisser le ballon dans le bain-marie pour qu'il trempe sur 1/3 bas
Lorsque l'évaporation est terminée, on procède au même protocole dans le sens inverse:
- - - remonter le ballon du bain-marie
- ouvrir l'entrée d'air
- éteindre la pompe à vide
- arrêter la rotation du ballon
- détacher le ballon
- fermer l'entrée d'eau pour le réfrigérant
- éteindre le bain-marie
#### Précautions d'emploi
L'utilisation de l'évaporateur rotatif demande de faire attention à quelques points, dont la mise en ébullition du solvant qui peut faire entrer des gouttes dans le réfrigérant. Si le solvant venait à buller fortement de la sorte, on peut augmenter la vitesse de rotation du ballon ou contrôler manuellement la pression, en gardant une main sur l'entrée d'air. Il faut également faire attention à la verrerie utilisée car si celle-ci est endommagée, il peut avoir un risque de casse.
# Utilisation du réfrigérateur hi-chill 250
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/img-0375.jpeg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/img-0376.jpeg)
Utilisation primaire pour l’évaporateur rotatif Hei-VAP Core:
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/img-0374.jpeg)
**NOTICE UTILISATEUR :**
Lien vers la notice d’utilisateur: *[https://heidolph-instruments.com/documents/operation%20manuals/chiller/Operation-Manual-Chiller-Hei-CHILL%20250-1200.pdf](https://heidolph-instruments.com/documents/operation%20manuals/chiller/Operation-Manual-Chiller-Hei-CHILL%20250-1200.pdf)*
Lien du descriptif appareil : [https://heidolph-instruments.com/fr/produits/print/22647](https://heidolph-instruments.com/fr/produits/print/22647)
Description : Refroidisseur compact qui se positionne facilement sur une paillasse de laboratoire. Capacité de refroidissement de 250 W. Systèmes de commande clairement disposés, grand écran à LED, clavier à membrane et fenêtre pour la surveillance du niveau de liquide. Fonction de démarrage et d'arrêt automatique.
- Plage de températures de -10°C à +40°C. Stabilité à la température de ± 0,5 K. Capacité de refroidissement à +20°C : 250 W.
- Dimensions : L 200 x P 350 x H 465 mm
Explication d'utilisation (en italien) : [https://www.youtube.com/watch?v=IoCwwN0i3uA&list=PLHXCtSDql0S9TKgFnqUGcejk9BmPgzCXB](https://www.youtube.com/watch?v=IoCwwN0i3uA&list=PLHXCtSDql0S9TKgFnqUGcejk9BmPgzCXB)
Exemples d'applications :
1\) **En chimie organique** : Dans la synthèse de composés organiques, il est souvent nécessaire de contrôler précisément la température lors de réactions exothermiques ou sensibles à la chaleur. Le refroidisseur peut maintenir une température constante dans un réacteur, ce qui est crucial pour obtenir des résultats reproductibles.
2\) **Extraction de solvants** : Lors de l'extraction de composés à partir de matrices complexes (par exemple, l'extraction de principes actifs à partir de plantes pour la préparation de médicaments), le refroidissement du solvant extrayant peut améliorer l'efficacité du processus tout en préservant la qualité des composés recherchés.
3\) **Purification par chromatographie** : Dans les techniques de chromatographie, le contrôle précis de la température peut améliorer la séparation des composés. Le refroidisseur peut maintenir une température constante dans le système de chromatographie liquide ou gazeuse, ce qui aide à obtenir des résultats plus fiables et reproductibles.
4\) **Synthèse de polymères** : Pour contrôler la vitesse de réaction et la taille des polymères synthétisés, le refroidisseur peut être utilisé pour maintenir des conditions de réaction spécifiques. Cela permet de contrôler la cinétique de réaction et les propriétés finales du polymère.
5\) **Culture cellulaire** : Dans certains protocoles de culture cellulaire, il est nécessaire de maintenir une température constante pour assurer la croissance cellulaire optimale. Le refroidisseur peut être utilisé pour refroidir les milieux de culture ou les incubateurs, fournissant ainsi un environnement stable pour les cellules.
Ce produit doit être utilisé avec un **liquide caloporteur avec une capacité thermique élevée** pour circuits de thermostatisation ouverts ou fermés (Mélange eau-Glycol avec une très bonne résistance au gel REACH et RoHs conforme). Un bidon de 5 litres de *KRYO 30 (marque Lauda)* peut être une bonne référence de liquide caloporteur.
Photographie du liquide de refroidissement Lauda Kryo 30 :
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-02/7L9img-0372.jpeg)
*Permet un refroidissement plus efficace sans utiliser de grandes quantités d’eau de robinet.*
# Balance de précision
Balance sous cloche permettant des pesées fines au mg.
# Balance d'analyse KERN
#### Présentation de l'appareil
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-10/v4Fimg-3636.PNG)
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/idtimage.png)
##### **1. Généralités**
##### **Principe **
Une balance à précision est un instrument de mesure qui permet de peser des objets avec une très haute précision, généralement à des échelles de poids très faibles. La balance est composée d'une cloche s'ouvrant grâce à des portes coulissantes, sur les cotés et le haut de l'appareil. Sous la cloche, on peut trouver au centre le capteur de pesée. Enfin, en dehors de la cloche, on a l'écran ainsi que six touches pour notamment allumer/éteindre ou calibrer l'appareil. Cette balance permet de faire des mesures jusqu'à 320g. Les balances à précision peuvent mesurer des poids allant de quelques milligrammes (mg) à plusieurs grammes, mais ce qui les distingue des balances ordinaires, c’est leur capacité à donner des mesures très fines.
##### **Caractéristiques **
- **Plage de pesée** : Elle définit la capacité maximale que la balance peut peser (ex : 320 g pour le modèle KERN ABS320-4N (photo ci-dessus)).
- **Précision** : Elle définit la plus petite variation de poids que la balance peut détecter (ex : 0,0001 g).
- **Lecture numérique** : Les balances modernes affichent les résultats sur un écran numérique, ce qui permet une lecture facile et rapide.
- **Calibrage** : La balance doit être calibrée régulièrement pour garantir des mesures précises.
- **Stabilité de la lecture** : Les balances à précision doivent donner des résultats stables et ne pas être influencées par de petites perturbations.
- **Fonction tare** : Permet de soustraire le poids du récipient pour ne mesurer que celui de l’objet.
##### **2. Procédure d'utilisation d'une balance à précision**
**Préparation avant utilisation :**
- - S’assurer que la balance est placée sur une surface stable. (Éviter les endroits soumis à des vibrations, au vent ou à des courants d'air (près d'une fenêtre, par exemple), car cela pourrait fausser les mesures.)
- Vérifier que la balance est propre et en bon état de fonctionnement.
**Allumage de la balance** :
- Appuie sur le bouton d’allumage (sur ce bouton) et attendre quelques secondes pour que l'appareil s'initialise.
- Si nécessaire, procéder au calibrage comme indiquer sur la photo ci-dessous.
**Calibrage (si nécessaire) :**
- Pour calibrer l'appareil, il faut tourner les deux vis des pieds vers la gauche ou droite jusqu’à ce que la bulle situé à droite du bouton « Print » soit au centre :
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/bj8image.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/Oezimage.jpeg)
**Tarer** :
- Placez un récipient vide sur la balance puis appuyez sur la touche .Cela mettra la balance à zéro et soustraira le poids de l'objet ou du contenant, te permettant de ne peser que le produit à l’intérieur. La balance affichera “0.000” lorsque l'objet est en place, et tu pourras ensuite ajouter le produit à peser.
**Peser** :
- Placez l’objet à peser sur le plateau de la balance. Et s'assurez de fermer les portes coulissantes.
- Attendre que l'affichage se stabilise pour lire la valeur de la masse. Une flèche doit s'affiche sur le coté gauche.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/Rwvimage.jpeg)
**Changement d'unités (si nécessaire)** :
- Pour changer l’unité de mesure pour passer de gramme à milligramme, appuyez :
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/TkTimage.jpeg)
Maintenant la balance est passer de gramme à milligramme, pour bien s’assurer que l’unité est bien activée, il y’a normalement sur le côté gauche de l’écran l’affichage de la stabilité (sous forme de flèche) (comme ci-dessous):
**Changer de mode de pesée (si nécessaire) :** Il est possible de changer de mode de pesée en appuyant deux fois pour commencer sur le bouton [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/wZAimage.png):
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/cF1image.jpeg)
Ensuite pour changer de mode de pensée il suffit d’appuyer une fois sur ce même bouton. Il y a quatre modes : TOOLS / PASS.WRD / POURING / STAND.
**Extinction** :
- Éteindre la balance lorsque vous avez fini sur ce bouton
**Nettoyage** :
- S'assurez de bien nettoyer l'intérieur de la cloche
**Nettoyage de l'appareil **
- **Matériel nécessaire** : Pinceau, lingette sec.
- **Procédure** :
1. Éteindre la balance avant de la nettoyer.
2. Utiliser un pinceau, une lingette douce ou un chiffon propre pour essuyer délicatement le plateau et l’écran.
3. Ne pas utiliser de produits abrasifs, de solvants forts, ni d’eau pour éviter d’endommager les composants internes.
4. Vérifier régulièrement l'état des câbles et des capteurs pour s'assurer qu'ils ne sont pas obstrués par des poussières.
##### **3. Précautions**
- **Ne pas déplacer la balance**, au risque de changer la calibration
- Ouvrir et fermer les portes coulissantes avec soin
- Ne pas s'appuyer sur la paillasse pour éviter de crée des vibrations qui affecte la précision des mesures
- Utilise toujours la balance sur une surface plane et stable. Une surface inclinée peut fausser la lecture du poids.
# Centrifugeuse réfrigérée
Centrifugeuse à rotor interchangeables (1,5mL, 15mL, 50mL), permettant de travailler dans une gamme de température allant de l'ambiante à 4°C ou moins. 17000 rpm max.
# Consignes d'utilisation : Centrifugeuse réfigérée (Sirena)
**1 PRINCIPE ET APPLICATIONS**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/4gpimage.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/92Rimage.png)
Recherches : de la microbiologie à la recherche moléculaire en passant par la biochimie.
**2 INTERDICTIONS**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/vk5image.png)
**3 CONSIGNES DE SECURITE**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/pROimage.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/GfVimage.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/2lEimage.png)
**4 CARACTERISTIQUES**
[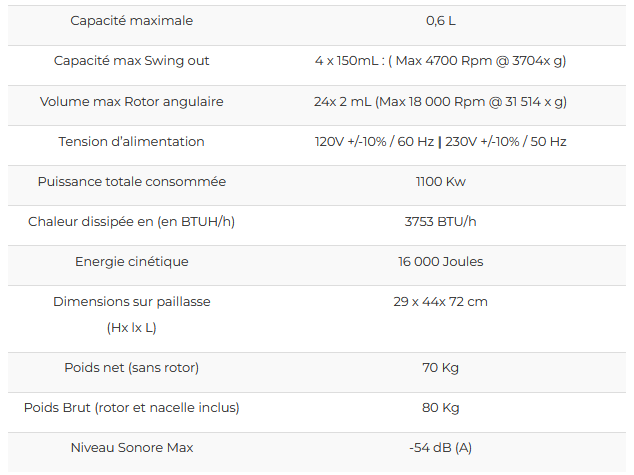](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/VR1image.png)
**5 PROCEDURE D'UTILISATION**
**SCHEMA RECAPITULATIF BOUTONS/PROGRAMMES/UNITES**
[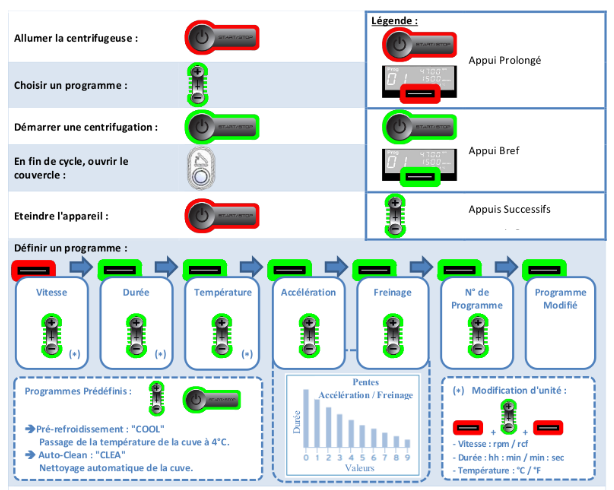](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/2Ynimage.png)
[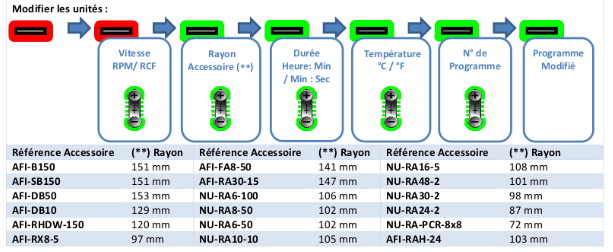](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/aQqimage.png)
**DESCRIPTION**
[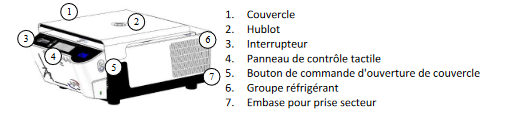](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/yjaimage.png)
**ACTIONNER LE COUVERCLE**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/hjcimage.png)
**PRE-REFROIDISSEMENT**
**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/CVOimage.png)**
**BOUTONS ET DESCRIPTIONS DE L'INTERFACE + CHOIX DU PROGRAMME. IMPORTANT: INFOS PRECISES SUR LE PARAMETRAGE ENSUITE (exemple: affichage du numéro de programme sous "prog" lorsqu'on appuie sur + ou -).**
[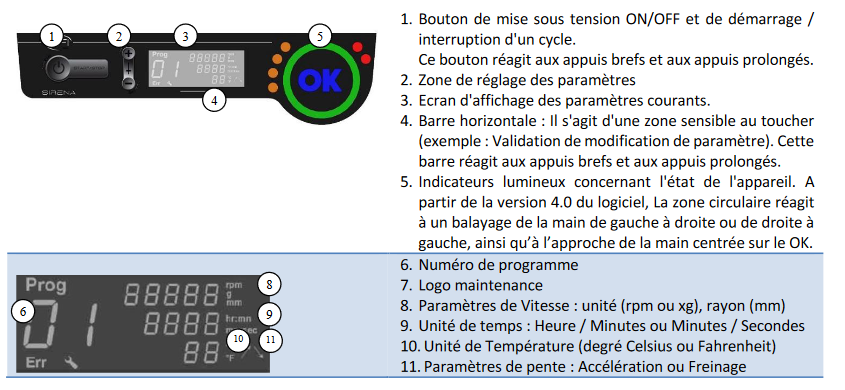](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/NiVimage.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/6svimage.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/a2limage.png)
**INTERROMPRE UNE CENTRIFUGATION**
[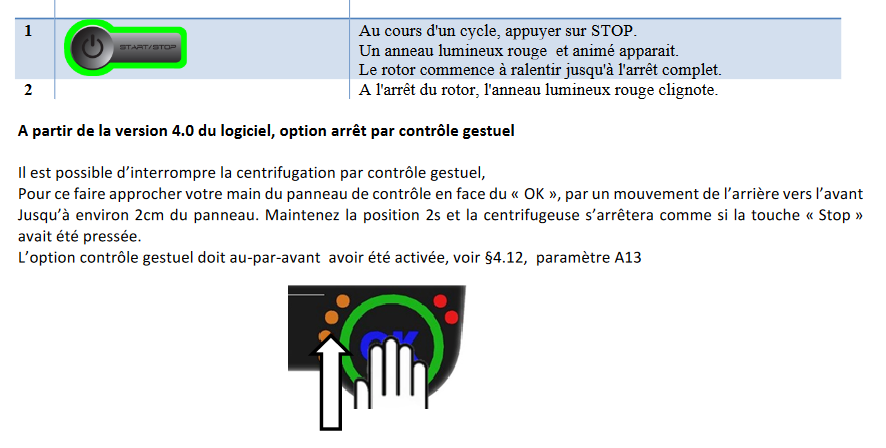](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/LFoimage.png)
***MODE PARAMETRAGE***
**Reglage de l'unité de vitesse/force centrifuge**
[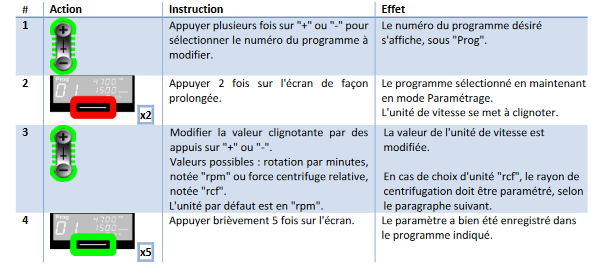](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/hW2image.png)
**Réglage du rayon de centrifugation**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/HlNimage.png)
**Réglage de l'unité du temps**
[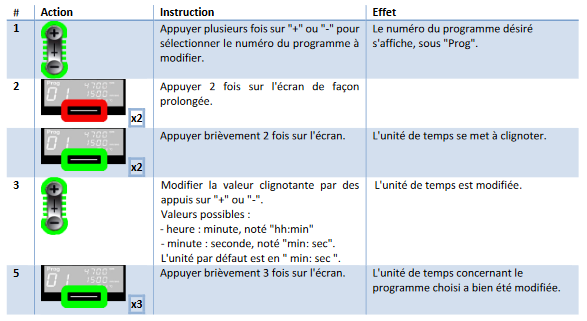](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/t8vimage.png)
**Réglage de la température**
[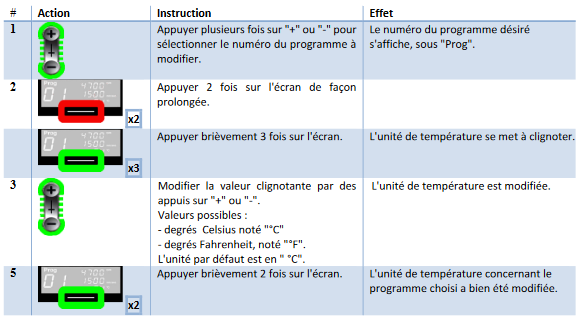](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/hPOimage.png)
**Paramètres avancés**
[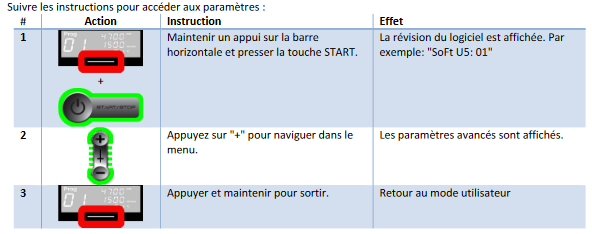](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/LS0image.png)
**OUVERTURE AUTOMATIQUE DU COUVERCLE**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/fKvimage.png)
**CONTROL GESTUEL**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/c0Wimage.png)
**REFROIDISSEMENT A L'ARRET POST-COOL**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-01/DhZimage.png)
**6 SOURCES**
file:///C:/Users/FabLabUser/Downloads/FR%20-%20SIRENA%20Manuel%20Utilisateur%20-%20Rev%201.3.pdf
https://www.afigroups.fr/sirena
**Allumer** en maintenant appuyer le bouton 1 Power. Ce bouton réagit aux appuis brefs et aux appuis prolongés.
**Choisir un programme** : appuyer sur + ou - (étape 2).
**Lancer une centrifugation** : appuyer brièvement sur power
**Modifier un programme :**
⦁ choisir le programme à modifier avec le '+' ou '-'
⦁ maintenir longtemps la barre tactile en bas de l'écran jusqu'à ce que la vitesse se mette a clignoter
(pour modifier la durée, appuyer une fois de plus brièvement et suivez le protocole )
(pour modifier la température, appuyer 2 fois )
(pour modifier accélération, appuyer 3 fois)
⦁ Modifier la valeur avec le '+' et le '-'
⦁ Pour valider le programme, appuyer brièvement 6 fois sur la barre en bas de l’écran.
(pour la durée, appuyer 5 fois brièvement pour valider)
(pour la température, appuyer 4 fois brièvement pour valider)
(pour l'accélération , appuyer 3 fois brièvement pour valider)
cela validera les autres paramètres non modifiés
**Utiliser le programme:**
⦁ choisir le programme avec le '+' et '-'
⦁ mettre les tubes dans le rotor et fermer le couvercle
⦁ appuyer brièvement sur le bouton power
lorsque les conditions du programme sont atteintes, il est affiché un 'OK'
**les unités par défauts :**
vitesse: tour par min (rpm)
durée: min:sec
température : degré Celsius
pente d'Accélération : plus la valeur est grande, plus le temps d’accélération diminue
# Conductimètre
Appareil permettant la mesure de conductimétrie dans un liquide. La conductimétrie se caractérise par les propriétés des solutions de laisser passer un courant électrique grâce aux ions. La conductimétrie permet d'évaluer quantitativement la concentration de la solution à haute précision.
# Conductimètre de paillasse F30 FiveEasy + Electrode LE703 Mettler
#### **Généralités**
**Principe : **
Les conductimètres, tels que le F30, mesurent la conductivité électrique d'une solution en faisant passer un courant alternatif entre deux électrodes de la sonde LE703. Ce courant est influencé par la concentration en ions de la solution, ces derniers servant de porteurs de charge. Le conductimètre convertit ensuite cette conductivité en données interprétables, qui correspondent à la concentration ionique de la solution.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/image.png)
**Conductimètre de paillasse F30 FiveEasy + Electrode LE7** **(1)**
(1) *https://www.atlanticlabo-ics.fr/conductimetre/14425-conductimetre-de-paillasse-f30-fiveeasy-electrode-le703-mettler.html#description-wrap*
**Caractéristiques : **
Plage de mesure conductivité : 0.01 µS/cm - 200 mS/cm
Résolution conductivité : 0.01 - 1
Précision conductivité : 0.5 %
Précision mV : 0
Résolution de température: 0,1 °C
Précision température (±): 0,5 °C
**Applications:**
**Qualité de l'eau** : Vérifier la pureté de l'eau pour des analyses et expériences précises.
**Biotechnologie et microbiologie** : contrôler la croissance des cellules et des microorganismes en mesurant les ions dans les milieux de culture.
**Préparation de solutions** : Vérifier la concentration des solutions et réactifs pour garantir la précision expérimentale.
**Électrochimie et matériaux** : Analyser les électrolytes et étudier les interactions ioniques dans les matériaux.
**Études environnementales** : Mesurer la conductivité des échantillons de sol et d'eau pour détecter des polluants et anomalies.
**Avantages: ** Mesure immédiate et facile, sensible aux ions , précise dans des conditions contrôlées.
**inconvénients**: Ne distingue pas les types d'ions, sensible à la température , inefficace pour les solutions sans ions.
##### **[Capteurs de conductivité et conductimètres - METTLER TOLEDO](https://www.mt.com/fr/fr/home/perm-lp/product-organizations/sea/conductivity-sensors-probes-cells.html?cmp=sea_52040413&SE=BING&Campaign=MT_PRO-ANA_FR_FR&Adgroup=PRO-ANA_Conductimetre_MT&bookedkeyword=conductim%C3%A8tre%20mettler&matchtype=p&adtext=77721891333254&placement=Bing-not_available&network=o&kclid=_k_f906bb1935fc1cd25d11dc358a1c84a5_k_&msclkid=f906bb1935fc1cd25d11dc358a1c84a5)**
#### **Procédure d'utilisation :**
1. Allumer l’appareil en appuyant sur le bouton exit : [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/aJ6image.png)
2. [Rincer les électrodes avec de l’eau distillée pour éviter toute contamination.](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/Exiimage.png)
3. Plonger les électrodes dans la solution à tester
4. appuyez sur le bouton read :[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/img-4263.jpeg)
5. Attendre quelques secondes que la valeur se stabilise, en vérifiant la température si elle est importante pour la précision.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/img-0192.jpeg)
6.Noter la conductivité affichée.
7.Rincer les électrodes avec de l’eau distillée après chaque utilisation pour éviter les dépôts.
8.appuyez sur exit pour éteindre l'appareil.
**Recommandations**
• Stockez le capteur dans de l'eau désionisée pendant 1 heure pour obtenir les meilleures performances de mesure.
• Pour réduire les bulles d'air, immergez la cellule avec un angle, puis mettez-la en position verticale.
• Si une bulle d'air est coincée dans la cellule de mesure, tapotez doucement sur le corps pour la faire disparaitre.
• Assurez-vous que la cellule de mesure est complètement immergée.
• Attendez que la cellule et l'échantillon aient la même température avant toute mesure.
Pour plus d'informations : [Bibliothèque Expert - METTLER TOLEDO](https://www.mt.com/fr/fr/home/library.tabs.custom2.html?cmp=als_library#cat=EXPERTISE&stp=1)
# Chambre climatique
Enceinte thermostatée permettant de réguler la température intérieure en positif et en négatif par rapport à la température ambiante.
# AutoClave de paillasse: Pression max 1.08bar (121°C)
# Utilisation de l'AutoClave de paillasse
#### **Taches à verifier**
1. Vérifier branchement à l’alimentation.
2. Vérifier que rien autour n'empêche l’évacuation de l’air, laisser les bouchons sur le couvercle : ils sont essentiels au bon fonctionnement de la machine !
3. Introduire de l’eau distillée jusqu'à couvrir le système de chauffe + 500 mL par 20 min d’utilisation (on utilise de l’eau distillée pour éviter les dépôts calcaire.)
4. Le programme est déjà prêt ! Ne pas modifier.
5. Appuyer sur le bouton vert pour allumer, puis le bouton noir pour allumer l'écran de programmation/affichage, quand s’affiche t°C 23 (ambiante) et 105 (température de stérilisation.) Appuyer sur start pendant 3 sec.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/autoclave4.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/autoclave1.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/autoclave2.jpg)
6. Vérifier la jauge de pression durant l’utilisation : 105°C=2.90PSI.
[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/autoclave3.jpg)
7. Pour éteindre, appuyer sur le bouton start/stop quelques secondes, puis appuyer sur l'interrupteur noir puis vert.
8. Attendre le refroidissement pour ouvrir et récupérer le matériel autoclavé.
# Incubateur
# Utilisation de l'incubateur
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-13.jpg)
##### **Liste des tâches:**
1\. Nettoyer et désinfecter les parois intérieures par précaution.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-1.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-2.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-3.jpg)
2\. Appuyer sur l'interrupteur, la température interne actuelle s’affiche au bout de quelques secondes.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-4.jpg)
3\. Appuyer sur FKT pour entrer dans le menu de configuration.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-6.jpg)
4\. Après 60 sec sans presser de bouton l’écran retournera à l’affichage de la température interne.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-7.jpg)
5\. L’écran affiche par alternance le paramètre et sa valeur. Changer la valeur du paramètre avec les flèches, changer de paramètre et valider le changement de valeur en appuyant de nouveau sur FKT 3 paramètres : "Set Point (SP)" de 0 à 70°C, "Timer Unit (t.Un)" minutes ou heures, "Timer Initial Value (t.st)" de 0 à 999 min ou de 0.0 à 99.9 hr , "t.of" signifie que le timer n’est pas actif.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-9.jpg)
6\. Appuyer sur "Time" pour lancer le timer , le timer n’attend pas que la température demandée soit atteinte, l’incubateur chauffe lentement il faut donc l’allumer longtemps à l’avance pour l’amener à la température d’utilisation et pouvoir utiliser le timer de manière effective.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/incubateur-10.jpg)
7\. Attendre que l’incubateur ait atteint la température demandée avant d’y insérer les échantillons.
8\. Après utilisation débrancher l’incubateur et nettoyer les parois internes à l’éthanol pour la prochaine utilisation
# Fiche technique “Incubateur BRE240”
*Incubateurs de laboratoire précis et durables à convection naturelle ou forcée.*
Volume net : 230 L
Plage de régulation : 0°C à 100°C \*
Chauffage par convection assurée par un ventilateur (ni conduction ni de rayonnement)
Puissance : 2400 W
Dimensions extérieures (H x L x P) : 1500 x 626 x 679.5 mm
Dimensions intérieures (H x L x P) : 980 x 500 x 456 mm
***Pré-requis :***
\- Avoir un tourne-vis plat (cela servira pour régler le thermostat de sécurité)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/7IJimage.png)
SV = température voulu
PV= température actuelle
**Consigne d’utilisation :**
\- **Allumer l’appareil :** Appuyer sur le bouton “Marche/Arrêt”
\- **Choisir la température de l’appareil** : Entrer la température de l’appareil dans le “Régulateur de température” à l’aide des touches S2 (flèche du haut) et S3 (flèche du bas)
*(Attendre que la température se stabilise, il faut environ 8 minutes pour monter à 60°C depuis la température ambiante)*
\- **Régler le thermostat de sécurité :**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/c1Cimage.png)**LE THERMOSTAT DOIT ÊTRE AJUSTÉ À CHAQUE MODIFICATION DE TEMPÉRATURE !!**
1\. Retirer **le bouchon noir du bandeau de pupitre** pour accéder au thermostat de sécurité.
2\. Régler le thermostat de sécurité à **sa température maximum à l’aide d’un tournevis plat** (tourner vers la droite).
3\. Laisser l’incubateur se stabiliser parfaitement à la température de consigne.
4\. **Tourner le thermostat vers la gauche** jusqu’à entendre un déclic (le voyant rouge en façade s’allume).
5\. **Remonter très légèrement vers la droite** jusqu’à entendre le déclic (le voyant rouge s’éteint).
6\. Repositionner le bouchon noir. > La sécurité est opérationnelle.
**Clapet de ventilation:**
En fonction des applications, il peut être intéressant de régler l‘ouverture de la sortie d’air située à l’arrière de l’appareil. Ce réglage se fait à l’aide du bouton situé sur le panneau de commande de l’incubateur.
\---------------------------------------------------------------------------------------------------------------------------
**Les ALARMES !!!**
\- **Alarme visuelle haute et basse :** On définit un seuil de sécurité bas et un seuil de sécurité haut. Si la température
mesurée franchit ces seuils, l’alarme se déclenche et le voyant rouge (à l’avant de l’incubateur / à côté du thermostat) s’allume
(Les valeurs d’usine sont : Seuil bas = 0°C / Seuil haut = 100°C)
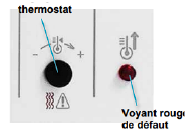
*On peut également modifier le seuil des alarmes haut et bas.*
*Pour cela, on passe par le régulateur de température*
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/XNoimage.png)
**Réglage de l’alarme basse :**
1\. Afficher le bloc de paramètres n°1 en appuyant sur SEL pendant 1 sec.
2\. Afficher le paramètre (A2-L), à l’aide des touches “S2” et “S3” et sélectionner en appuyant sur SEL.
3\. Modifier le paramètre (A2-L), à l’aide des touches “S2” et “S3”
4\. Valider en appuyant sur SEL
**Réglage de l’alarme haute :**
1\. Afficher le bloc de paramètres n°1 en appuyant sur SEL pendant 1 sec.
2\. Afficher le paramètre (A2-H), à l’aide des touches “S2” et “S3”, sélectionner en appuyant sur SEL.
3\. Modifier le paramètre (A2-H), à l’aide des touches “S2” et “S3”
4\. Valider en appuyant sur SEL.
*Il est aussi possible de temporiser ces alarmes, c'est-à-dire de définir une durée, l’alarme se*
*déclenche si la température mesurée atteint ou dépasse le seuil pendant la durée définie.*
*Cette valeur est réglée en usine à 0 sec. Par défaut, l’alarme est donc active dès que la*
*valeur d’alarme haute est atteinte.*
**Temporisation de l’alarme basse :**
1\. Afficher le bloc de paramètres n°3 en appuyant sur SEL pendant 5 sec.
2\. Afficher le paramètre dLy2, à l’aide des touchesC(S2) et D(S3) et sélectionner en appuyant sur SEL.
3\. Modifier le paramètre dLy2, à l’aide des touchesC(S2) et D(S3)
4\. Valider en appuyant sur SEL.
**Temporisation de l’alarme haute :**
1\. Afficher le bloc de paramètres n°3 en appuyant sur SEL pendant 5 sec.
2\. Afficher le paramètre dLy2, à l’aide des touches C(S2) et D(S3) ) et sélectionner en appuyant sur SEL.
3\. Modifier le paramètre dLy2, à l’aide des touches C(S2) et D(S3)
4\. Valider en appuyant sur SEL
*En plus du thermostat de sécurité, il y a un fusible thermique qui protège de toute*
*surchauffe. Sa température de coupure est de 190°C*
*[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/eMcimage.png)!! Attention aux surfaces chaudes à l’arrière de la machine sur le couvercle supérieur !](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/Nhuimage.png)*
\---------------------------------------------------------------------------------------------------------------------------
**Petit descriptif des paramètres :**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/TwTimage.png)
1\. Sélectionner le bloc de paramètre adapté en appuyant 1,3 ou 5 sec. sur la touche SEL.
2\. Sélectionner le paramètre à modifier en appuyant sur les touches S2 et S3
3\. Valider le paramètre en appuyant sur la touche SEL (après validation, le paramètre modifié clignote).
4\. Modifier la valeur du paramètre en appuyant sur les touches S2 et S3
5\. Appuyer sur la touche SEL pour enregistrer cette valeur.
6\. Retourner en mode opérateur en appuyant sur la touche SEL pendant 2 secondes.
**Les Fonctions programmables :**
\- Fonction **rampe** : Permet de programmer la vitesse de montée en température de l’incubateur puis de maintenir la température de l’enceinte à la température de consigne pour une durée maximale de 99 h 59 min (par segment de programmation)1
[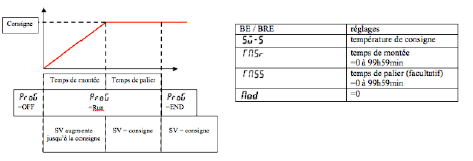](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/ftOimage.png)
=> Pour **sélectionner les paramètres** : Appuyer sur SEL pendant 3s. Afficher “Su-I” en utilisant les touches “S2” et “S3” puis valider (SEL). Choisir la température de consigne en utilisant les touches “S2” et “S3” puis valider (SEL). Répéter l’opération pour les autres paramètres.
\- **Arrêt programmé** : Permet de stopper automatiquement le chauffage de l’enceinte à l’issue d’un temps déterminée, à partir de la mise en route.2
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/jnbimage.png)
*1. Pour redémarrer l’incubateur, utiliser soit le bouton “Marche/Arrêt” soit la fonction “RUN”*
*2. Pareil…*
# PHmètre
# Utilisation de la PHmètre
##### **Présentation de la machine**
Le pH mètre est un système composé d’une électrode SI Analytics pH relié au boîtier Lab 850.Ce système permet de faire des mesures de pH précises au millième. La calibration est nécessaire, et doit se faire de régulièrement à très régulièrement en fonction de la fréquence d’utilisation.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-0880.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-0837.jpg)
##### **Informations importantes**
- Ne **pas essuyer la sonde avec du papier**, la rincer à l’eau distillée en utilisant une pissette et un bécher est suffisant.
- Ne **pas utiliser la sonde comme agitateur** et ne pas l’agiter de n’importe quelle manière qui soit
- Avant d’enlever ou de remettre le Capuchon de trempage, **ouvrir le petit clapet obturant le trou de remplissage et le refermer après**.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-0834.jpg)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-0835.jpg)
- Du **liquide intérieur de la sonde doit toujours arriver au moins au niveau du diaphragme** dans la sonde.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-0836.jpg)
- Ne **pas manier la sonde manuellement** mais utiliser la potence pour la bouger.
- La **calibration doit s'effectuer rapidement**, donc ne pas traîner, surtout pendant la phase de rinçage de la sonde entre les différents tampons.
##### **Calibration**
Le boîtier allumé et la sonde dans son capuchon protecteur, le calibrage peut s’effectuer. Lors du calibrage, l’ordre des tampons (BUFFER 1, 2 et 3) n’est pas réellement important puisque l’appareil les reconnaît, mais il est préférable de les utiliser dans l’ordre de pH croissant. Par défaut, l’appareil a enregistré le set de buffer DIN Si Analytics GmbH, composé de buffers à pH4,006 6,865 et 9,180. Si besoin est de changer ce set, se référer à la notice.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-0841.jpg)
\- Appuyer sur <CAL>
Le numéro de set de tampon s’affiche et l’appareil demande le buffer1 (tampon1)
\- Régler la température du buffer1 avec les flèches (en général la même que la température ambiante, sauf cas ou les tampons auraient été placé dans une zone de température différente.)

\- Enlever le capuchon de trempage de la sonde, **CONSERVER PRÉCIEUSEMENT LE CAPUCHON ET LE LIQUIDE QU’IL CONTIENT**.
\- Rincer la sonde à l’eau distillée en utilisant une pissette et un bécher.
\- Mettre la sonde dans le tube contenant le buffer 1.
\- Appuyer sur <OK>.
\- Attendre que le pH se stabilise.
L’appareil bipe et vous demande maintenant le BUFFER 2.
\- Enlever la sonde du buffer 1.
\- Rincer la sonde à l’eau distillée en utilisant la pissette et un bécher.
\- Régler la température du buffer 2 (normalement identique au buffer 1).
\- Plonger la sonde dans le tube contenant le buffer2.
\- Appuyer sur <OK>.
\- Attendre que le pH se stabilise.
L’appareil bipe et vous demande maintenant le BUFFER 3.
\- Enlever la sonde du buffer 2.
\- Rincer la sonde à l’eau distillée en utilisant la pissette et un bécher.
\- Régler la température du buffer3 (normalement identique au buffer 1 et 2).
\- Plonger la sonde dans le tube contenant le buffer3.
\- Appuyer sur <OK>.
\- Attendre que le pH se stabilise.
L’appareil bipe, il affiche pendant 10 secondes la valeur ASY puis celle de SLO pendant 10 autres secondes. Il retourne ensuite en mode "Mesure". Le calibrage est **terminé**.
\- Enlever la sonde du buffer 3.
\- Rincer la sonde à l’eau distillée en utilisant la pissette et un bécher.
\- Remettre la sonde dans son capuchon protecteur en pinçant légèrement le capuchon de trempage, ou bien commencer les mesures.
##### **Entretien**
\- Le capuchon de trempage et la sonde contiennent du liquide KCl 3mol/L. Entre les utilisations, l’extrémité de la sonde (diaphragme) doit toujours tremper dans le liquide KCl du capuchon.
\- Pour enlever les traces et d’éventuels encrassements sur la sonde et sur le diaphragme, l’utilisation de solvants adaptés est nécessaire : acides minéraux (HCl dilué par exemple) pour les dépôts calcaires, solvants appropriés pour les encrassements organiques, et solutions tensioactives pour les graisses déposées.
\- Des solutions tampons sont en stock sous forme d’ampoules de verre, chaque ampoule permettant de remplir 2 tubes tampons.
##### **"Monsieur, je n'arrive pas à calibrer !"**
**Err1** s'affiche sur la console
- Vérifier que le diaphragme de l'électrode est recouvert de KCl et qu'il n' y a pas de bulles d'air sur celui-ci.
- Vérifier que l'électrode est correctement branchée et qu'il n'y a pas de problème avec son câble.
**Err2** s'affiche sur la console
- Vérifier le raccord entre l'électrode et le boiter : recommencer la calibration.
- Vemps de calibration trop long : recommencer en prenant moins son temps.
**Err4** s'affiche sur la console
- Température instable pendant la calibration : recommencer la calibration en conditions de température constantes.
**CalError** s'affiche sur la console
- Valeurs déterminées hors des limites admises : calibrer à nouveau.
- Vérifier l'état du diaphragme : si besoin le nettoyer.
- Electrode cassée : vaut mieux pas, essayer de nouveau.
# Étalonnage d’un ph metre
| Canal
| Monocanal |
| Plage de mesure du pH
| 0 – 14 |
| Résolution pH
| 0,01 |
| Précision pH (±)
| 0,01 |
| Langues
| Anglais |
| Plage de température
| 0 °C – 100 °C |
| Résolution de température
| 0,1 °C |
| Précision température (±)
| 0,5 °C |
| Dimensions
| 227 x 147 x 70 mm |
| Poids
| 0,63 kg |
| Connecteurs
| BNC
Cinch/RCA
2 mm Réf.
sortie du signal mV analogique
|
| Compatible avec la technologie ISM (Intelligent Sensor Management)
| Non |
##### Application
Le pH des éléments étudié, et donc les pH-mètres sont des éléments transversales dans la plupart des domaines scientifiques, que ce soit dans la physique des matériaux, la chimie théorique ou industriel... Un certain pH peut par exemple catalyser une réaction, ou alors détruire des réactifs. Il est donc important de connaître le pH des éléments selon l'utilisation qu'on en fait.
##### Rangement
Rincer la sonde pH-métrique à l'eau distillée, la refermer avec le capuchon (remplie de la solution de départ ou à défaut, d'eau distillée). Éteindre le pH-mètre, le débrancher et le ranger. Ne pas oublier de nettoyer le plan de travail !
# Thermocycleur
Paramétrages et utilisation d'un appareil à PCR
# Guide d'utilisation du thermocycleur
# Fiche technique du thermocycleur XT⁹⁶
Le thermocycleur XT96 est un appareil qui permet d’effectuer de manière automatisée et séquentielle les cycles de température nécessaires pour effectuer la réaction en chaîne par polymérase (PCR) de l’amplification de l’ADN. Le thermocycleur fournit un environnement thermiquement contrôlé pour les échantillons PCR.
**Connectiques de l’appareil : **
[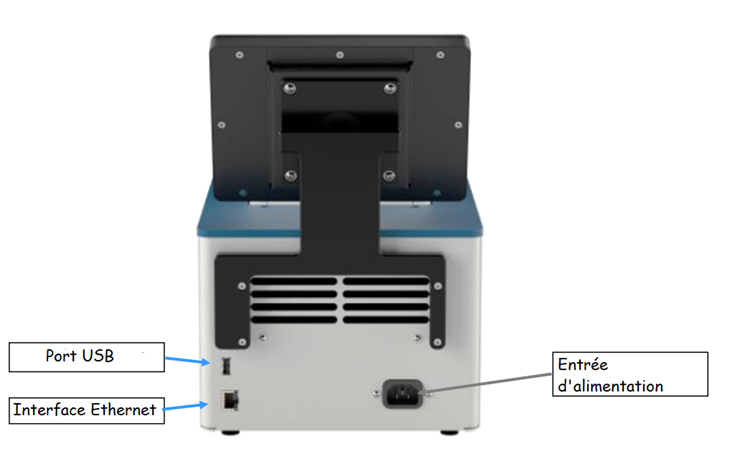](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/S1nimage.png)
[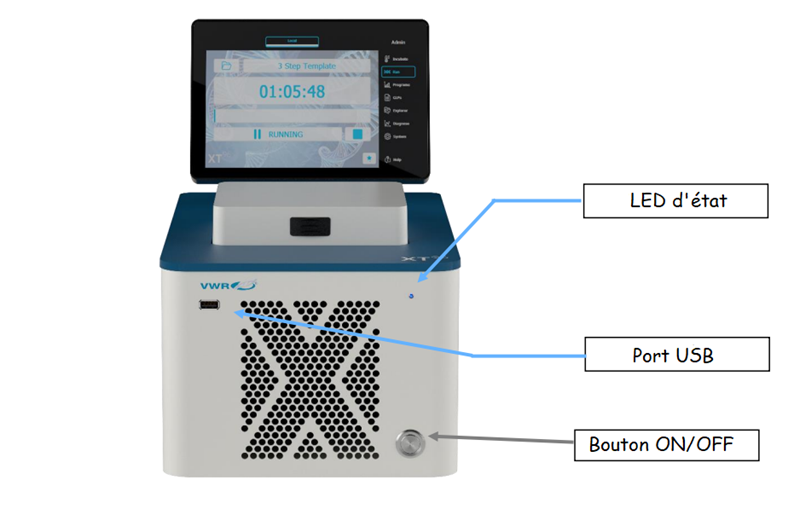](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/lo1image.png)
**Menu Principal : **
Le menu principal se compose de sept onglets. Chaque onglets contient un bouton d'aide pour une fonction d'aide directe.
[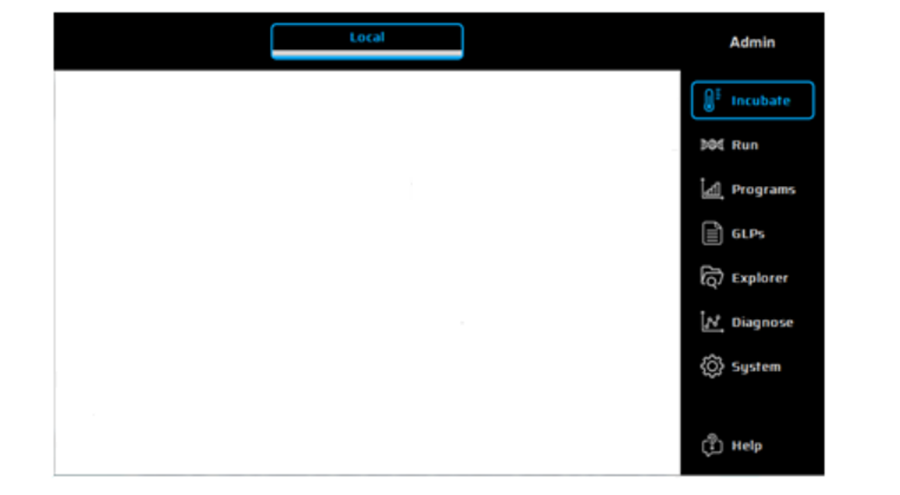](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/i57image.png)
**Comment utiliser le thermocycleur ? **
- **Le mode incubateur **
1. Appuyez sur 'incubate' dans le menu principal [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/RX2image.png)
2. Entrez la valeur de température du bol/couvercle et de temps souhaité[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/tnpimage.png)
3. Lancez l'incubation grâce à "run and stop" [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/iBzimage.png)[ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/iBzimage.png)
- **Lancement du mode simple dans l'onglet "Run"**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/OCpimage.png)
1. Sélectionner un programme utilisé récemment ou créer votre propre programme avec le protocole Wizard (voir après)
2. vérifier les informations du programmes
3. Lancer avec le bouton start ( ou utiliser pour mettre sur pause)
4. Stopper avec le bouton stop
- **Modifier un programme**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/rEaimage.png)
1. [ ](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/SLEimage.png)Entrer une nouvelle commande dans le programme existant
2. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/R5Wimage.png)Éditer une commande
3. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/V95image.png)Supprimer une commande
4. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/bWuimage.png)Sauver les modifications
5. [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/rpximage.png)Sauver et lancer le programme
- **Protocole Wizard pour créer de nouveaux programmes[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/5uOimage.png)**
Ce protocole est un outil utile pour la création rapide et automatique de protocoles de PCR comme les programmes en 3 étapes, 2 étapes et le programme de gradient.
Un programme en trois étapes consiste en une étape séparée pour la dénaturation, l'amorçage et l'élongation.
Dans un programme en deux étapes, les étapes d'amorçage et d'élongation sont sont combinées en une seule étape.
Comment utiliser l'assistant en 3 étapes :[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/KWnimage.png)
1. 1. Saisir le nombre de cycles
2. Entrer la température de dénaturation (recommandation 95°C) et la durée (s)
3. Entrer la température de recuit de l'amorce de l'amorce.
Note : En général, la température de d'amorçage est d'environ 5°C en dessous de la moyenne calculée des paires d'amorces.
moyenne calculée de la température de fusion (Tm) de la paire d'amorces
4. Entrer la température d'élongation (72°C recommandée) et la durée.
Remarque : temps d'élongation (s) = longueur du produit \[bases\] / 1000 \[bases\] \* 60 s
Sauvegarder ou enregistrer et démarrer le nouveau protocole
[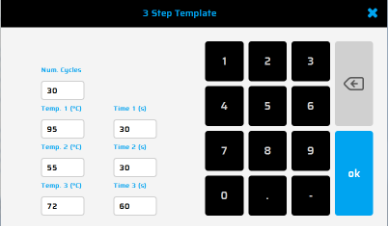](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-11/ybMimage.png)
# Phytotron
Paramétrages et utilisation d'un incubateur dédié aux végétaux
# Lancement d'un programme AtmoCONTROL
#### Objectifs
Après avoir préparé le Phytotron, et exporté le programme AtmoCONTROL sur la clé USB, il faut maintenant mettre le programme en marche dans le Phytotron.
#### Interface
⚠️ Les écrans des différents menus ne sont pas tactiles.
Pour sélectionner un menu, cliquer sur le bouton tactile à côté puis, pour y naviguer, utiliser le bouton de sélection.
Pour revenir au menu précédent, cliquer sur le bouton tactile du menu dans lequel vous naviguez.
En cas de doute, le bouton \[MENU\], qui est tactile, vous permet d'accéder aux différents paramètres et réglages.
#### Exportation du programme d'une expérience
##### Étape 1
Allumer le phytotron, si ce n'est pas déjà fait.
##### Étape 2
Insérer la clé USB portant le programme AtmoCONTROL dans le port USB sur le côté droit de l'interface.
##### Étape 3
Cliquer sur le bouton \[MENU\] pour accéder aux différents paramètres de la machine.
##### Étape 4
Sélectionner le menu PROTOCOLE grâce au bouton tactile sur la gauche.
##### Étape 5
Le menu s'ouvre en affichant le programme en cours, et deux options : sélectionner ou supprimer. Pour changer de programme, sélectionner supprimer avec bouton de sélection puis valider.
##### Étape 6
Les différents programmes compris dans le phytotron et dans la clé USB s'affiche, il suffit de trouver votre programme dans la liste et de valider.
⚠️ Vous êtes directement redirigé à l'écran précédent, mais n'ayez craintes votre programme a bien été sélectionné.
##### Étape 7
Le programme ayant été choisi, il ne vous reste plus qu'à le lancer. Cela se fait dans l'autre interface de menu, celle avec les informations de vos cycles en cours. Pour y accéder, appuyer à nouveau sur le bouton \[MENU\].
Une fois dans ce menu, sélectionner le menu de lancement en haut à droite.
Il est possible de modifier les paramètres du phytotron sans arrêter les différentes manipulations en activant le mode manuel. Les différents menus de température, lumière et alarme deviennent alors accessibles et modifiables.
Si vous souhaitez arrêter l'expérience, il suffit d'appuyer sur le bouton ''arrêt''. Dans le cas où vous souhaiteriez ensuite relancer le phytotron, le programme recommence du début quand vous appuyez sur le bouton ''lecture''.
##### Quelques petits conseils et astuces supplémentaires :
- Il est possible de récupérer les données de votre expérience en cliquant sur le menu ''Protocole''. Les données du phytotron sur votre expérience seront ensuite copiées sur la clé USB branchée. Il sera ensuite possible d'y accéder sur un ordinateur grâce à un logiciel de traitement de texte (OpenOffice, Word).
- Pour y accéder, suivez le chemin : Memmert->Devices->le nom de votre phytotron->Protocols->l'année de votre expérience->le mois de votre expérience en nombre.
# Utilisation de la machine
\- Nettoyer et désinfecter les parois intérieures par précaution.
\- Appuyer sur le bouton On/Off pour allumer la machine : l’écran s’allume en affichant les conditions définies et actuelles.
\- Pour modifier les conditions voulues (température, luminosité et timer) il suffit d'appuyer sur le bouton à côté du paramètre, de modifier la valeur avec la molette (i.e bouton rotateur) et d'appuyer sur le bouton au centre de la molette pour valider.
\- Il est important de placer les échantillons de manière espacée et uniformes pour la libre circulation de l’air dans le caisson.
\- L’éclairage du caisson ne peut être actif qu’en dessous de 40°C.
\- L’élaboration de programme de variation de conditions se fait sur un logiciel à part qui doit ensuite être téléchargé dans le phytotron.
\- Après utilisation éteindre le phytotron et nettoyer les parois internes à l’éthanol 70° pour la prochaine utilisation.
# Phytotron Memmert
Le Phytotron Memmert est une enceinte contrôlée spécifiquement conçue pour l'expérimentation végétale mais qui peut être détournée vers d'autres usages.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-10/th.jpg)
Les paramètres qui peuvent être contrôlés sont : la température, l'intensité lumineuse, la durée d'éclairement. Le tout adossé à un logiciel externe (AtmoControl) qui permet de réaliser des programmes complexes (cyclages variés avec variations graduelles ou rapide).
Constitution de l'appareil : une chambre avec porte isolante et contre porte transparente pour une observation sans perturbation importante des paramètres internes, contenant un système d'homogénéisation par ventilateurs arrières et cellules à effet pelettier, des rampes de leds latérales par niveaux, des étagères grillagées modulables. Un tableau de bord frontal sous forme d'un bloc de commande avec affichage et réglages.
Les boutons et l'affichage :
Utilisation de base de l'appareil : mise en marche par interrupteur du tableau de bord, choix du programme et mise en lecture
Programmation et extractions : les programmes réalisés via le logiciel externe AtmoControl peut-être importé via la clé usb spécifique à l'appareil (à droite du tableau de bord). Avant toute modification le programme en cours doit être mis en mode manuel. Parfois la programme n'apparait pas en premier lieu dans la liste, dans ce cas éteindre et rallumer l'appareil. Les fichier n'apparaissent pas par ordre alphabétique mais par date de création du plus ancien au plus récent, et de la mémoire interne de l'appareil avant celle de la clé usb (donc il faut chercher à la fin).
**Remarque:** En cas de coupure électrique, l'appareil redémarre automatiquement à la remise sous tension du réseau et reprend le programme en cours tout en indiquant l'évènement et sa durée dans le journal interne.
# Création de programme (logiciel AtmoCONTROL)
**[Manuel du logiciel](https://wiki.fablab.sorbonne-universite.fr/wiki/lib/exe/fetch.php?media=wiki:tutoriel:ba-atmocontrol-fr-d24130.pdf) / [Software manual](https://wiki.fablab.sorbonne-universite.fr/wiki/lib/exe/fetch.php?media=wiki:tutoriel:atmocontrol-en-v2.4.pdf)**
Lancer le logiciel Atmocontrol, et connecter la clé USB du phytotron à l’ordinateur.
Si l’appareil IPP 260 plus n’apparaît pas dans la colonne de gauche, aller dans le menu “Device” puis choisissez l’option “Connect offline from USB device” et sélectionnez l’option “V6160109”.
Dans la partie supérieure droite de l’écran se trouve les trois onglets : “Editor”, “Simulation” et “Protocol”.
Sélectionnez l’onglet “Editor”. Dans la fenêtre, on retrouve maintenant une barre grise avec à sa gauche une icône d’un thermomètre. Sur la partie gauche de la barre, il y a un rectangle plus foncé, c’est ici que vous mettrez les différents modules pour contrôler les paramètres.
Avec ce programme, vous pouvez modifier la température et l’éclairage du phytotron.
- Dans la partie gauche de l’écran d’édition, on retrouve 8 icônes qui permettent de :
- Modifier la température de façon linéaire (de 10 à 50°C). La température de départ sera la dernière température définie, et si aucune température n’a été définie avant la température par défaut sera 20°C.
- De garder la chambre d’incubation à une température constante (de 10 à 50°C)
- De modifier la luminosité (0% à 100% de luminosité)
- De jouer une alarme lorsque le programme arrive à une certaine étape jusqu’à ce que l’utilisateur appuie sur le bouton principal du phytotron pour stopper l’alarme
- De définir les jours de la semaine pendant lesquels le programme doit être exécuté
- De régler la date de lancement du programme
- De répéter une séquence du programme pendant X fois
- De mettre les systèmes du phytotron à l’arrêt
- De changer la provenance de l'air introduit dans le phytotron (provenant d'une filtration de l'air environnant ou d'une bonbonne de gaz particulière).
Pour insérer un item dans le programme, il suffit de le sélectionner et de le faire glisser dans le rectangle gris en maintenant le clic gauche. Pour supprimer un item du programme, on le fait glisser en maintenant le clic gauche vers la corbeille.
[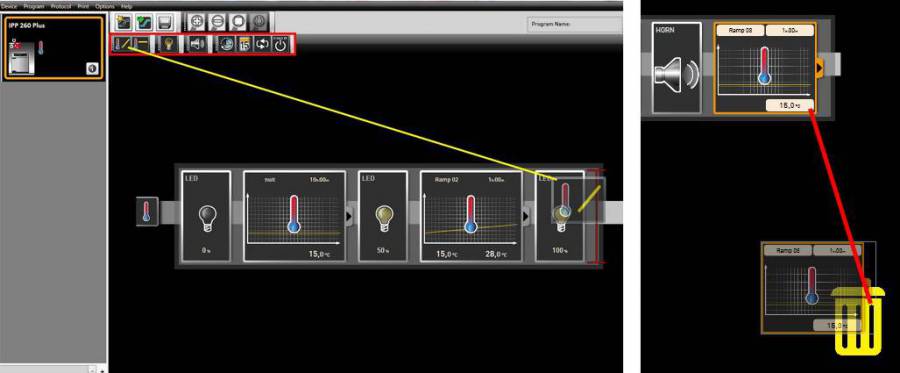](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2023-02/img-3.jpg)
On attribuera une durée, allant d’une minute à une durée infinie, pour les items contrôlant la température. Cependant, l’attribution d’une durée à l’item contrôlant la luminosité est impossible. La valeur de la luminosité restera fixe jusqu’à ce qu’elle soit à nouveau modifiée dans le programme.
**Remarque:** Vérifier que tous les items soient dans le même bloc.
Une fois votre programme terminé sauvegardez votre fichier dans le dossier Memmert/profiles sur la clé USB.
# SPECTRE DE L' ETHANOL
[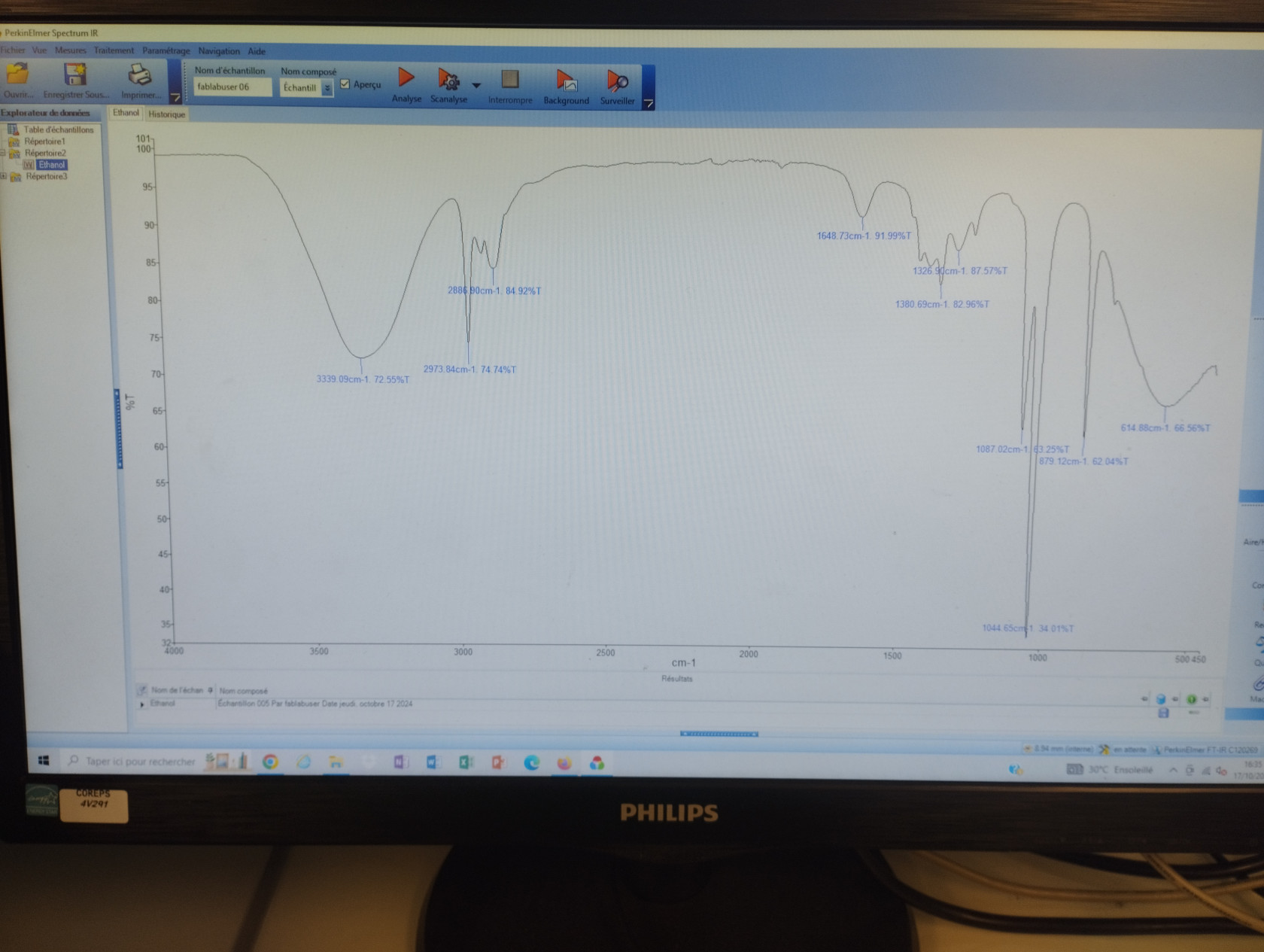](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-10/1729175952526.jpg)
# Minuterie numérique programmable Chacon
##### [](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/capture-decran-2024-11-04-140301.png)**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/chacon.jpg)**
##### Une minuterie numérique programmable permet de planifier l'allumage et l'extinction d'appareils à des horaires définis.
### **Mode d'emploi:**
#### **A. Démarrage :**
#### **1-Allumage écran:**
##### i. Si l'écran LCD ne s'allume pas , branchez votre appareil sur le courant.
##### ii. Ensuite , appuyez sur la bouton "RESET"
##### **2-Réglage du jour de la semaine**
##### **L'écran doit être en mode affichage de l'heure réelle pour passer en mode réglage du jour et de l'heure:**
##### **i**. Appuyez sur le bouton « CLOCK » pour afficher l'heure réelle
##### **ii.** Appuyez sur le bouton « SET » jusqu'à ce que l'affichage de la semaine clignote pour passer au réglage
##### **iii.** Appuyez sur les boutons « ^+/v» pour choisir les jours suivants et précédents.
#####
**La séquence de l'affichage est la suivante :**
Mo (lundi) → Tu (mardi) → We (mercredi) → Th (jeudi) → Fr (vendredi) → Sa (samedi) → Su
##### →(dimanche)
##### En appuyant une fois sur les boutons « ^+/v », le jour avancera ou reculera lentement.
#####
Si vous maintenez le bouton enfoncé, l'affichage des jours de la semaine défilera rapidement. Relâchez le bouton quand le jour de la semaine désiré s'affiche à l'écran.
#####
**iv.** Appuyez ensuite sur le bouton « SET » pour confirmer le réglage.
##### **3-Réglage de l'heure**
##### Une fois le jour de la semaine réglé, l'heure s'affiche en clignotant, ceci indique que vous pouvez la régler.
#####
**i.** Appuyez sur les boutons « ^+/v » pour faire avancer ou reculer l'heure lentement. Si vous maintenez le bouton enfoncé, l'affichage des heures de la semaine défilera rapidement.
Relâchez le bouton dès que l'heure désirée s'affiche à l'écran.
#####
**ii.** Appuyez sur le bouton « SET » pour confirmer le réglage.
#####
**iii.** Ce sont ensuite les minutes qui se mettront à clignoter. Répétez la procédure de réglage de l'heure indiquée aux paragraphes 2.2 et 2.3.
##### **4-Passez à l'heure d'été**
##### **i.** Appuyez simultanément sur le bouton « CLOCK » et « v » pour passer à l'heure d'été.
La lettre « S » (Summer = été) s'affichera à droite de l'écran pour confirmation.
#####
**ii.** Répétez l'opération pour repasser à l'heure d'hiver.
##### **5-Affichage de l'heure**
##### **i**. Il existe deux types d'affichage d'heure :
1. Affichage 12 heures : l'écran LCD affiche de 00:00 à 12:00 ainsi qu'une mention AM ou PM.
2. Affichage 24 heures : l'écran LCD affiche de 00:00 à 23:59 sans mention AM ou PM
##### **ii.** Pour changer le type d'affichage, appuyez sur le bouton « CLOCK» et maintenez-le enfoncé jusqu'à ce que l'affichage à l'écran LCD change.
#####
**iii.** Appuyez sur le bouton « CLOCK » pour revenir à l'affichage d'origine.
#### **B. Sélection du programme :**
##### L'écran doit être en mode affichage de l'heure « CLOCK ».pour passer en mode programmation.
##### **1-Choisir le n° de programme**
##### **i.** Appuyez sur le bouton « AUTO» pour sélectionner le programme.
##### **ii.** Appuyez sur le bouton « +» pour choisir le n° du programme et son état:
1. « On » = mise sous tension
2. « OFF » = mise hors tension
3. « AUTO»= mise sous tension et hors tension automatiquement en fonction des heures programmées
**iii.** Appuyez sur le bouton « SET » pour confirmer le réglage des jours.
##### **2-Choisir les jours du programme**
##### **i.** La semaine clignote pour sélectionner les jours.
##### **ii.** Appuyez sur le bouton « ^+» pour choisir le jour.
**iii.** Appuyez sur le bouton « SET » pour confirmer le réglage des jours.
#####
##### **3-Choisir l'heure du programme**
##### **i.** L'heure se met à clignoter pour être configurée.
**ii.** Appuyez sur les boutons « ^+/v-» pour avancer ou reculer l'heure.
##### **iii.** Appuyez sur le bouton « SET » pour confirmer le réglage.
**iv.** Les minutes se mettent ensuite à clignoter. Répétez la même opération que pour le réglage de l'heure.
#### **B. Compte à rebours :**
##### L'écran doit être en mode affichage de l'heure réelle « CLOCK » pour programmer le compte à rebours.
##### **1-programmation du compte à rebours**
##### **i.** Appuyez sur le bouton « V-» pour programmer le compte à rebours
##### « d ON» ou « d OFF » s'affichera dans le coin en bas à gauche de l'écran.
« d»= compte à rebours
«ON » = compte à rebours jusqu'à l'heure de mise sous tension
« OFF » = compte à rebours jusqu'à l'heure de mise hors tension
##### **ii.** Appuyez sur le bouton « SET » jusqu'à ce que « ON/OFF » clignote.
**iii**. Appuyez sur le bouton « ^+/v » pour sélectionner l'état ON ou OFF du compte à rebours.
**iv.** Appuyez sur « SET » pour confirmer le réglage.
##### **2-choisir l'heure du compte a rebours**
##### L'affichage de l'heure clignote.
**i.** Appuyez sur le bouton « ^+/v- » pour choisir l'heure.
##### **ii.** Appuyez sur le bouton « SET » pour valider l'opération.
##### L'affichage des minutes clignote.
**i.** Appuyez sur le bouton « ^+/v- » pour choisir les minutes.
##### **ii.** Appuyez sur le bouton « SET » pour valider l'opération,
L'affichage des secondes clignote.
**i.** Appuyez sur le bouton « ^+/V » pour choisir les secondes.
##### **ii.** Appuyez sur le bouton « SET » pour valider l'opération.
##### **3-Démarrez le compte à rebours**
##### **i.** Branchez ensuite la minuterie à la prise et placez la minuterie en made « AUTO »
##### **ii.** Appuyez sur le bouton « CD » pour démarrer le compte à rebours
##### **iii.** Appuyez une nouvelle fois sur le bouton « CD» pour arrêter le compte à rebours
#### **C. Réglage de la fonction aléatoire :**
##### La fonction aléatoire allume et éteint votre appareil de façon irrégulière:
#####
**i.** Fonction aléatoire
1. Temps minimum pour un appareil éteint : 26 minutes
2. Temps maximum pour un appareil éteint: 42 minutes
3. Temps minimum pour un appareil allumé: 10 minutes
4. Temps maximum pour un appareil allumé : 26 minutes
##### **ii**. Branchez la minuterie dans la prise et placez-la en mode « AUTO » afin de
démarrer/arrêter la fonction aléatoire.
**iii.** Appuyez sur le bouton « RND » pour activer la fonction aléatoire.
**iv.** L'appareil demeurera éteint pendant 26 à 42 minutes et s'allumera ensuite pendant
10 à 26 minutes.
##### **v.** Appuyez à nouveau sur le bouton "RND" pour arrêter la fonction aléatoire.
# Microscope Optika B-193PL
C'est un microscope optique trinoculaire (caméra Optika possible), avec 4 objectifs, d'une résolution totale pouvant aller jusqu'à 1000.
Documentation par Sassi.
# Présentation
## **Comment est le microscope ?**
### **Apparence**
Voici une photo du microscope en question :
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/whatsapp-image-2024-11-06-at-14-21-00-1.jpeg)
### **Points d'intérêts**
[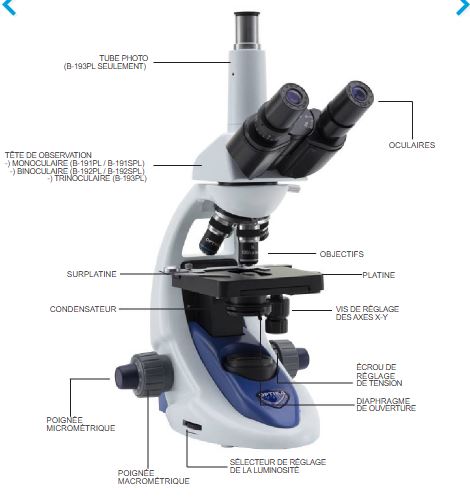](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/micro-legende.JPG)
##### **Utilité :**
- **Sélecteur de réglage de la luminosité** : molette qui contrôle la puissance lumineuse émise par la lampe à la base du microscope ;
- **Diaphragme d'ouverture** : membrane opaque dont l'ouverture (plus ou moins grande) permet de contrôler le contraste ;
- **Poignée macrométrique** : permet de faire un focus grossier (à faire en 1er). Doit être la plus basse possible au début de l'expérience (il y en a une des 2 côtés du microscope) ;
- **Poignée micrométrique** : permet de faire un focus précis (à faire en 2ème) \[il y en a une des 2 côtés du microscope\] ;
- **Platine** : endroit où l'on pose la lame à observer ;
- **Surplatine** : permet de maintenir fixe la lame à étudier ;
- **Vis de réglage des axes x et y** : permet de déplacer la lame dans le plan de la lame ;
- **Objectifs** : 4 objectifs sur une tête rotative (choisir l'objectif avec la plus petite résolution au début de l'expérience, puis augmenter progressivement) ;
- **Oculaires** : endroit où placer ses yeux pour observer la lame ;
- **Tube** **photo** : Tube grâce auquel une caméra peut voir la lame.
### **Principe**
Lorsque la lamelle est posée sur la platine est maintenue par la surplatine, la lumière de la lampe passe à travers l'échantillon, arrive dans un objectif puis dans l'oculaire, et nous pouvons voir ce qu'il se passe au niveau microscopique.
# Utilisation
## **Comment utiliser le microscope ?**
### **Précaution**
- Transporter le microscope débranché (caméra déséquipée)
- Transporter le microscope avec toujours une main sur le manche, et une main en dessous du socle
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/whatsapp-image-2024-11-06-at-17-31-04.jpeg)
- Ne pas toucher les objectifs et oculaires avec ses doigts (de la même manière, la lame se manipule en posant ses doigts sur ses arêtes, comme des lunettes)
- Veiller à toujours débuter avec la platine le plus bas possible
- La poignée macrométrique est exclusivement réservée pour les 2 premiers objectifs (possibilité de casser la lame avec les 2 derniers objectifs)
- Les manipulations du microscopes se font debout
### **Mode d'emploi**
L'échantillon sur la lame se fait avant la manipulation du microscope.
##### **Etape 1 : Assembler le microscope / caméra**
- *Optionnel* : Caméra : enlever le cache de protection
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/whatsapp-image-2024-11-06-at-16-32-23.jpeg)
- Brancher le microscope sur une prise secteur (embout à l'arrière)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/whatsapp-image-2024-11-06-at-16-14-01.jpeg)
- *Optionnel* : filtre polarisant : installer le filtre en dessous du diaphragme d'ouverture
##### **Etape 2 : Poser la lame**
- Allumer la lampe du microscope (l'interrupteur est à côté de l'alimentation).
- Baisser la platine au maximum à l'aide des poignées macrométriques
- Vérifier que l'objectif le plus petit est bien en place (le rouge)
- Ouvrir la surplatine, placer la lame, lâcher doucement la surplatine
- Régler la luminosité de la lampe et le contraste de l'image (avec la molette et le diaphragme)
##### **Etape 3 : Installer la caméra**
Voir la page "[Caméra Microscope | Wiki FablabSU](https://wiki.fablab.sorbonne-universite.fr/BookStack/books/appareils-biologie-chimie/chapter/camera-microscope-Hq4)"
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/whatsapp-image-2024-11-06-at-16-40-27.jpeg)
##### **Etape 4 : Faire le focus**
- Tourner les poignées macrométriques pour obtenir l'image la plus nette possible
- Tourner les poignées micrométriques pour obtenir l'image la plus nette possible
- (Il est possible de faire le focus de chaque oculaire pour les personnes portants des lunettes : Faire le focus avec les vis de réglages au niveau des oculaires)
Voici l'exemple d'un focus sur une feuille de papier
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/4Oyschema.png)
##### **Etape 5 : Changer d'objectif**
- Changer d'objectif en prenant celui juste au dessus
- Faire le focus (avec des objectifs puissants, il est possible de n'utiliser que la poignée micrométrique)
- Recommencer jusqu'à atteindre la résolution souhaitée
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/schema-2.png)
(J'aurais pu m'arrêter au 2ème objectif, mais si je veux aller jusqu'au dernier objectif, je suis obligé de respecter l'ordre croissant)
##### **Etape 6 : Observation**
- Utiliser la vis de réglage des axes x et y pour chercher un point d'intérêt sur la lame
### **Rangement**
- Baisser la luminosité de la lampe, éteindre le microscope, débrancher l'appareil
- Baisser la platine au maximum, à l'aide des poignées macrométriques, remettre l'objectif le plus petit (le rouge)
- Enlever la lame (ne pas oublier de nettoyer l'appareil s'il a été sali)
- Déséquiper la caméra (la démonter...) et remettre le cache de protection (si elle a été équipée)
- Mettre le microscope dans son cache et le ranger où il était
Voilà tout ! Vous venez d'utiliser le microscope en question !
*Pour des informations complémentaires, voir le manuel du microscope en ligne* "[OPTIKA ITALY B-190 SERIE MANUEL D'UTILISATION Télécharger le Pdf | ManualsLib](https://www.manualslib.fr/manual/651805/Optika-Italy-B-190-Serie.html)"
# MicroPulser Electroporation
### **Description générale:**
Le **Micropulser Electroporation Apparatus** est un appareil conçu pour réaliser des électroporations, une méthode permettant d'introduire des substances dans les cellules via des impulsions électriques. Il offre un contrôle précis des paramètres d'impulsion (tension, durée, intensité) et est équipé d'électrodes adaptées pour un contact optimal. L'appareil est compatible avec divers milieux de culture cellulaire. Il garantit également la sécurité de l'utilisateur lors des manipulations à haute tension.
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-11/img-4453.jpeg)
### **Installation du système MicroPulser**
1\. Branchez le câble d’alimentation noir à l’arrière du module générateur d’impulsions MicroPulser.
2\. Abaissez le pied repliable situé sous le MicroPulser. Insérez ce pied dans la glissière située à la base de la chambre de choc. Insérez la glissière de la chambre de choc dans la chambre elle-même.
3\. Connectez les câbles de la chambre de choc aux connecteurs de sortie situés sur le panneau avant du MicroPulser ; la polarité n’a pas d’importance pour le processus d’électroporation.
4\. Allumez l’appareil en utilisant l’interrupteur situé à l’arrière droit. L’affichage à diode électroluminescente (LED) devrait s’allumer, afficher “Ec1”, et le voyant LED à côté des paramètres de bactéries devrait être allumé.
**[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-12/whatsapp-image-2024-12-05-a-16-44-03-c42ce89e.jpg)**
### **Utilisation du MicroPulser**
#### **1. Sélection des paramètres préprogrammés**
Le MicroPulser est préprogrammé avec des paramètres adaptés à l’électroporation de plusieurs organismes couramment utilisés. Les paramètres du programme pour les bactéries incluent les éléments suivants :
| Code | Organisme | Voltage (KV) | Nombre d’impulsions | Temps constant (ms) |
| Ec1 | E.coli (0.1 cm cuvette) | 1.8 | 1 | - |
| Ec2 | E.coli (0.2 cm cuvette) | 2.5 | 1 | - |
| StA | S. aureus (0.2 cm cuvette) | 1.8 | 1 | 2.5 |
| Agr | A. tumefaciens (0.1 cuvette ) | 2.2 | 1 | - |
| Ec3 | E.coli (0.2 cm cuvette) | 3.0 | 1
| - |
Inclus dans le programme de paramètres pour les champignons :
| Code | Organisme | Voltage | Nombre d’impulsions | Temps constant |
| Sc2 | S.cerevisiae(0.2 cm cuvette) | 1.5 | 1 | — |
| Sc4 | S.cerevisiae(0.2 cm cuvette) | 3.0 | 1 | – |
| ShS | S .pombe (0.2 cm cuvette ) | 2.0 | 1 | - |
| dic | D. discoideum (0.4 cm cuvette ) | 1.0 | 2 | 1.0 |
| Pic | P.pastoris (0.2 cm cuvette ) | 2.0 | 1 | - |
Appuyer sur le bouton "Settings" fait défiler la LED des paramètres entre "Bactéries", "Fungi" et "Manuel". Lorsque la LED à côté de "Fungi" est allumée, le code des programmes pour les champignons s'affiche. En appuyant sur les boutons "Raise" et "Lower" à gauche de la LED d'affichage, vous faites défiler les différents programmes pour les champignons. Lorsque le mnémonique est affiché, les paramètres associés à celui-ci sont automatiquement sélectionnés.
Pour passer d'un paramètre bactérien à un autre, lorsque la LED des paramètres à côté de "Bactéries" est allumée, appuyez sur les boutons "Raise" et "Lower" à gauche de la LED d'affichage pour faire défiler les différents programmes. Lorsque le code est affiché, les paramètres associés à celui-ci sont automatiquement sélectionnés.
Lorsque le code d'un programme pour un paramètre "Bactéries" ou "Fungi" est affiché, appuyer simultanément sur les boutons "Raise" et "Lower" montre les paramètres du programme sélectionné sur la LED d'affichage. La LED d'affichage montre d'abord la valeur de la tension, puis affiche un "t" suivi du temps en millisecondes, puis, si le temps et plusieurs impulsions sont associés à un programme, affiche "p" suivi de "2", indiquant que deux impulsions successives sont données. Si aucun "t" n'est affiché, l'impulsion n'est pas tronquée, et si aucun "p" n'est affiché, une seule impulsion est donnée.
#### **2. Utilisation du Micropulser en mode manuel :**
##### **A. Pour changer la tension :**
Appuyez sur le bouton "Settings" pour allumer la LED à côté de "Manuel". La LED d'affichage montre maintenant la tension (en kV). En appuyant sur les boutons "Raise" et "Lower" à gauche de la LED d'affichage, vous pouvez sélectionner la tension souhaitée dans la plage de 0,20 kV à 3,00 kV.
Si l'appareil vient d'être allumé, la LED d'affichage montre "0,00".
##### **B. Pour tronquer l'impulsion :**
Appuyez simultanément sur les boutons "Raise" et "Lower" lorsque la LED "Manuel" est allumée. La LED d'affichage montre alors "t-" et indique le temps de l'impulsion sélectionné. Le paramètre par défaut lors de l'allumage est l'impulsion à décroissance exponentielle standard, c'est-à-dire sans troncature d'impulsion, ce qui est indiqué par les deux tirets.
Relâcher uniquement le bouton "Lower" fait afficher sur la LED d'affichage le temps de l'impulsion tronquée en millisecondes. La LED d'affichage change d'abord en "t1.0" et augmente par incréments de 0,1 ms jusqu'à "4.0". Cela permet de tronquer l'impulsion exponentielle entre 1 et 4 ms.
Appuyer simultanément sur les boutons "Raise" et "Lower", puis relâcher uniquement le bouton "Raise", permet de réduire le temps de troncature indiqué.
##### **3. Fonction d'impulsion**
Appuyer sur le bouton "Pulse" entraîne la charge du condensateur jusqu'à la tension définie ; pendant ce temps, "PLS" est affiché sur la LED. Un signal sonore retentit pour indiquer que l'impulsion a été délivrée. Lorsque plusieurs impulsions sont délivrées par l'un des programmes intégrés, "PLS" reste affiché sur la LED pendant toute la durée et un signal sonore retentit chaque fois qu'une impulsion est délivrée. Pour délivrer manuellement plusieurs impulsions, après le signal sonore de la première impulsion, appuyez à nouveau sur le bouton d'impulsion.
Si un ton plus grave retentit, accompagné de "Arc" affiché sur la LED, le système de prévention d'arc et d'extinction (ARQ) a été activé et l'impulsion a été interrompue. Cela indique généralement une tentative de décharge de l'arc de la cuvette, mais peut également se produire si la résistance de l'échantillon est trop faible. Comme l'énergie délivrée lors d'un tel événement ARQ est faible, il est généralement possible de refaire une impulsion sur l'échantillon avec des paramètres qui ne provoqueront pas d'arc et qui produiront toujours des résultats acceptables. Cependant, il n'est pas conseillé d'utiliser un échantillon sur lequel deux événements d'arc ont eu lieu.
##### **4. Mesures**
Appuyer sur le bouton "Measurements" permet d'allumer la LED "Actual kV". Cela indique que la LED d'affichage montre la tension réelle délivrée (en kV) lors de la dernière impulsion.
Si l'appareil vient d'être allumé et qu'aucune impulsion n'a été délivrée, la LED d'affichage affiche "0,00". Appuyer à nouveau sur le bouton "Measurements" fait allumer la LED "Time ms". Cela indique que la LED d'affichage montre la constante de temps (en ms) de la dernière impulsion.
Si l'appareil vient d'être allumé et qu'aucune impulsion n'a été délivrée, la LED d'affichage affiche "0,00". En maintenant le bouton "Measurements" enfoncé, la LED d'affichage alterne entre la tension réelle et la constante de temps.
#### **3. Électroporation avec le MicroPulser**
1. Placez la suspension cellulaire dans une cuvette d’électroporation et tapotez le liquide pour le faire descendre au fond de la cuvette. Jusqu’à 0,4 ml (400 µl) de solution peuvent être placés dans la cuvette de 0,2 cm, et jusqu’à 80 µl peuvent être placés dans la cuvette de 0,1 cm. Notez que la température peut avoir une influence importante sur la fréquence de transformation. L’électroporation de certains organismes, notamment *E. coli* et *S. cerevisiae*, est plus efficace dans des cuvettes refroidies.
2. Insérez la cuvette dans le curseur de la chambre de choc. Poussez le curseur dans la chambre jusqu’à ce que la cuvette soit en contact ferme avec les électrodes de la chambre.
Pour charger le condensateur et délivrer une impulsion, appuyez sur le bouton jaune "Pulse" ; la LED d'affichage affichera "PLS" jusqu’à ce qu’un signal sonore indique que l’impulsion a été délivrée. La LED d'affichage affichera ensuite le programme, la constante de temps ou la tension réelle délivrée, en fonction de la LED sélectionnée.
3. Retirez le curseur de la chambre, retirez la cuvette et traitez l’échantillon.
4. La constante de temps et la tension réelle délivrée à l’échantillon sont affichées sur la LED en appuyant sur le bouton "Measurements". Lorsque la LED à côté de "Actual kV" est allumée, la tension est affichée en kilovolts. La constante de temps peut être affichée en appuyant à nouveau sur le bouton "Measurements". La LED à côté de "Time ms" sera allumée ; la constante de temps est affichée en millisecondes.
5. Pour éteindre l’unité, appuyez sur l’interrupteur d’alimentation sur le panneau arrière droit. La chambre de l’échantillon peut maintenant être déconnectée en toute sécurité, si souhaité. Ne retirez jamais le couvercle de la chambre de l’échantillon avant que les câbles ne soient déconnectés.
# Bain marie LSCI TBW-06
#### **[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2024-12/img-6281.JPG)**
#### **Fiche technique:**
Volume : 6 litres
L x P x H int mm : 300 x 140 x 150
Puissance : 700 W
Température de réglage : 0°C à +100°C
Résolution ±0,1°C
Stabilité ±1°C
Cuve en acier inox
#### **Précautions d'emploi:**
- Portez votre équipement de protection personnel selon la classe de danger du produit à chauffer.
- Placez l'appareil en aire spacieuse sur une surface plane, stable, propre, non glisssante, sèche et ininflammable.
- Utilisez des température adéquate suivant le fluide thermique utilisé.
- Débranchez l'appareil avant de le remplir ou de le vider de son fluide thermique.
- Nettoyez le bac après usage avec un chiffon propre et humide. Utilisez du liquide de nettoyage glace non agressif si besoin.
#### **Utilisation conforme:**
##### **Application :**
Chauffer un produit uniformément à des températures relativement basses et pendant une duré prolongé
##### **Mise en fonctionnement:**
- Vérifier que les interrupteurs généraux sont éteint (il y en a deux, un devant et un derrière)
- Remplir la cuve au 2/3 d'eau ou autre liquide thermique adéquat
- Brancher sur le secteur et allumer l'appareil
- Régler la température de chauffe en appuyant brièvement sur le bouton "Set" puis utiliser les flèches pour augmenter ou diminuer la température voulu. Par défaut la plage de valeur va de 0,0°C à 99,99°C
**Attention, ne pas maintenir le bouton "Set" plus de 5sec, il comporte l'entrée au mode de programmation et il y a un risque de déprogrammer le régulateur par mégarde**
- Au bout de 15sec le programme de chauffe débutera automatiquement
#### **Arrêt :**
- Éteindre l'appareil à l'aide des deux interrupteurs situé à l'avant et à l'arrière de l'appareil
- Attendre que le liquide soit à température ambiante avant de la vider
- Nettoyer la cuve à l'aide d'un chiffon humide
#### **Entretien :**
L'appareil ne nécessite pas d'entretien particulier, il suffit de le nettoyer avec du produit à vitre non agressif si besoin.
#####
##### **Notice :**
Vous trouverez la notice du contrôleur en pièce jointe
# Déshydrateur alimentaire
# Notice d'utilisation
[https://www.modesdemploi.fr/gorenje/fdk500gcw/mode-d-emploi?p=71](https://www.modesdemploi.fr/gorenje/fdk500gcw/mode-d-emploi?p=71)
# Osmoseur OmniaPure XS Touch UV-TOC
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/6MTimage.png)[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/0KUimage.png)
DESCRIPTION
Sert à purifier et déminéraliser l'eau. Permet d'obtenir une eau osmosée, c'est à dire, débarrassée de la majeure partie des particules solides, ions et microorganismes contenus dans une eau potable
L'OmniaPure XS Touch (UV-TOC en version standard) permet, à partir d'une eau préalablement déminéralisée, la production d'une eau de type ASTM I avec une valeur de TOC < 10 ppb. Les endotoxines, les nucléases et les protéases peuvent également être éliminées pour les applications en culture cellulaire (version UV-TOC/UF sur demande).
Équipé d'un distributeur avec commande tactile, port USB et TOC-mètre, le système OmniaPure XS Touch est ergonomique et simple d'utilisation. Il convient à des besoins de 20 à 100 L d'eau par jour.
Afin d’assurer qualité maximale de l’eau ultrapure avec la plus longue durée de vie possible des consommables, le
Le système OmniaPure xs doit être alimenté en eau dès une étape de prétraitement.
L’eau ultrapure traitée n’est pas propre à la consommation.
Le système ne doit pas être utilisé pour la production de produits pharmaceutiques et n’est pas un dispositif médical.
Cette machine combine l’efficacité des ressources, la durabilité et la recyclabilité avec les normes de qualité les plus élevées permettant de réduire considérablement les émissions de gaz à effet de serre tout au long de la vie du produit.
**PARTIES DE L'OSMOSEUR:**
[
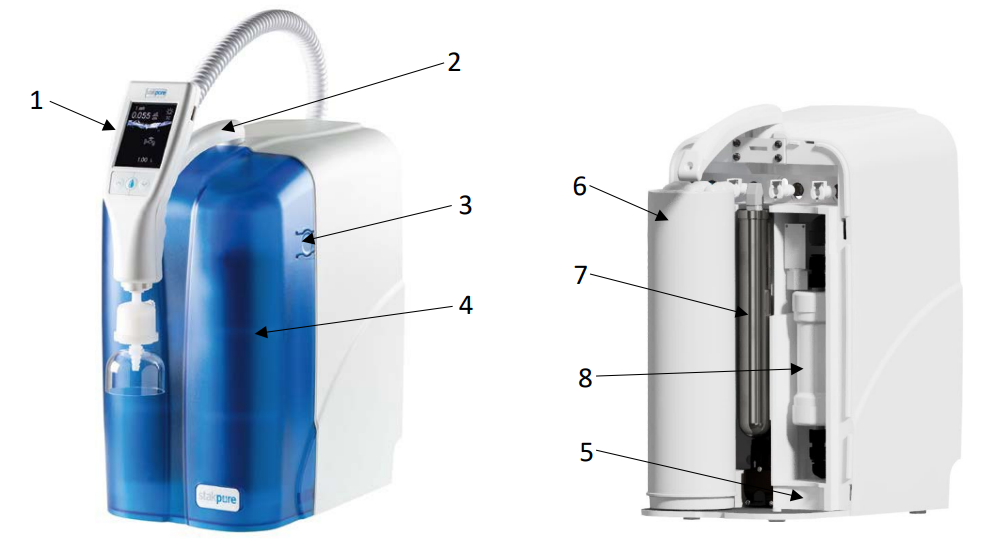](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/s6Uimage.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/lJQimage.png)
1 : Distributeur OptiFill amovible avec unité de commande intégrée et port USB
2. Bras distributeur rotatif
3 : Fermeture à pression
4 : Capot de protection amovible
5 : Espace pour la cartouche de prétraitement (pas sur la photo)
6 : Cartouche d’eau ultra-pure
7 : Réacteur UV
8 : Module d’ultrafiltration
9 : Admission du distributeur
10 : Port USB
APPLICATIONS
L’eau ultrapure produite est utilisée comme solvant ou agent de rinçage dans une grande variété de
méthodes telles que la chromatographie liquide à haute performance (HPLC), la chromatographie ionique (CI),
spectrométrie d’absorption (SAA), analyse par ultratraces, etc. Il est également utilisé dans une variété de produits chimiques et
applications biochimiques telles que la préparation de réactifs, la culture de cellules, ICP-MS, analyse de TOC, rétention des Dnases et RNases et microbiologie.
Possibilité d'applications médicales.
CARACTERISTIQUES
Conductivité µS/cm: 0.055
Résistivité Mohms.cm: 18.2
Teneur en bactérie en UFC/ml : < 0.01
Teneur en particules par mL : moins de une particule > 0.2µm
Débit de distribution : jusqu'à 2L/min
Pression d'alimentation en bar, min/max : 0.5/6
Alimentation 240v/60Hz
Dimensions L x P x H mm : 240 x 435 x 530
Poids : 14 kg
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/ENAimage.png)
FONCTIONNEMENT
L'eau ultrapure répond aux exigences respectives de l’ASTM , normes ISO, USP et CLSI.
**Pour le traitement**, l’eau (eau d’alimentation) qui a déjà été prétraitée par osmose inverse, distillation ou la déionisation est introduite dans le système OmniaPure xs. L’eau d’alimentation s’écoule d’abord à travers la cartouche de prétraitement, qui élimine déjà une grande partie des ions et des composés organiques. La qualité de l’eau prétraitée de manière appropriée ainsi que l’état de la cartouche de prétraitement sont surveillés en permanence par la première mesure de conductivité (LF1). Les valeurs actuelles de la mesure de conductivité peuvent être affichées sur l’écran de l’unité de fonctionnement/retrait (OptiFill Dispenser) à des fins de contrôle.
Dans l’étape suivante, l’eau est pompée dans le réacteur UV, où le rayonnement UV est utilisé pour photo oxyder les substances organiques. L’eau s’écoule ensuite à travers la cartouche d’eau ultra-pure, qui élimine ions restants. Enfin, pour éliminer un maximum de composés non ionisés, l’eau est filtrée à travers un module d’ultrafiltration (uniquement chez OmniaPure xs UV-TOC/UF).
Avant que l’eau ne soit distribuée par le distributeur OptiFill, la qualité de l’eau ultrapure et l’état des consommables est surveillé à l’aide d’une conductivité compensée en température mesure (LF2). Les valeurs de conductivité mesurées et la température sont affichées à l’écran du distributeur OptiFill.
Comme étape finale du traitement, l’eau ultrapure passe à travers un filtre stérile immédiatement avant d’être retirée. Afin d’assurer en permanence une qualité d’eau ultrapure élevée, l’eau ultrapure circule périodiquement à travers la cartouche échangeuse d’ions (F2), le réacteur UV et le module d'ultrafiltration (uniquement avec OmniaPure xs UV-TOC/UF).
**Affichage principal:**
[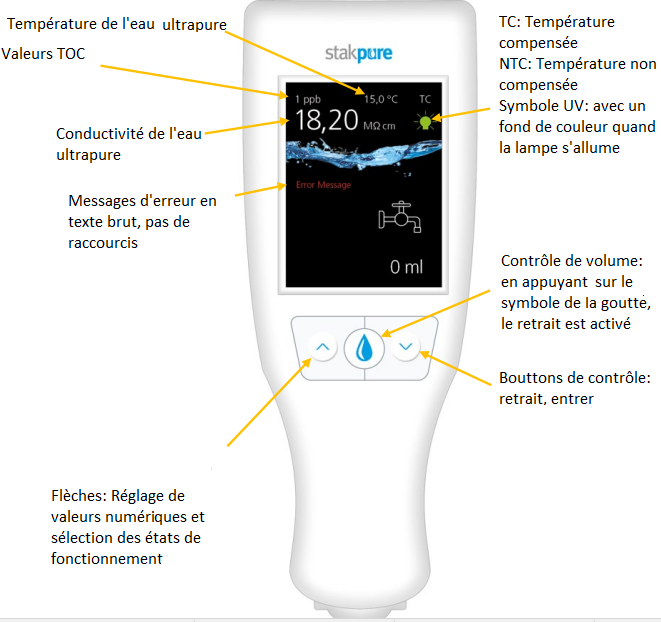](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/2Gdimage.png)
**Détails du fonctionnement:**
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/Rn3image.png)
[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/42Cimage.png)

[](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/tDeimage.png)
Après avoir appuyé sur la touche de fonction « Edit », la ligne sélectionnée est surligné en rouge. Une autre valeur peut être sélectionnée en appuyant sur la touche fléchée «^».
L’entrée est activée à l’aide de la touche goutte et la commande curseur passe au premier chiffre. Utilisez le bouton goutte pour déplacer le curseur à la position à modifier et utilisez les touches fléchées pour définir la valeur souhaitée.
Confirmez ensuite la saisie avec «Enter» et quittez le menu avec le bouton «Home».
**Métrique du volume d'eau à retirer: (Important: évacuer 100mL d'eau en amont afin de s'assurer que l'eau soit en bonne condition d'utilisation sachant que de l'eau reste bloquée dans le tube des opérations de retrait antérieures.**
Le mode de retrait s’active en appuyant sur le bouton "goutte" sous le bouton retrait de l’écran. Dans l’affichage des retraits, vous avez la possibilité de sélectionner l’un des valeurs de retrait prédéfinies. Vous pouvez sélectionner l’une des valeurs par défaut (voir le tableau ci-dessous) à l’aide de la flèche et confirmez avec la touche goutte. En appuyant à nouveau sur le bouton goutte, vous lancez le processus de retrait, qui est automatiquement arrêté lorsque la valeur de retrait définie est atteinte. Cependant, vous pouvez arrêtez la distribution d’eau à tout moment en appuyant à nouveau sur ce même bouton. Vous pouvez voir la quantité de
l’eau en cours de prélèvement sur l’écran pendant le retrait de l’eau. La conductivité de l’eau ultrapure est affichée pour vérifier la qualité de l’eau.
[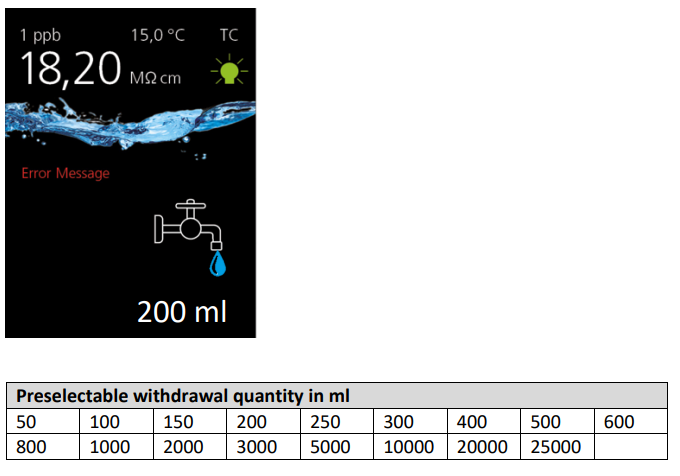](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/d0Rimage.png)
NB: Preselectable withdrawal quantity in ml = Quantité de prélèvement présélectionnable en ml
[**Commande:**
Dès que l’alimentation électrique du système OmniaPure xs est établie, le système démarre et le nom du système, le numéro de série et la version du logiciel s’affichent pendant 3 secondes. L’affichage principal apparaît.](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/d0Rimage.png)
[Start Affichage principal
](https://wiki.fablab.sorbonne-universite.fr/BookStack/uploads/images/gallery/2025-02/c9simage.png)
Information pour les fabmanagers:
Retirez maintenant au moins 2 litres d’eau en appuyant sur le bouton de retrait et jetez l'eau.
Le système est maintenant prêt à l’emploi. Il est automatiquement en mode recirculation. Au début, la conductivité peut encore être un peu plus élevée, mais elle s’améliore au cours de l’opération de recirculation.
SOURCES
[https://www.grosseron.com/omniapure-xs-touch-asd\_48-117-1-494-1-21323.html](https://www.grosseron.com/omniapure-xs-touch-asd_48-117-1-494-1-21323.html)
[https://cloup.fr/files/fiches/22.06.21\_Omnia\_xs\_touch\_EN\_fiche.pdf?21102024](https://cloup.fr/files/fiches/22.06.21_Omnia_xs_touch_EN_fiche.pdf?21102024)
https://treion.co.il/wp-content/uploads/2023/10/TREION%E2%84%A2-OmniaPure-xs-touch-EN\_Operating-Manual.pdf
# Générateur d'hydrogène gazeux
Notice du générateur d'hydrogène Parker Balston N2-04 :
[BAL\_IOM\_TI\_N2\_04K\_Nitrogen-Generator.pdf](https://wiki.fablab.sorbonne-universite.fr/BookStack/attachments/1547)