Valorisation nutritionnelle des déchets alimentaires
FLIEG FLORIAN : Florian.Flieg068@orange.fr
MADA Amira : amiramada01@gmail.comDIAKHABY DIENABA : diakhabydienaba13@gmail.com
MOHAMMAD HOSSEIN POUR BANAFSHEH : Banafshehmhp@gmail.com
IntituléIntitulé: Poudre de peaux de bananes
Contexte
- Alternative sans gluten (cible primaire).
- Alternative saine pour l'alimentation (cible secondaire).
- Alternative
ééco-responsable pour les personnes soucieuses de l'environnement (cible tertiaire).
=> ÀÀ destination de toutes classes sociales.
ProbléProblématique
Comment donner une seconde vie àà nos éépluchures de bananes ?
Objectif
CréCréer un projet innovant multi-usagesàà destination des personnesintoléintolérantes au gluten.- Valoriser des
dédéchets alimentaires (peaux de bananes).
Mode opéopératoire
Protocole prépréliminaire de transformation en poudre:
Utilisation de deux processus de séséchage diffédifférents afin d'effectuer une comparaison pour optimiser le rapport temps/tempétempérature et prépréserver la qualitéqualité de notre produit àà moindre coûcoûts.
SéSéchage : Four.Lyophilisation : Lyophilisateur.
Analyses:
- Mesure de l'AW : Appareil Rotronic (logiciel Aw Quick).
- Mesure de l'
humiditéhumidité : Balance depréprécision. - Mesure du pH : pH
mèmètre. DéDénombrements des mesures et moisissures.DéDénombrements des germes totaux.- Mesure des glucides.
- Mesure des
protéprotéines. - Mesure du contenu en fibres.
Date : Lundi 25 Novembre 2024 ; Heure : 14h –– 17h30
Lieu : FabLab
Compte rendu des manipulations : Valorisation des dédéchets alimentaires "peaux de bananes en poudre"
Mise au point du matématériel du laboratoire et validation des protocoles :
- AccèAccès au laboratoire.
- Identification du matématériel et de la matièmatière premièpremière.
- Etablissement du protocole.
- PréPréparation du matématériel et de la matièmatière premièpremière.
I- RéRéduction des éépluchures en poudre
DéDébut du travail :
StéStérilisation dumatématériel.PréPréparation deséépluchures de banane. (Figure 1)DéDécoupage deséépluchures de banane et dressage sur del’l’aluminium alimentaire. (Figure 2)SéSéchage au fouràà hautetempétempérature pendant 2hàà 65C°C°. (Figure 3)- Broyage des peaux de banane
séchéséchéesààl’l’aided’d’un mortier - Tamisage de la poudre pour
ééliminer toutes particules. - Codification des
ééchantillons.
Figure 1 : Peaux sur plaque d'aluminium
Figure 2 : Peaux découpédécoupées (prépré-séséchage)
Figure 3 : Four XUEII2 utiliséutilisé (65°65°C)
RéRésultats des manipulations :
°Aprè°Après 2h de séséchage => peaux légèlégèrement humides, brunies (Figure 4). Odeur conservéconservée.
Figure 4 : Peaux post séséchage (2h)
Conclusion => Poursuite du séséchage sur la nuit àà 65C°65C°
Date : Mardi 26 Novembre 2024 ; Heure : 9H50 –– 10H10
Lieu : FabLab
°Aprè°Après 16h30 de séséchage => de 17h30 jusqu'àà 10H
Remarques: - Peaux sèsèches, brunies (Figure 5).
- Odeur conservéconservée.
Figure 5 : peaux post séséchage (16h30)
Date : Mardi 26 Novembre 2024 ; Heure : 14H –– 18H
Lieu : FabLab
- Broyage des peaux de banane
séchéséchéesààl’l’aided’d’un mortier ( Figure 6 ) - Tamisage de la poudre pour
ééliminer toutes particules. - Codification des
ééchantillons.
Figure 6 : Broyage des peaux de banane avec un mortier
Figure 7 : PeséPesée de la poudre de peaux de banane obtenue
II-Tests physico-chimiques
Figure 8 : Mesure du taux d'humiditéhumidité de la poudre de banane
Calcul du taux d'humiditéhumidité de la poudre de bananes : 5%
Poids de la poudre avant 4.21g et aprèaprès 4.01g pour 110°110°C
Date : Mercredi 27 novembre 2024 ; Heure : 14H –– 18H
Lieu : FabLab
- Mesure de l'AW et du pH du Test n°n°1
- Lancement d'un nouveau processus de séséchage Test n°n°2
- Lavage des peaux dans de l'eau
salésalée (50g de sel) pendant 10 minutes. PeséPesée des peauxprépré-séséchage (279,44g).- Mise sur grille et
séséchageàà65°65°C pendant 17h.
Peaux séchéséchées aprèaprès 17h àà 65°65°C
Date : Jeudi 28 novembre 2024 ; Heure : 10H –– 12H
Lieu : FabLab
RéRéduction en poudre du 2nd séséchage
- Broyage des peaux de banane
séchéséchéesààl’l’aided’d’un mixeur - Tamisage de la poudre pour
ééliminer toutes particules. (0,25mm) (mettre photo) - Codification des
ééchantillons.
Mixeur et tamis
PeséPesée de la poudrePeséPesée desdédéchets nontamisétamisés
Mesure du taux d'humiditéhumidité de la poudre de banane (2è2ème ééchantillon)
PeséPesée de l'ééchantillon (3,01g)- Mesure de l'
humiditéhumidité (dessiccateur OHAUS) PeséPesée de l'ééchantillondéshumidifiédéshumidifié (2,90g)
=> HumiditéHumidité dans l'ééchantillon = 3,01 - 2,90 = 0,11g
Poids prépré dessiccation Poids post dessiccation
Mesure de l'activitéactivité de l'eau :
PeséPesée de l'ééchantillon (1g)
=> ActivitéActivité de l'eau = 0,320 AW
Mesure du pH:
- 5g de poudre
diluédilués dans 50 mL d'eau
=> pH = 5,83
Date : Jeudi 28 novembre 2024 ; Heure : 14H –– 17H
Lieu : FabLab
PréPréparation des milieux de culture bactébactériens :
°°Milieu PCA : dédénombrement des germes totaux: 200mL
- Tryptone : 1 g
- Extrait de levures : 0,5g
- D-Glucose : 0,25g
- Agar : 3g
- QSP 200 mL eau
distillédistillée
°°Milieu Sabouraud chloramphéchloramphénicol : dédénombrement de levures et moisissures : 200mL
- Peptone : 2g
- D-Glucose : 4g
ChloramphéChloramphénicol : 0,5g- Agar : 3g
- QSP 200 mL eau
distillédistillée
PréPréparation et pesage :
Mettre en autoclavage pendant 1h30
Date : Mardi 03 DéDécembre 2024 ; Heure : 14H –– 17H
Lieu : FabLab
Lancement d'un nouveau séséchage 4Kg de bananes
Date : Mercredi 04 DéDécembre 2024 ; Heure :
Lieu : FabLab
Broyage tamisage et pesage de la poudre
Date : Jeudi 05 DéDécembre 2024 ; Heure :
Lieu : FabLab
Analyse des protéprotéines
Date : Vendredi 06 DéDécembre 2024 ; Heure :
Lieu : FabLab
Refaire l'analyse des protéprotéines
Date : Lundi 09 DéDécembre 2024 ; Heure :
Lieu : FabLab
rePrérePréparation des milieux
Date : Mardi 10 DéDécembre 2024 ; Heure :
Lieu : FabLab
Milieux + éécoulement
Date : Mercredi 11 DéDécembre 2024 ; Heure :
Lieu : FabLab
Fibres fail + lecture PCA du 9 dédécembre
Date : Jeudi 12 DéDécembre 2024 ; Heure :
Lieu : FabLab
Refaire Fibres + Lancer calcification + reprérepréparer les milieux
Date : Vendredi 13 DéDécembre 2024 ; Heure :
Lieu : FabLab
Refaire les milieux + éécoulement + lecture cendres
Date : Lundi 16 DéDécembre 2024 ; Heure :
Lieu : FabLab
lecture microbio + glucides prépréparation du NaOH et HCl pour la colorimécolorimétrie
Date : Mercredi 18 DéDécembre 2024 ; Heure :
Lieu : FabLab
PréPréparation DNS et dilutions glucose
Date : Jeudi 19 DéDécembre 2024 ; Heure :
Lieu : FabLab
refaire DNS + lecture spectro
Date : Vendredi 20 DéDécembre 2024 ; Heure :
Lieu : FabLab
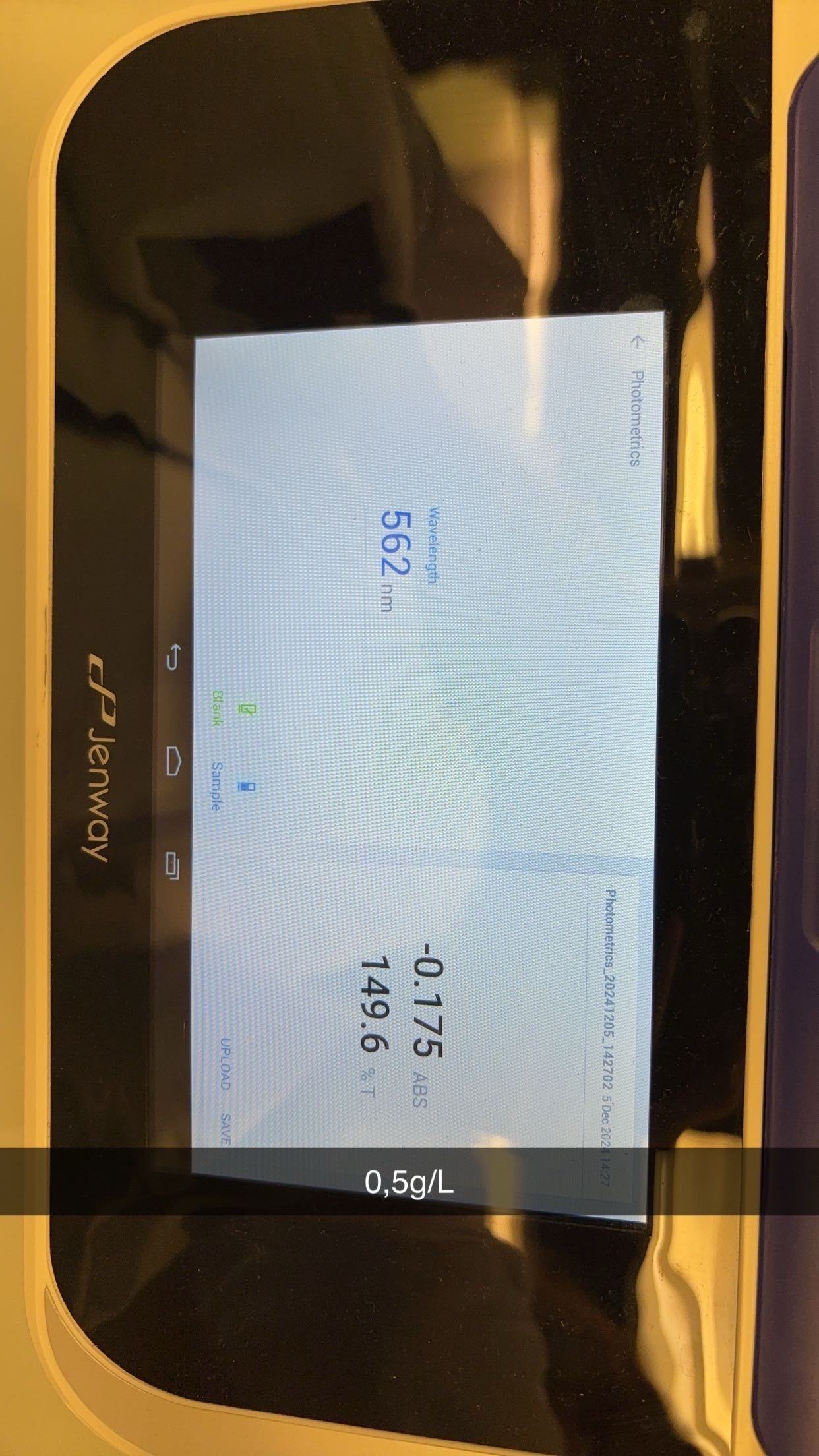
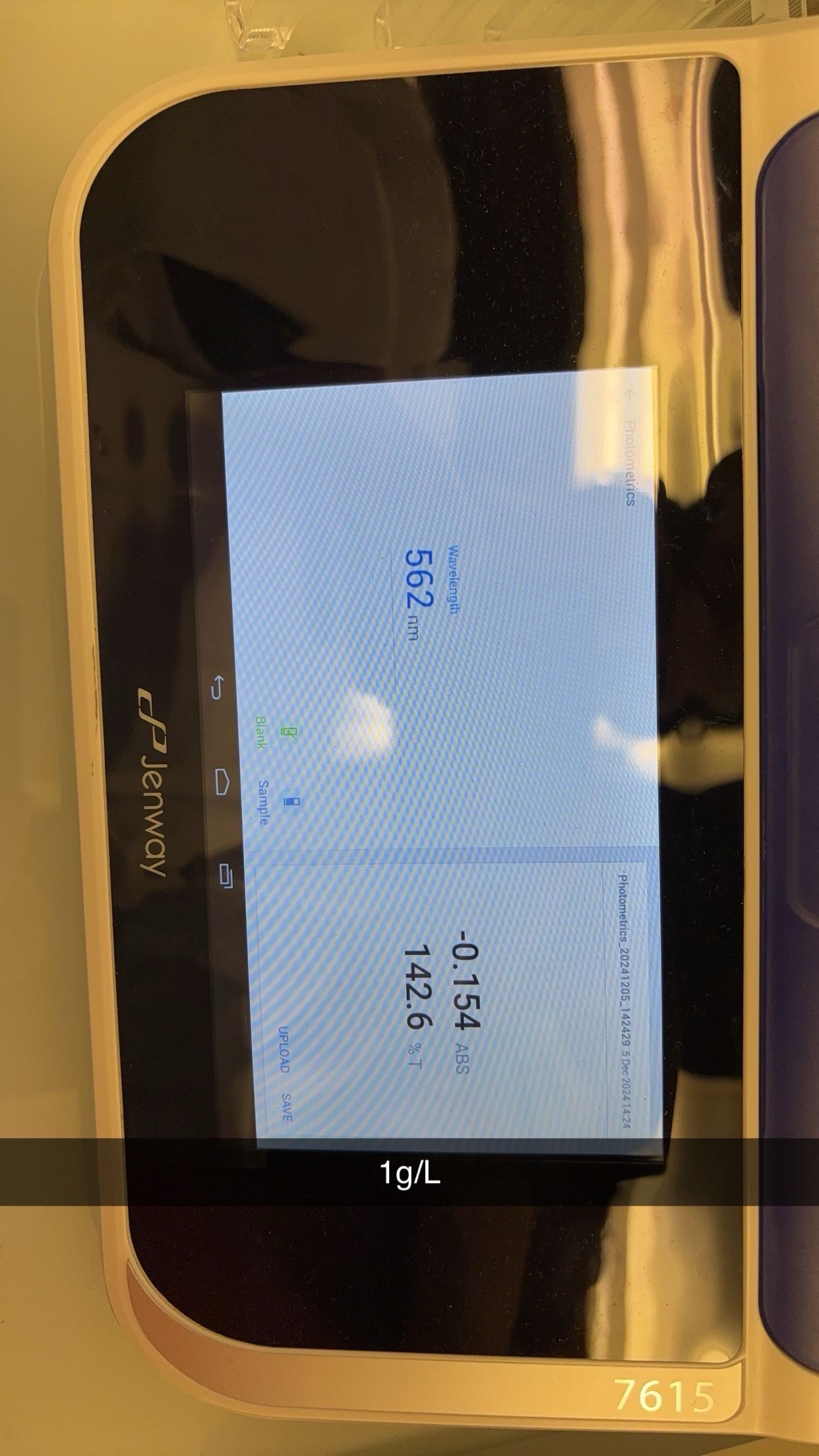
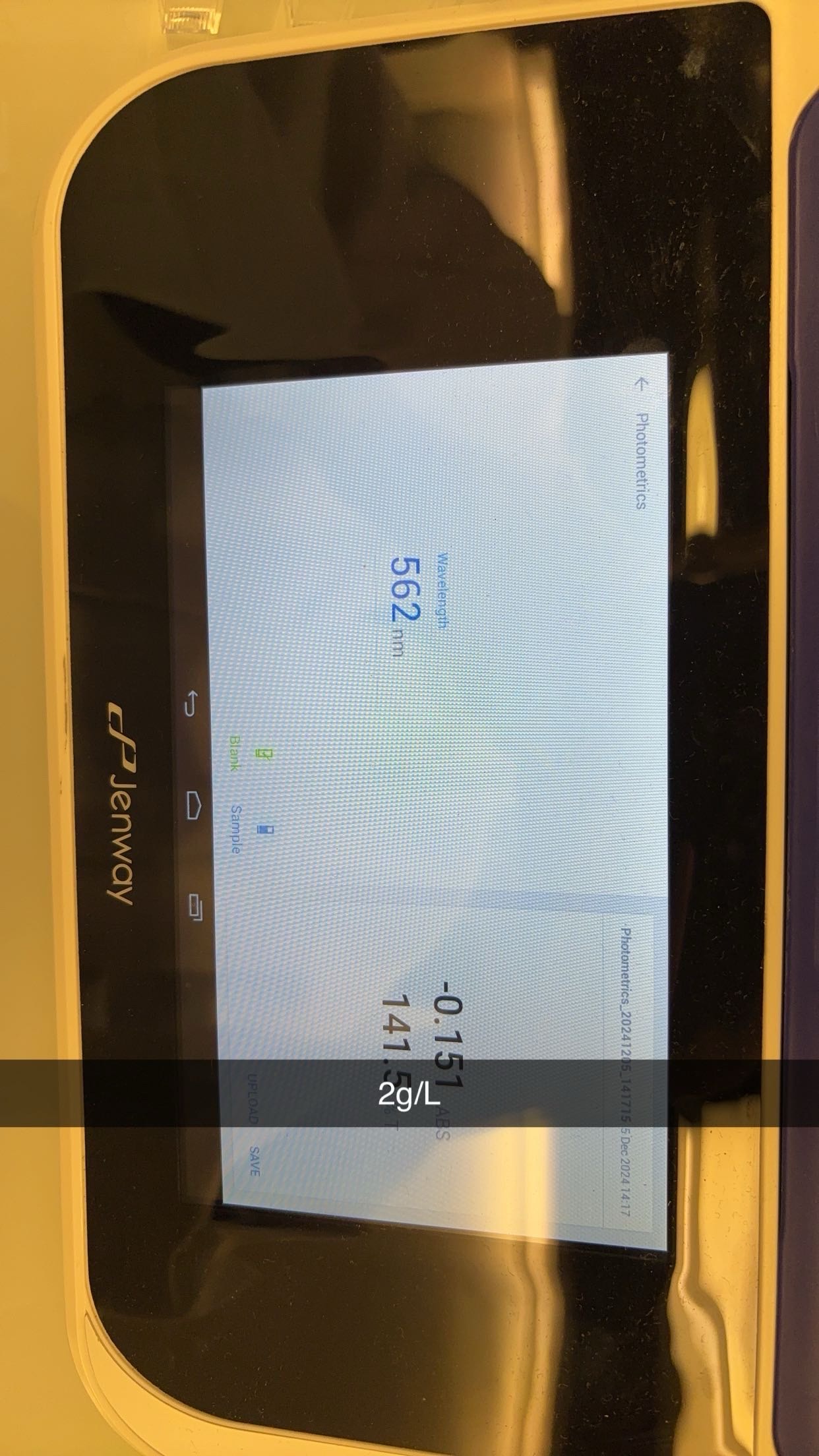
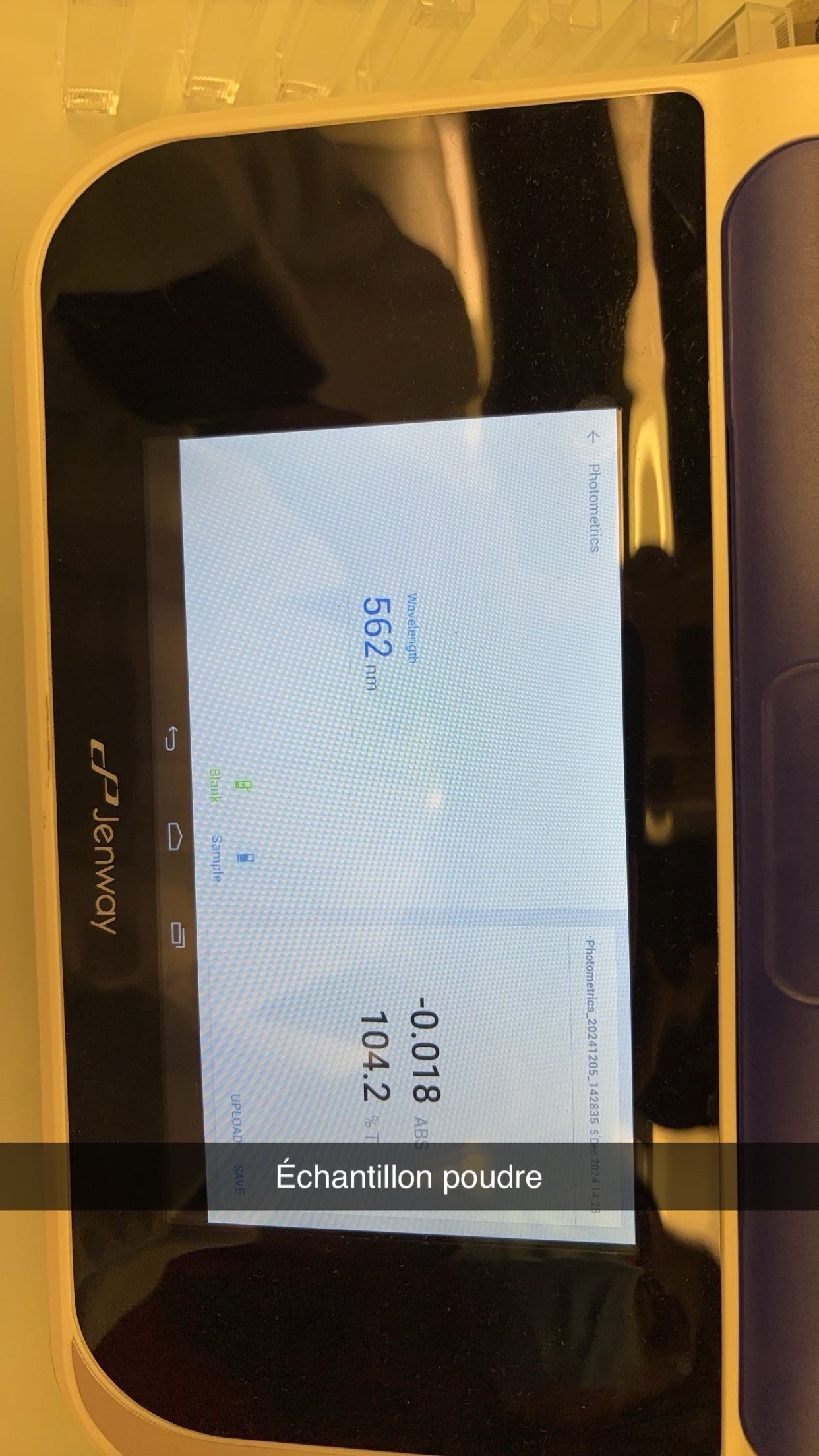
Analyse des glucides
- MéMéthode colorimécolorimétrique
Date : Mercredi 08 Janvier 2025; Heure :
Lieu : FabLab
Mise au point sur l'analyse des glucides et antioxydants
Date : Lundi 13 Janvier 2025; Heure :
Lieu : FabLab
Analyse des glucides
MéMéthode colorimécolorimétrique
Date : Mardi 14 Janvier 2025; Heure :
Lieu : FabLab
Analyse des glucides
1. Préparation de l’échantillon :
Peser 1 g de poudre de peau de banane dans un bécher ou tube à essai.Ajouter 100 mL d’eau distillée.Homogénéiser la solution.Chauffer au bain-marie à 100 °C pendant 30 minutes pour extraire les glucides.
2. Hydrolyse acide (si les glucides sont complexes) :
Ajouter 1 mL d’acide chlorhydrique (HCl, 6M) ou 1 mL d’acide sulfurique dilué (30 %).Chauffer à 100 °C pendant 30 minutes.Laisser refroidir, puis neutraliser avec une solution de NaOH 6M (ajouter goutte à goutte jusqu’à pH neutre).Diluer jusqu’à un volume final de 10 mL avec de l’eau distillée.
3. Réaction avec le phénol-acide dilué :
Prélever 1 mL de l’échantillon dilué dans un tube à essai.Ajouter 1 mL de solution de phénol à 5 %.Ajouter lentement 5 mL d’acide sulfurique dilué (30 %) ou d’acide chlorhydrique dilué (6M). Versez doucement pour éviter une surchauffe.Agiter vigoureusement pour bien mélanger.Laisser refroidir à température ambiante pendant 10 minutes.
4. Lecture de l’absorbance :
Mesurer l’absorbance à 490 et 540 nm avec un spectrophotomètre.Si le spectrophotomètre n’est pas disponible, comparer visuellement la coloration avec les standards de glucose préparé
5. Préparation d’une gamme étalon :
Préparer des solutions de glucose standard dans une gamme de concentrations (Tableau 3)Traiter chaque solution standard selon les étapes 3 et 4.Construire une courbe d’étalonnage en traçant l’absorbance en fonction de la concentration de glucose.
4. Tableau 3 : Concentration glucidique pour gamme étalon
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6. Calcul de la concentration en glucides totaux :
Utiliser la courbe d’étalonnage pour déterminer la concentration en glucides de votre échantillon.Exprimer le résultat en mg de glucides par g de poudre de peau de banane.
Dilution Chromato
Date : Mercredi 15 Janvier 2025; Heure :
Lieu : FabLab
Analyse des antioxydants
Préparation de l’échantillon :
a. CCM Pesée de l’échantillon en poudre
Prélevez1 gd'échantillon en poudre (par exemple, une poudre sèche obtenue par lyophilisation ou séchage de kombucha).
b. Extraction avec solvant
Ajoutez15 mL de solvant d'extraction(éther éthylique) à l'échantillon en poudre dans un bécher.Mélangez le tout à l’aide d’un agitateur magnétique pendant5 à 10 minutespour bien dissoudre les composés phénoliques présents dans la poudre.
c. Filtration
Filtrez le mélange pour éliminer les particules solides non dissoutes (papier filtre ou centrifugation).
d. Transfert dans un entonnoir de séparation
Versez le filtrat dans unentonnoir de séparation.Ajoutez à nouveau15 mL d’éther éthyliquepour assurer une meilleure extraction des composés phénoliques.
e. Séparation des phases
Secouez doucement l'entonnoir de séparation pendant5 minutes, puis laissez reposer pour permettre aux deux phases (aqueuse et organique) de se séparer.Récupérez laphase organique (couche d’éther)dans un ballon jaugé.
f. Concentration de l’échantillon
Vaporisez la phase organique (couche d’éther) à l’aide d’unévaporateur rotatifou en utilisant unbain-marieà une température contrôlée (environ 40°C) jusqu'à ce qu'il reste1 mLde solution concentrée.
g. Préparation pour la TLC
Utilisez cette solution concentrée pour réaliser votre dépôt sur la plaque desilice TLC.
Préparation des standards :
Nous disposons de divers types de standards (épicatéchine, quercétine, L-dopamine, ß-carotène, riboflavine). Pour chaque standard, on suit le protocole suivant.
°Prélever 10mg de standard sous forme de poudre
°Diluer la poudre dans 1ml d’eau distillée
Préparation de l’éluant : pour épicatéchine, quercétine
°Mélanger 50mL de chloroforme, 40mL d’acétate éthyle et 10mL d’acide formique (99%)
°Pour un volume final de 100mL rapport (5 ;4 ;1 v ; v ; v)
Préparation de l’éluant : pour L-dopamine, ß-carotène, riboflavine
°Mélanger 90ml de chloroforme à 10mL de méthanol
°Pour un volume final de 100mL rapport (9 ;1 v ; v)
Mise sur plaque et CCM (chromatographie sur couche mince) :
°Disposer sur une plaque en verre couverte de silice une goutte de chaque échantillon (poudre de peaux et standards)°Laisser sécher et répéter l’étape 3 fois
°Disposer la plaque dans une cuve CCM
°Ajouter l’éluant et laisser migrer 20/30 min
°Après migration, révéler aux UV selon l’antioxydant étudié (épicatéchine, L-dopamine incolores)
Date : Vendredi 17 Janvier 2025; Heure :
Lieu : FabLab
Analyse des antioxydants : riboflavine, ß-carotène, dopamine
CCM