Label vert: La larve mangeuse de plastique
Nom : LE TOQUIN Juliette, SOUFIANI Noha, BOUATIR Fatima Ezzahraa, FERNANDES PEREIRA Alizée
Projet : La larve Galleria Mellonella mangeuse de plastique (PS/PEBD)
Introduction:
Le plastique est une matière qui pollue énormément et elle se retrouve bien trop souvent dans l’environnement. Le problème qui se pose est la dégradation totale ou partielle du plastique. On souhaite donc au travers de notre projet présenter une nouvelle méthode de dégradation du plastique qui est encore en cours de développement. En effet, des recherches récentes ont essayé de déterminer la capacité de certaines larves à dégrader le plastique.
Objectif : Notre projet a pour but d’étudier l’efficacité de l'une des larves étudiées, la larve Galleria Mellonella, à dégrader le plastique et de pouvoir comparer les différents résultats. Dans notre cas, nous prendrons deux types de plastiques différents: du polyéthylène basse densité (PEBD) et du polystyrène (PS). En effet, nous cherchons donc à mettre en confrontation nos différentes expériences.
- Etude bibliographique et documentation
- Création d'un poster
- Expérience au Fablab (Biologie-Chimie et Prototypage)
Galleria mellonella (Gm) est une espèce de Lepidoptera dans la famille Pyralidae. Nommée teigne de ruche, c'est une larve que l'on utilise principalement pour la pêche. Son cycle de développement varie de 4 semaines à 6 mois selon les conditions et comprend 4 phases (œuf, larve, nymphe et adulte). C'est dans les alentours de mars qu'elle se développe et atteint son pic autour d’août. Dans le cadre de ce projet, nous allons nous intéresser seulement à son stade de larve.
Expérimentation/Manipulation:
I/ Protocole expérimental: Préparation des tests + témoin
Fablab prototypage:
1. Broyer les bouteilles en PEBD
Fablab de biologie:
2. Nettoyer les béchers/erlenmeyers/cristallisoirs à l'éthanol
3. Faire des copeaux de cire d'abeille à l'aide d'un économe/scalpel
4. Émietter le PS en petits morceaux
5. Avant toutes préparations, peser les récipients, le PEBD, le PS, les copeaux de cire, et les larves à l'aide d'une balance de pesée
6. Mises en places des tests/témoins* :
- Témoin: Bécher de 500 ml + 10.85 g de cire + 43 larves Gm (18.855 g)
- Test 1: Bécher de 250 ml (90,5968g) + 10.85 g de cire + 34 larves Gm (15.9 g) + 0.7 g de PS
- Test 2: Bécher de 250 ml (118,57g) + 10.85 g de cire + 36 larves Gm (15.5419 g) + 10.8 g de PEBD
- Test 3: Erlenmeyer de 250 ml (134,4g) + 36 larves Gm (16.05g) + 17.15 g de PEBD
- Test 4: Erlenmeyer de 250 ml (134,6g) + 44 larves Gm (20,27g) + 1 g de PS
- Test 5: Cristallisoir de 795 g + 29 larves Gm (14.6296 g) + 2,6301 g de PEBD (film alimentaire). Le cristallisoir est recouvert par son couvercle en verre.
- Test 6: Cristallisoir de 991.84 g + 10.88 g de cire + 38 larve Gm (18.1318 g) + 2.7634 g de PEBD (film alimentaire). Le cristallisoir est recouvert par son couvercle en verre.
- Test 7: Bécher de 800 ml (243.38 g) + 38 larves (18.547 g) + 1.0735 g de PS
7. Mettre les tests/témoin dans une grosse boîte en plastique que l'on mettra dans une salle close, sans lumière, à 22-23°C.
* récipients couverts avec du papier aluminium rempli de petits trous
Matériel nécessaire à la réalisation de nos expériences:
- Fablab de Biologie: 350 larves Gm vivantes, bloc de cire d'abeille, 1 bécher de 500 ml, 2 béchers de 250 ml, 2 erlenmeyers de 250 ml, 2 cristallisoirs, papier aluminium alimentaire, une Brucelles en plastique, plaque de polystyrène, 2 bouteilles en PEBD, thermomètre mercure, scalpel, économe
- Fablab de Chimie: Accessoire ATR diamant, éthanol de nettoyage
- Fablab prototypage: broyeuse
II/ Observations:
| Dates, T(°C), | Témoin |
Test 1 |
Test 2 | Test 3 | Test 4 | Test 5 |
Test 6 |
Test 7 |
|
27/03/2023, 14h40, 22°C |
8 mortes | 8 mortes | 10 mortes | X | X | X | X | X |
|
29/03/2023, 16h21, 23°C |
6 mortes | 1 morte | 4 mortes | 12 mortes | 9 mortes | X | X | X |
|
31/03/2023, 9h57, 23°C |
4 mortes* | 5 mortes | 1 morte* |
8 mortes* + perte de PE |
13 mortes* | X | X | X |
|
03/04/2023, 11h17, 22°C |
2 mortes * |
0 morte |
5 mortes * |
5 mortes | 10 mortes | X | X | X |
| 05/04/2023, 11h, 22.5°C |
0 morte * |
0 morte * |
0 morte * |
0 mortes | 6 mortes | X | X | X |
|
07/04/2023, 12h, 24°C |
0 morte |
2 mortes |
0 morte |
1 morte |
0 morte |
X | X | X |
|
11/04/2023, 13h53, 23°C |
1 morte |
0 morte |
0 morte * |
1 morte | 1 morte | 2 mortes | X | X |
|
13/04/2023, 10h30, 23°C |
0 morte |
0 morte |
0 morte |
0 morte | 0 morte | 1 morte | 1 morte | 1 morte (+1 cocon) |
|
14/04/2023, 14h, 22,5°C |
0 morte |
0 morte |
1 morte |
0 morte | 1 morte | 1 morte | 0 morte | 5 mortes |
|
18/04/2023, 13h20, 23,5°C |
1 morte |
1 morte |
1 morte |
4 mortes |
1 morte |
1 morte |
1 morte |
8 mortes |
- 23/03/2023, 12h, 23°C: mise en place du témoin et des tests 1 et 2 ( arrivée des larves depuis 2j (au frais))
- 27/03/2023, 14h50, 22°C: mise en place des tests 3 et 4 (arrivée jour même)
- 07/04/2023, 12h, 24°C: mise en place du test 5 (arrivée des larves la veille (au frais))
- 11/04/2023, 15h15, 23°C: mise en place des tests 6 et 7 (arrivée des larves le 6/04/23 (au frais))
05/04/2023: diminution forte de la cire
* présence de soie
À la fin de l'expérience :
| Témoin | Test 1 | Test 2 | Test 3 | Test 4 | Test 5 | Test 6 | Test 7 | |
| durée | 3 semaines et 1 jour |
3 semaines et 1 jour | 3 semaines et 1 jour | 2 semaines et 6 jours |
2 semaines et 6 jours | 1 semaine |
5 jours |
5 jours |
| final |
20 larves vivantes : 6,4352g et un cocon |
17 larves vivantes: 6,1753g |
14 larves vivantes: 4,7291g et un cocon |
5 larves vivantes: 1,6712g |
2 vivantes: 0,7676g et un cocon |
23 vivantes: 10,462g et un cocon |
35 vivantes: 14,966g et un cocon en formation |
23 larves vivantes: 9,647g et un cocon |
III/ Analyses expérimentales
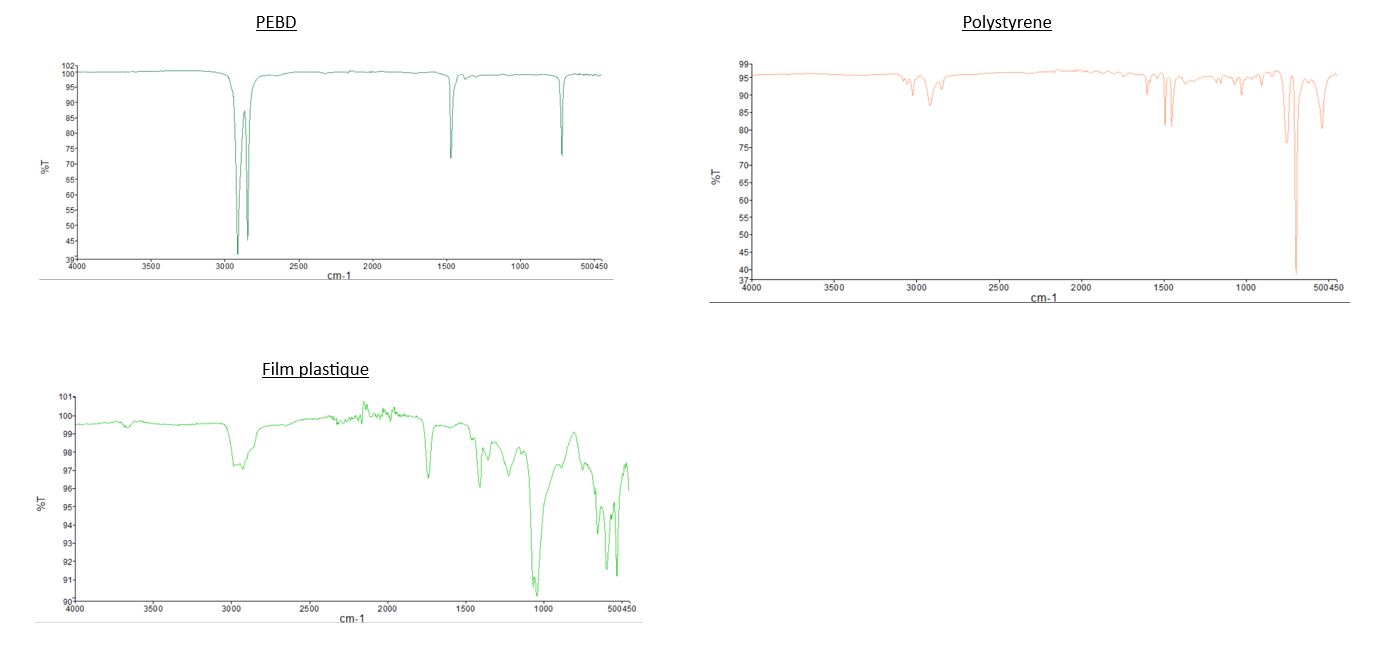
Analyses IR en ATR:
| Nom du plastique | PEBD | PS |
| Pic(s) caractéristique(s) |
Alcane
|
Alcane
Aromatique
|
- Analyse en début expérience: 31/03/2023
- Analyse en fin expérience: 18/04/2023
EXPLOITATION DES RESULTATS
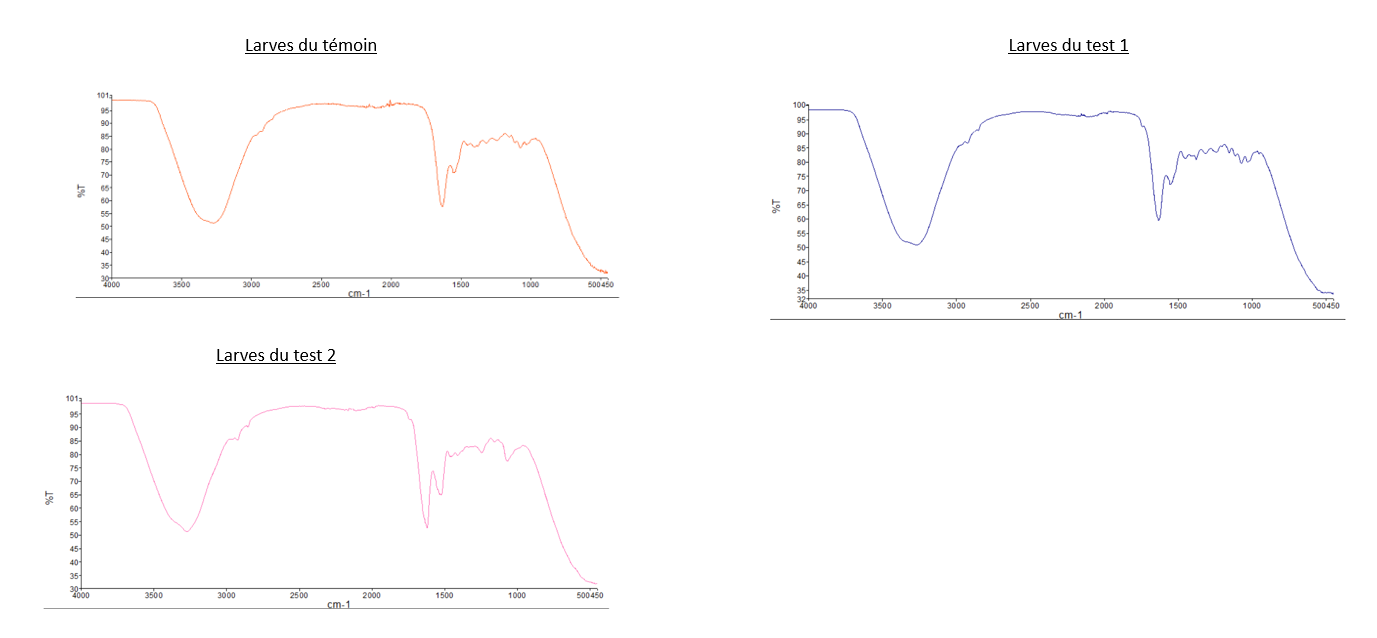
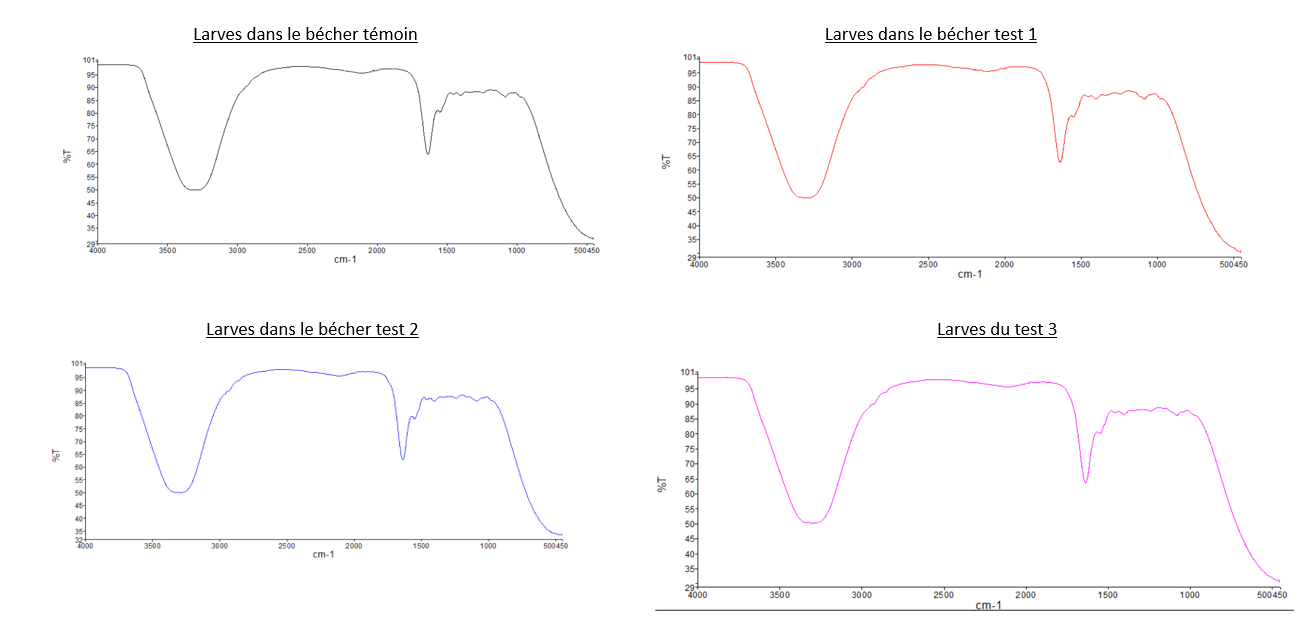
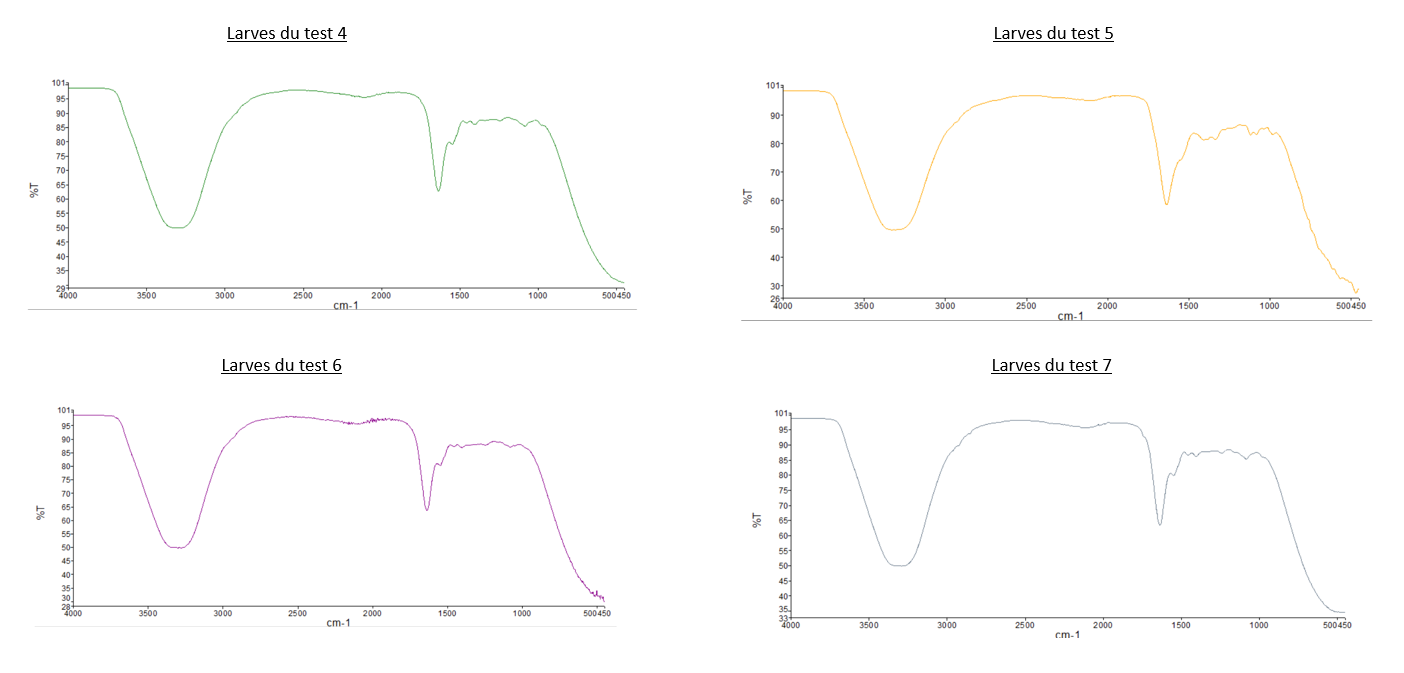
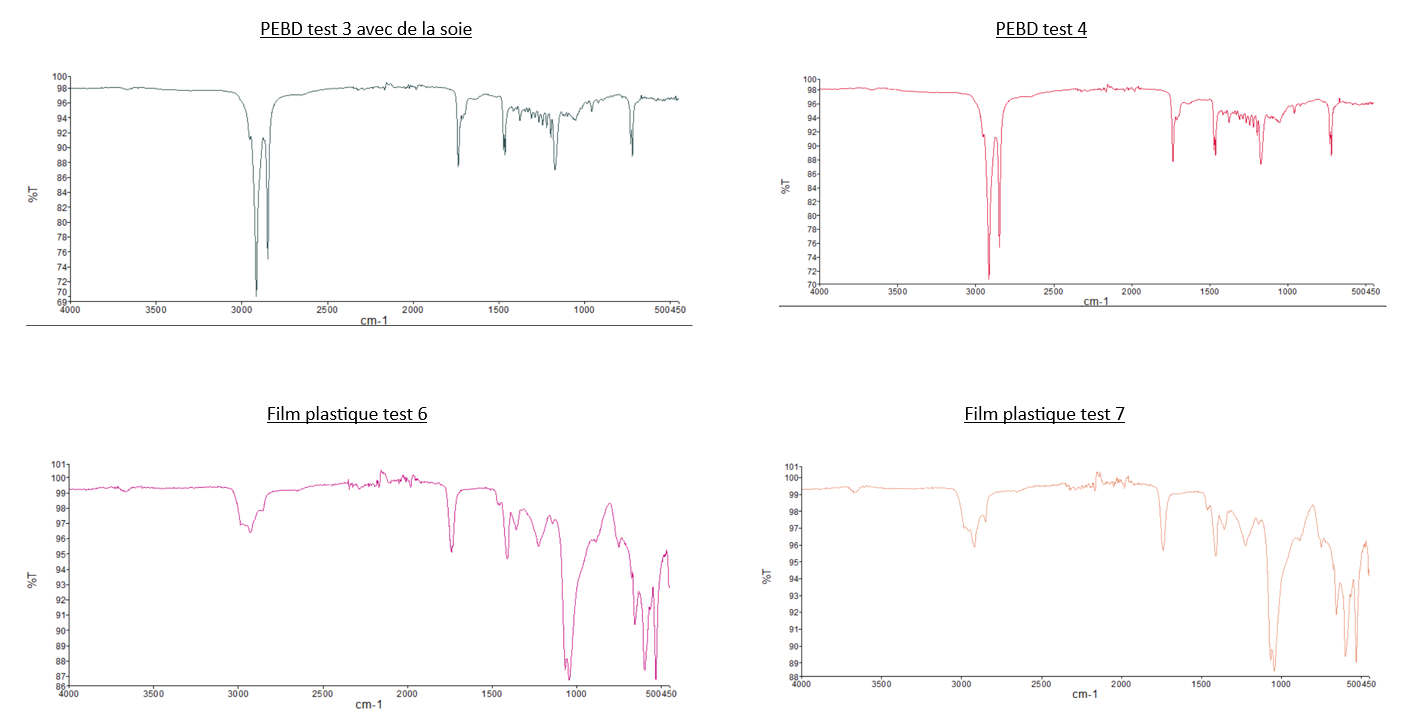
- Comparaison du spectre IR du PEBD avec les deux
spectrespectres des "Larves test 2" et celuidedes "Larves test 3": Nous pouvons observer que les pics caractéristiques du PEBD ne sont pas présents sur les spectres des larves, dont les tests sont composés de PEBD. Pour illustrer ce propos, nous pouvons relever que les 2 pics de forte intensité à 2800 cm-1 et 2900 cm-1 présent sur le spectre IR du PEBD, ne sont pas observable sur sur les spectre du test 2 et 3. - Comparaison du spectre IR du PS avec les deux
spectrespectres des "Larves test 1" et celuidedes "Larves test 4": Même observation que celle pour le PEBD: nous n'observons pas de pics caractéristiques du PS sur les spectres des larves. - Comparaison
dedu spectre IR des "Larves du témoin" avec tous les autres spectres des larves: Les spectres des larvesontsontlestousmêmessimilairesspectresmalgréqueleurs conditions différentes.
Remarque: Les pics caractéristiques à la larve Galleria Mellonella
CONCLUSION
Notre expérience a permis l’étude et l’observation du développement des larves Galleria Mellonella. Celles exposées uniquement aux plastiques s’en sont nourries et semblent anormalement plus grandes et grosses que celles se nourrissant aussi de cires. La spectroscopie IR en ATR ne présente pas de résultats concluants. Donc la présence de résidus de PS et PEBD est indiscernable.
PERSPECTIVES
Les résultats observés peuvent avoir été causé par de nombreux paramètres que nous avons du changer comparer à ceux établit dans les articles de références. Ainsi nous avons utilisé des plastiques (PEBD et PS) non stérilisés, effectuer des analyses IR en ATR, effectuer nos tests dans des béchers/erlenmeyers/cristallisoirs. Or eux, dans leurs cas, le plastiques avaient été stérilisés avant son introduction dans les tests à partir d’éthanol, ils ont caractérisé leurs éléments à travers des analyses plus précisent de l'ATR: FTIR, GC-MS ou l'imagerie hyperspectral.
BIBLIOGRAPHIE
- Lou, Yu, et al. « Biodegradation of Polyethylene and Polystyrene by Greater Wax Moth Larvae ( Galleria Mellonella L.) and the Effect of Co-Diet Supplementation on the Core Gut Microbiome ». Environmental Science & Technology, vol. 54, no 5, mars 2020, p. 2821‑31. DOI.org (Crossref), https://doi.org/10.1021/acs.est.9b07044
- Yang, Jun, et al. « Evidence of Polyethylene Biodegradation by Bacterial Strains from the Guts of Plastic-Eating Waxworms ». Environmental Science & Technology, vol. 48, no 23, décembre 2014, p. 13776‑84. DOI.org (Crossref), https://doi.org/10.1021/es504038a
- Cassone, Bryan J., et al. « Role of the Intestinal Microbiome in Low-Density Polyethylene Degradation by Caterpillar Larvae of the Greater Wax Moth, Galleria Mellonella ». Proceedings of the Royal Society B: Biological Sciences, vol. 287, no 1922, mars 2020, p. 20200112. DOI.org (Crossref), https://doi.org/10.1098/rspb.2020.0112
- Bombelli, Paolo, et al. « Polyethylene Bio-Degradation by Caterpillars of the Wax Moth Galleria Mellonella ». Current Biology, vol. 27, no 8, avril 2017, p. R292‑93. ScienceDirect, https://doi.org/10.1016/j.cub.2017.02.060.