Extraction du chitosane et élaboration d'un film alimentaire biosourcé
Informations
- Lucie Granjeon (L),
StéStéphanie Siek (S), Rozelin Yilmaz (R) - lucie.granjeon@etu.sorbonne-universite.fr ; stephanie.siek@etu.sorbonne-universite.fr ; rozelin.yilmaz@etu.sorbonne-universite.fr
- Licence 3 monodisciplinaire chimie
- 25/03/2024 - 12/04/2024
Contexte
A l'heure oùoù la chimie a besoin de se dédétacher du prétrosourcéprétrosourcé et alors que 8 millions de tonnes de dédéchets de crustacécrustacés sont produits par an, la valorisation de ces dédéchets pour obtenir du chitosane est une alternative prometteuse. Ce biopolymèbiopolymère préprésente en effet de nombreuses propriétépropriétés et applications potentielles, notamment la capacitécapacité de former des films, ce qui ouvre la voie àà des applications aussi bien dans le domaine de l'agroalimentaire que dans le domaine mémédical.
Objectifs
- Montrer que les
dédéchets alimentaires sont une source debiopolymèbiopolymères qui peuventêêtre une alternative aux films alimentaires enpolyéthylèpolyéthylène - Tester et comparer la
capacitécapacité du filmààprépréserver un fruit par rapport au film enpolyéthylèpolyéthylène ÉÉvaluer labiodégradabilitébiodégradabilité du film et sasolubilitésolubilité et comparaison avec les films enpolyéthylèpolyéthylène


MatéMatériel
- Papier pH
- Barreau
aimantéaimanté - Plats de cuisine en verre
borosilicatéborosilicatétrempétrempé - Mixeur/broyeur de cuisine
BoîBoîtes depépétri en verreFrittéFritté (porositéporosité 1)- Fiole
àà vide - Coupelles de
pesépesée - Spatule
- Pipette
graduégraduée de 10 mL - Fioles
jaugéjaugées ( volumeàà adapter en fonction des besoins) BéBéchers en verre ( volumeàà adapter en fonction des besoins)- Eprouvettes
graduégraduées ( volumeàà adapter en fonction des besoins) - Micropipettes
- Flacons (contenance
àà adapter en fonction des besoins)
Produits utiliséutilisés
- Chitosane de faible poids
molémoléculaire (n°n° CAS : 9012-76-4) - pastilles de NaOH (
n°n° CAS : 1310-73-2) - HCl 37% (
n°n° CAS : 7647-01-0) - Hypochlorite de sodium 14% Cl2 en solution aqueuse (
n°n° CAS : 7681-52-9) - Acide lactique de
qualitéqualité technique (n°n° CAS : 79-33-4) GlycéGlycérol anhydre (n°n° CAS : 56-81-5)- acide
acéacétique glacial pour analyses (n°n° CAS : 64-19-7)
Machines utiliséutilisées
- Sorbonne fixe
- Centrifugeuse
réfrigéréréfrigérée (modèmodèle : Sirena ; fabricant : Afi) - Etuve universelle
ventiléventilée 112 litres (300°300°C) (modèmodèle : XUE112 ; fabricant : Franceéétuves) - Agitateur
magnémagnétique chauffant (fabricant : IKA RCT) - Pompe
àà vide (modèmodèle : N022AN ; fabricant : KNF) - Balance d'analyse max 320 g
àà 0,1 mg (modèmodèle : ABS 320-4M ; fabricant : Kern) SpectromèSpectromètre FT-IR (modèmodèle : Spectrum Two ; fabricant : PerkinElmer)
ÉÉtapes du projet
ÉÉtape 1 : RéRéaliser un film àà partir de chitosane commercial (1)(3)
ÉÉtape 2 : Extraire le chitosane des dédéchets de crevettes (2)
ÉÉtape 3 : RéRéaliser un film àà partir de extrait de chitosane
ÉÉtape 4 : Etude de la biodégradabilitébiodégradabilité (hors Fablab), de la capacitécapacité àà prépréserver une banane (hors Fablab) et de la solubilisation du film dans l'eau
Journal de bord
25/03/2024 : (R+L+S)
Objectif : prépréparer une solution pour former des films àà base de chitosane commercial en premier test pour avoir une idéidée de volume de solution àà utiliser pour avoir une éépaisseur de film satisfaisante ainsi que tester la façfaçon de les dédécoller.
- Protocole suivi pour la formation de 3 films avec chitosane commercial :
PréPréparer une solution acide dans unebébécher en verre de 250mL :
100mL eaudistillédistillée + 2 mL acide lactiqueprelevéprelevéàà la pipettegraduégraduée
masse d'eaupesépesée : 100,4154 g→→ l'acide lactique est un peu visqueux- Agitation
magnémagnétique de la solution pourhomogénéhomogénéiser (quelques minutes) - Ajouter 1g de chitosane commercial et laisser sous vive agitation pendant 1h
ààtempétempérature ambiante
masse de chitosanepesépesée : 1,0019g→→ la solution passe de troubleàà presque limpide et a une certaineviscositéviscosité PréPrélever 30 mL, 25 mL et 47 mL de solutionàà l'ééprouvettegraduégraduée et verser chacun de ces volumes dans des plats de cuisine en verreborosillicatéborosillicaté. Veilleràà ce que la solution recouvre toute la surface du moule.→→ Ayant un protocole pour 100mL de solution, nous avons choisi d'utiliser toute la solution pourprépréparer des films en testantdiffédifférents moules etdiffédifférenteséépaisseurs
 Figure 1. Moules de cuisine en verres
Figure 1. Moules de cuisine en verres utiliséutilisés pour couler les 3 solutions de film.
-
- Laisser
éévaporer 48hààtempétempérature ambiante sous la sorbonne.
- Laisser
25/03/2024 Hors Fablab (S) :
Objectif : récupérécupérer des dédéchets de crevettes et les faire sésécher avant de commencer l'extraction de la chitine
- Mode
opéopératoire suivi :-
DéDécortiquer 200g de crevettesentièentières cuites (penaeus vannamei) etrécupérécupérer lestêtêtes et les carcasses.- Effectuer 5 lavages avec de l'eau du robinet
filtréfiltréeààtempétempérature ambiante : immerger les carcasses dans unrérécipient etmémélanger pendant 1 min, vider l'eau et recommencer.→→ L'eau des premiers lavages esttrètrès rose et trouble et n'est quasiment pluscolorécolorée au bout du 5e lavage→→ Le nombre de lavages aétéétédéterminédéterminé en fonction de la couleur de l'eau de lavage - Rincer
àà l'eaudéminéralisédéminéralisée : placer les carcasses dans une passoire et verser de l'eaudéminéralisédéminéralisée defaçfaçonàà bien rincer.
- Egoutter et mettre
ààsésécher : placer sur une plaque de four et mettreààsésécher au four domestique dans les conditions suivantes :
- consigne du fourrégléréglée sur30°30°C,tempétempératureàà l'intéintérieur du fourcontrôlécontrôlée avec unthermomèthermomètre :25°25°C,durédurée : 4h
- consigne du fourrégléréglé sur40°40°C,tempétempératureàà l'intéintérieur du four :30°30°C,durédurée : 5hDuréDurée totale duséséchage : 9h→→ En milieu deséséchage, lestêtêtes ontétéétéémiétéémiétées pouraccéléaccélérer leséséchage
-
RéRésultat :-
- masse de caracasse
récupérérécupéréeaprèaprèsséséchage : 20g→→quantitéquantité insuffisante par rapportàà laquantitéquantitéestiméestimée pour obtenir au moins 1g de chitosane (environ 70g dedédéchets)
- masse de caracasse
-


Figure 2. Caracasses de crevettes aprèaprès séséchage
27/03/2024 (R) :
Objectifs : - prépréparer la solution de soude pour la 1è1ère éétape de l'extraction
- Broyer les dédéchets de crevettes
- DéDécoller les films en chitosane et relancer une autre prépréparation
- Mode
opéopératoire suivi pour laprépréparation de la solution de NaOH 2M :→→ Un ratio solvant solide de 1:6 estnénécessaire. En attendant la masse finale desdédéchets obtenus, nous avonspréparépréparé 250mL de solution de NaOH 2M (pour environ 40g dedédéchetsséchéséchésestiméestimés)- Peser 17,664 g de pastilles de NaOH dans un flacon de 250mL
- Peser 220,82 g d'eau
distillédistillée dans unbébécher - Ajouter l'eau dans le flacon, boucher et agiter
DéDémoulage des filmsréaliséréalisés le 25/03/2024 (chitosane commercial) :- 25 mL :
éépaisseur trop fine pour pouvoirdédécoller le film - 30 mL : pas assez
éépais donc cassant - 47 mL : bonne
éépaisseur mais difficile de ledédécoller→→prépréparation de nouvelles solutionsàà partir du chitosane commercial avec un peu plus de volume pourréréussirààdédécoller
- 25 mL :
- Mode
opéopératoire suivi pour laprépréparation d'une nouvelle solution de film avec le chitosane commercial :
mêmême protocole que celui du 25/03rérépartition de la solution dans les moules :
- test de tremper la banane dans la solution→→ééchec
- 30mL de solution dans le moule de taille moyenne (20 x 30cm)
- test de verser de la solution sur du papier cuisson→→ n'adhèadhère pas
- 20mL dans uneboîboîte depépétri en verre de 20cm dediamèdiamètre
- Broyage des
dédéchets de crevettes :àà partir d'un mixeur/broyeur de cuisine en plusieurs fois defaçfaçonàà obtenir la poudre la plus fine possible.
RéRésultat :- masse de poudre obtenue
aprèaprès broyage :
- masse de poudre obtenue
 Figure 3. Poudre de
Figure 3. Poudre de dédéchets de crevettes sèsèche aprèaprès broyage
27/03/2024 Hors Fablab (S) :
Objectif : RécupéRécupérer plus de dédéchets de crevettes pour l'extraction
- Mode
opéopératoire suivi :mêmême protocole que le 25/03/2024TempéTempérature :consignéconsignéerégléréglée sur40°40°C,tempétempératureàà l'intéintérieur du four :30°30°CDuréDurée deséséchage : 8h
RéRésultats :- masse de
dédéchets avantséséchage : 276g - masse
dédéchetsaprèaprèsséséchage : 59,104g→→mêmêmeespèespèce de crevettes mais plus gros calibre. La masserécupérérécupérée estsupésupérieureàà celleestiméestimée, nous avons donc besoin dereprérepréparer de la solution de NaOH 2M pour ladéprotédéprotéinisation
- masse de
28/03/2024 (L) :
Objectifs : - broyer la suite des dédéchets récupérérécupérés et séchéséchés de la veille
- reprérepréparer une solution de NaOH 2M pour la déprotédéprotéinisation pour en avoir suffisamment
- Broyage des carcasses de crevettes avec le mixeur de cuisine :
- Masse avant broyage : 59,104 g
- Masse
aprèaprès broyage : 58,836 g→→ masse totale dedédéchetsrécupérérécupérés :
- Mode
opéopératoire suivi pour laprépréparation de la solution de NaOH 2M pour 30 g de carcasses :- Peser 13,331 g de pastilles de NaOH
- Peser 164,90 g d'eau
distillédistillée - Additionner l'eau et la soude dans un
mêmêmebébécher - Conserver la solution dans un flacon
29/03/2024 (R+S) :
Objectifs : - 1ere éétape de l'extraction : déprotédéprotéinisation
- DéDémoulage des films préparépréparés le 27 mars
- Mode
opéopératoire suivi pour l'éétape dedéprotédéprotéinisation :- Additionner la
totalitétotalité de la poudre dedédéchets de crevettes et .....mL de solution de NaOH 2Mprelevéprelevésàà l'ééprouvettegraduégraduée (rapport solide solvant 1:6) dans unbébécher en verre de 250mL - Ajouter un barreau
aimantéaimanté et laisser sous agitation pendant 1 hàà30°30°C sur un agitateurmagnémagnétique chauffant→→mémélanger assezéépais et visqueux - Filtrer sur
frittéfritté→→ la pompe chauffe rapidement et la solution bouche lefrittéfritté et manque de temps : tout rassembler dans unbébécher recouvert de parafilm et choix d'une nouvelleméméthode pourrécupérécupérer le solide la prochaine fois

- Additionner la
Figure 4. Montage utiliséutilisé pour la filtration
RéRésultats dudédémoulage des films :- film dans la
boîboîte depépétri :difficultédifficultésààdédécoller, sedédéchire - film dans le plat de cuisine : bords un peu difficiles et bien
collécollés maisdédécollage du film quasi entierréréussi - mode
opéopératoire pourdédécoller le film : faire les contours du film avec un outil pointu puisàà l'aide d'une pince enmémétaldédécollerdédélicatement un bord, terminer de tirer le film hors du mouleàà la main est plus simple etééviter de la casser.
- film dans la
02/02/2024 : (R)
Objectifs : - fin de la déprotédéprotéinisation
- 2e éétape de l'extraction : déminédéminéralisation
- Mode
opéopératoire suivi pour la fin de l'éétape dedéprotédéprotéinisation :-
- filtration
àà l'aide d'unfiltréfiltré→→ééchec - Centrifuger les solutions
àà 3500 tr/min pendant 20 minutesàà25°25°C - Jeter le surnageant
RécupéRécupérer lerérésidu solide et le laveràà l'eaudistillédistillée jusqu'àà pH neutre, centrifuger entre chaque lavage, 10 lavagesréaliséréalisés, perte de produit
- filtration
-
- Mode
opéopératoire suivi pourprépréparer la solution d'HCl 1.5M - Mode
opéopératoire suivi pour l'éétape dedéminédéminéralisation : Ajouter tout le solide dans une solution de HCl 1.5M avec un ratio solide solvant de 1:12
03/04/2024 (S) :
Objectif : - Etape de dédécoloration
- RepréRepréparer une solution de formation de film avec le chitosane commercial pour tester la reproductibilitéreproductibilité
PréPréparation de la solution de NaOCl 5% : dilution de la solution par 2,5- Dans une
ééprouvettegraduégraduée de 25mL, verser25mL10mL de solution de NaOCl 14% etcomplécompléter jusqu'àà15mL25mL avec de l'eaudistillédistillée
- Dans une
RéRésultats de ladéminédéminéralisationaprèaprès une nuitàà l'éétuve :- masse obtenue : 2,1509g
→→ grosse perte de produit biensupésupérieureàà celle attendue....
- masse obtenue : 2,1509g
 Figure 5. Chitine obtenue
Figure 5. Chitine obtenue aprèaprès une nuit de séséchage àà l'éétuve
- Mode
opéopératoire suivi pour l'éétape dedédécoloration :MéMélanger latotalitétotalité de la poudre de chitine obtenue dans 25mL de solution de NaOCl 5% ( ratio solide : solvant de 1:10)- Agiter pendant 30 min
ààtempétempérature ambiante-
-
-
-
-
-
-
-
-

 Figure 6. Solution
Figure 6. Solution décolorédécoloréeaprèaprès 30min d'agitation
-
-
-
-
-
-
-
-
-
- Centrifuger la solution pour
récupérécupérer le solide : 10 000rpmààtempétempérature ambiante pendant 10 min - Laver
àà l'eaudistillédistillée pour retirer l'excèexcès de NaOCl puis recentrifuger pourrécupérécupérer le solide→→ la vitesse et ladurédurée de rotation de l'éétuve sontàà adapter defaçfaçonàà ce que le moins de solide possible reste dans le surnagent. Le retrait du surnagent se fait le plusdédélicatement possible et estterminéterminéàà la pipette pasteur en plastique defaçfaçonàà perdre le moins de produit. Le reste d'eau difficileààêêtreééliminer sans trop perdre de produit estévaporéévaporéàà l'éétuve. - Placer dans une
boîboîte depépétri en verre et mettreààsésécheràà l'éétuveàà85°85°C toute la nuit
RéRésultats : Ladédécoloration afonctionnéfonctionné- Mode
opéopératoire suivi pour la solution de formation du film :mêmême modeopéopératoire suivi que le 25/03/2024, solutioncoulécoulée dans 2boîboîtes depépétri en verre et un plat de cuisine
04/04/2024 (S) :
Objectifs : - prépréparation d'une solution de NaOH 60% pour l'éétape de déacédéacétylation
- Etape de déacédéacétylation de la chitine en chitosane
- CaractéCaractérisation IR de la chitine
- prépréparation de solutions de films avec le nouveau protocole qui utilise du glycéglycérol
- Mode
opéopératoire suivi pour laprépréparation d'une solution de NaOH 60% :- Peser 60g de pastilles de NaOH dans une fiole
jaugéjaugée de 100mL CompléCompléter au trait de jauge avec de l'eaudistillédistillée→→trètrès exothermique !!- Boucher et agiter
→→ perte de volume donc rajoutsréréguliers d'eaudistillédistillée jusqu'au trait de jauge puiséégalement juste avant l'utilisation de la solution
- Peser 60g de pastilles de NaOH dans une fiole
RéRésultats de l'éétape dedédécolorationaprèaprès une nuitàà l'éétuve :- La poudre est bien
décolorédécolorée
- La poudre est bien
 Figure 7. Chitine
Figure 7. Chitine décolorédécolorée aprèaprès une nuit àà l'éétuve
-
- masse obtenue : 1,5682g
→→ perte de masseattribuéattribuée au lavage par centrifugation et au transfert du tubeàà centrifuger dans laboîboîte depépétri
- masse obtenue : 1,5682g
- Mode
opéopératoire suivi pour l'éétape dedéacédéacétylation :- Dans un
bébécher, ajouter toute la chitine obtenue dans 15mL de solution de NaOH 60%prélevéprélevéeàà l'expéexpériencettegraduégraduée (ratio solide : solvant 1:10) - Agiter pendant 1 h
ààtempétempérature ambiante avec un agitateurmagnémagnétique
- Dans un


Figure 8. Solution de chitine dans NaOH 60% aprèaprès agitation
→→ La couleur de la solution est liéliée àà la forte concentration en NaOH et non àà l'ééchec de la dédécoloration.
-
- Centrifuger et laver le
mémélangeàà l'eaudistillédistillée jusqu'àà pH neutre : 10 000rpm pendant 10min
→→ manque de temps, seulement 2rinçrinçagesréaliséréalisés et pH encoretrètrès basique (14 avec papier pH)→→durédurées et vitesses de centrifugation variables pour optimiser au mieux le temps et laquantitéquantité de soliderécupérécupérable au fond du tube→→ Lesmêmêmespréprécautions que pour ladédécoloration sont prises pourééliminer le surnagent - Placer le solide obtenu dans une
boîboîte depépétri en verre et placer pendant une nuitàà l'éétuveàà85°85°C
- Centrifuger et laver le
- Mode
opéopératoire suivi pour laprépréparation de films avec le nouveau protocoleàà base deglycéglycérol :
Nous testons un autre protocole pour faire un filmàà partir de chitosane qui utilise duglycéglycérol pour voir si nous arrivons mieuxàà ledédécoller (3)- Dans une coupelle de
pesépesée, peser 2g de chitosane commercial - Dans un
bébécher en verre de 250mL : peser 0,6g deglycéglycérolprélevéprélevéàà la pipette pasteur en plastique→→trètrès visqueux - introduire dans le
bébécher 100mL d'eaudistillédistilléeprélevéprélevéeàà l'ééprouvettegraduégraduée - Ajouter dans le
bébécher 1mL d'acideacéacétique glacialàà la micropipette - Ajouter la poudre de chitosane commercial dans le
bébécher - Agiter pendant 1h
àà60°60°C→→ consigne de l'agitateurmagnémagnétique chauffantréglérégléeàà65°65°C et 380 rpm - Verser
20mL25mL dans une boîte desolution dans 2 boîtes de pépétri en verre de 16cm de diamètre, 25mL dans une boîte de pétri en verre de 15cm de diamètre et40mL50mL de solution dans le plat de cuisine en verre de 20 x 30cm
- Dans une coupelle de
- Manipulations concernant le
séséchage des films :
moule de solution de filmréaliséréalisé la veilleplacéplacé 2hàà l'éétuve pouraccéléaccélérer leséséchage CaractéCaractérisation IR-ATR de la chitine :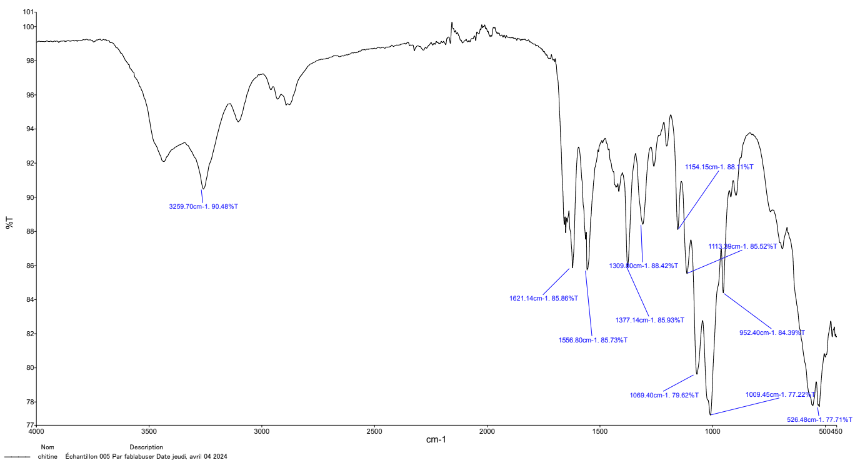 Nous
Nous repérepérons la bandecaractécaractéristique de de la chitine : l'éélongation CO amideàà 1621,54cm-1
05/04/2024 : (L+S)
Objectifs : - CaractéCaractérisation IR du produit obtenu aprèaprès déacédéacétylation
- DéDémoulage des films préparépréparés le 03 avril avec le 1er protocole (sans glycéglycérol)
RéRésultats de l'éétape dedéacédéacétylation :
- masse obtenue
aprèaprès une nuitàà l'éétuve : 0,43g
- masse obtenue
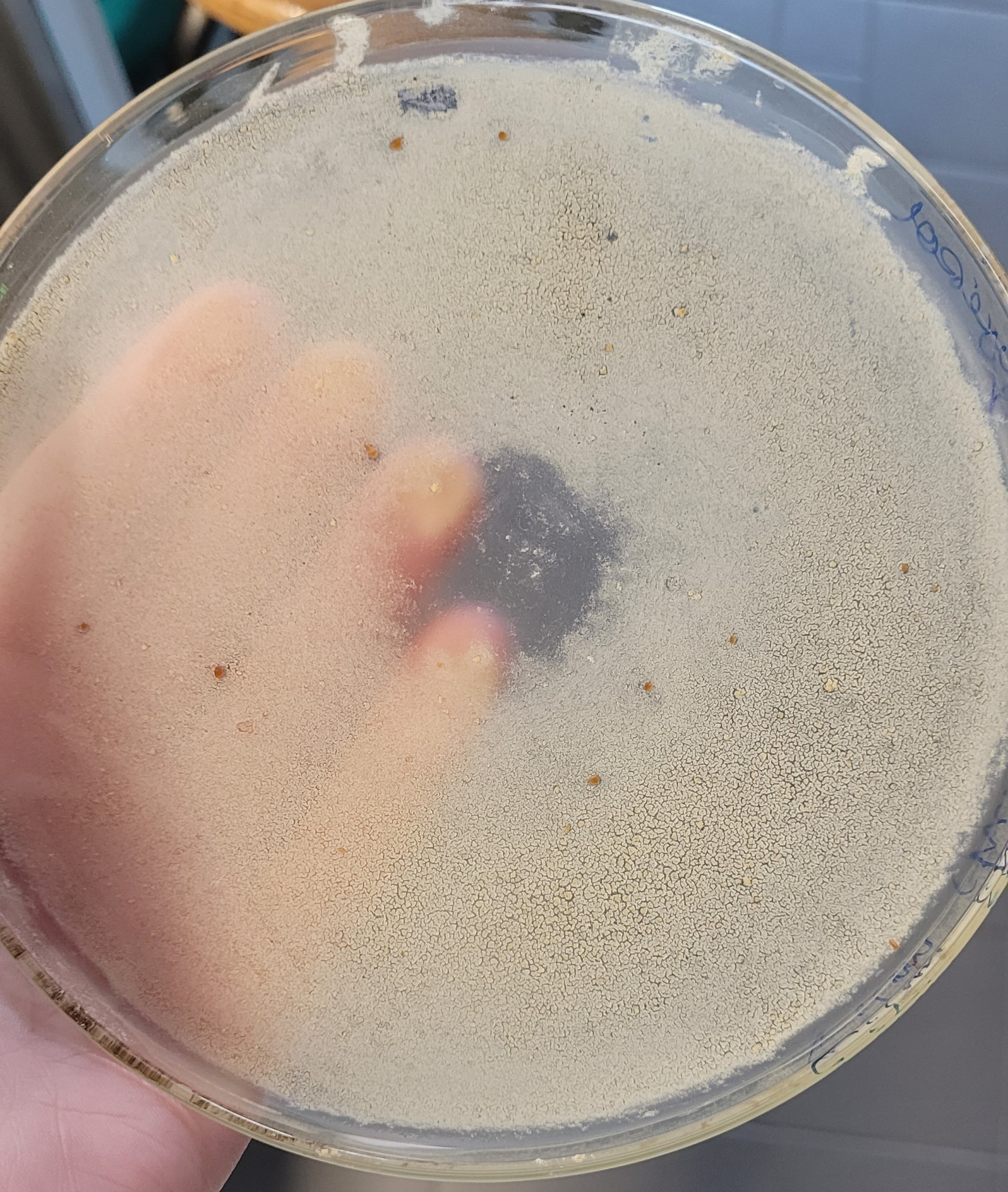
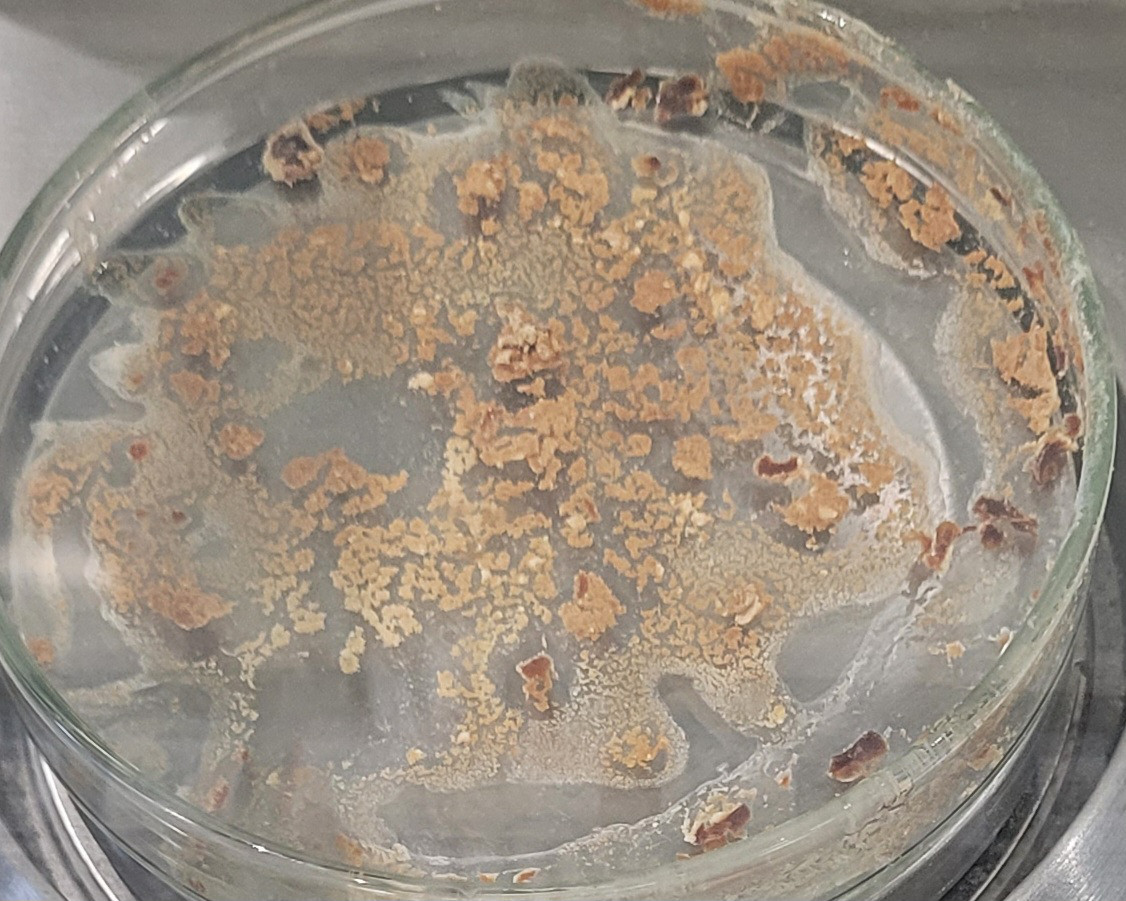 Figure 9. Chitosane obtenu
Figure 9. Chitosane obtenu aprèaprès une nuit àà l'éétuve →→ la couleur vient de la soude pas encore rincérincée
RéRésultats dedédémoulage des filmspréparépréparés le 3 avril (sansglycéglycérol) :- Film trop collant,
dédécollage difficile en lambeaux→→ Nous avonsnoténoté que la meilleurefaçfaçon de nettoyer les moules contenant du film que nous n'arrivions pasààdédécoller et de verser un peu d'eau dans le moule et de racler les parois avec un outil,dédécollant ainsi le film et le solubilisant ainsi dans l'eau. Cela nous a permis dedédémontrer une autrepropriétépropriété des biofilms en chitosane : leur solubilisation dans l'eau contrairement aux films enpolyéthylèpolyéthylène.
- Film trop collant,
CaractéCaractérisation IR ATR du produit obtenu :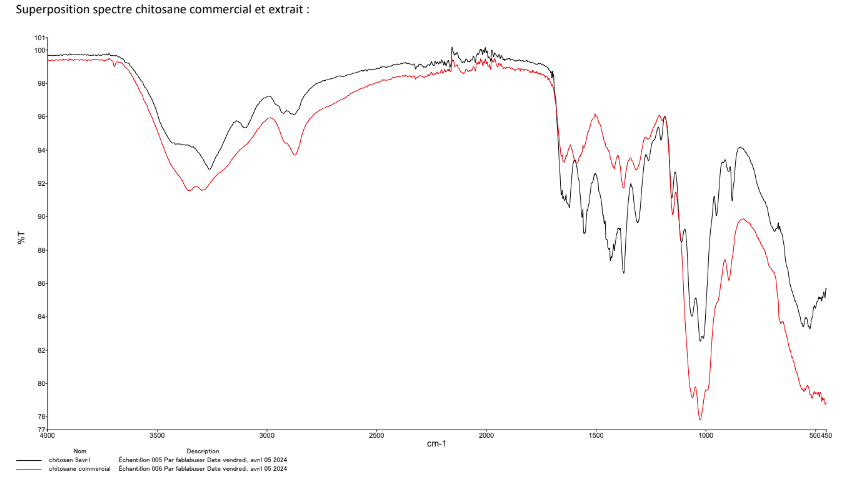
rouge : spectre IR-ATR du chitosane commercial
noir : spectre IR - ATR du chitosane extrait→→ on note une bonne superposition des 2 spectres qui confirme que le produit obtenu est bien du chitosane. La bande amideàà 1622cm-1 est plus intense sur l'extrait de chitosane que le commercial, il est donc moinsdéacétylédéacétylé. Nous notonséégalement lapréprésence de "bandessupplésupplémentaires" sur le chitosane extrait qui semble indiquer que celui-ci n'est pas parfaitement pur.
08/04/2024 : (L+S)
Objectifs : - DéDémoulage des films réaliséréalisés le 04 avril
- prépréparation de nouvelles solution de films avec et sans glycéglycérol avec 0.5g de chitosane commercial pour choisir le protocole et tester les meilleures conditions avant la réréalisation du film avec le chitosane extrait
- terminer les rinçrinçages du chitosane extrait pour ééviter que l'excèexcès de base neutralise l'acide lors de la formation du film
DéDémoulage des films : Les films englycéglycérol sedédécollent beaucoup plus facilement comme le montre levidévidéo : https://youtu.be/W0EesuDGnuk- Modes
opéopératoires suivis pour laprépréparation de films avec 0,5 g de chitosane commercial :- Avec
glycéglycérol :- Masse de chitosane : 0,5 g
- Masse de
glycéglycérol : 0,15 g - volume d'eau
distillédistillée : 25 mLprélevéprélevéàà l'ééprouvettegraduégraduée - Masse d'acide
acéacétique : 250μμLprélevéprélevéàà la micropipette - Verser dans un
bébécher muni d'un barreauaimantéaimanté, leglycéglycérol, l'eaudistillédistillée, l'acideacéacétique et le chitosane - Agiter pendant 45 min
àà 380 tr/min tout en chauffantàà60°60°C - Verser la solution dans la
boîboîte depépétri en verre d'environ 10cm dediamèdiamètre. Veilleràà ce que la solution recouvre toute la surface du moule. - Placer cette
boîboîteàà l'éétuve pendant 3hàà45°45°C
- Sans
glycéglycérol :- Masse de chitosane : 0,5 g
- Volume d'eau
distillédistillée : 50 mLprélevéprélevéàà l'ééprouvettegraduégraduée - Volume d'acide lactique : 1 mL (
prélevéprélevéàà la pipettegraduégraduée)→→ l'acide lactique est un peu visqueux - Verser dans un
bébécher muni d'un barreauaimantéaimanté, l'eaudistillédistillée et l'acide lactique - Agiter la solution pendant quelques minutes pour
homogénéhomogénéiser - Ajouter le chitosane commercial et laisser sous vive agitation pendant 1h
ààtempétempérature ambiante→→ la solution passe de troubleàà presque limpide et a une certaineviscositéviscosité - Verser la solution obtenue dans une
boîboîte depépétri en verre d'environ 10cm dediamèdiamètre . Veilleràà ce que la solution recouvre toute la surface du moule. - Placer cette
boîboîteàà l'éétuve pendant 3hàà45°45°C
- Avec
- Mode
opéopératoire suivi pour lerinçrinçage du chitosane extrait :- solubiliser la poudre de chitosane dans de l'eau
distillédistillée et l'introduire dans des tubes de centrifugeuse - 10 min
àà environ 10 000rpmààtempétempérature ambiante - Vider
dédélicatement le surnagent,contrôcontrôler le pH (papier pH) - 3
rinçrinçageseffectuéeffectuées : pH final : 8-9
- solubiliser la poudre de chitosane dans de l'eau
09/04/2024 : (L)
Objectifs : - dédécoller les films forméformés la veille et choisir le protocole àà suivre
- prépréparer une solution de formation de film àà partir du chitosane extrait
DéDécollement desdiffédifférents films :- Le film avec le
glycéglycérol sedédécolle plus facilement que celui sansglycéglycérol. On choisit donc deréréaliser le filmàà partir de notre chitosane avec le protocole comportant duglycéglycérol
- Le film avec le
- Formation du film
àà partir de notre chitosane :- Masse de chitosane : 0,43 g
- Masse de
glycéglycérol : 0,129 g - Masse d'eau
distillédistillée : 21,5 g - Masse d'acide
acéacétique : 215μμLprélevéprélevésàà la micropipette - Verser dans un
bébécher muni d'un barreauaimantéaimanté, leglycéglycérol, l'eaudistillédistillée, l'acideacéacétique et le chitosane - Agiter pendant 45 min
àà 380 tr/min tout en chauffantàà60°60°C - Verser la solution dans la
boîboîte depépétri - Placer cette
boîboîteàà l'éétuve pendant 3hàà45°45°C
10/04/2024 : (L+S)
Objectif : - Voir si un film est obtenu avec le chitosane extrait
- Le solvant s'est
évaporéévaporé et le chitosane areprécipitéreprécipité→→ pas de film obtenu
Figure 10. Chitosane qui a reprécipitéreprécipité dans la boîboîte de pépétri sans former de film
-
prépréparation d'une solution enréréutilisant l'intégralitéintégralité du solidereprécipitéreprécipité en laissant agiter 1h de plus et en ajoutant plus d'acide (15 gouttessupplésupplémentaires) pour favoriser la solubilisation : meilleur aspect de la solution qui restetrètrèsdiffédifférent de celle avec le chitosane commercial maismémélange quasicomplècomplètementhomogèhomogène. Nousdédécidons aussi de ne pas placer la solutionàà l'éétuve au casoùoù celle ci auraitétéété tropévaporéévaporée.
12/04/2024 : (S)
Objectif : voir les modifications de protocole ont permis d'obtenir un film avec le chitosane extrait
Figure 11. Chitosane qui a reprécitéreprécité sans former de film
→→ éétude de la biodégradabilitébiodégradabilité et de la capacitécapacité àà prépréserver une banane àà partir des ééchantillons de films àà base de chitosane commercial
Conclusion :
- rendement de l'extraction : masse de poudre de
dédépart/masse de chitosane obtenue = ......../0.43 = .....%→→ rendement - Nous avons pu montrer qu'il est possible de faire des films alimentaires
àà partir de chitosane commercial et que le protocole qui utilise duglycéglycérol est celui qui nous a permis d'obtenir les meilleursrérésultats. - Nous avons aussi
réréussiàà extraire la chitine desdédéchets de crevettes etàà ladéacédéacétyler partiellement en chitosane. Cependant, il serait utile de recommencer l'extraction en utilisant une autre technique que la centrifugation pour lesrinçrinçages et partir d'une masse dedédéchets beaucoup plus importante pour que l'impact des pertes de masses lors desrinçrinçages soitnénégligable. De plus, l'éétape dedéacédéacétylation est la plus cruciale et sensible aux conditionsexpéexpérimentales. Il s'agit de l'éétape la moinsdétaillédétaillée des publications que nous avonstrouvétrouvées. Il pourraitêêtre pertinent de tester de nouvelles conditions dedéacédéacétylation en jouant sur la concentration en NaOH et/ou latempétempérature dans le but de mieuxdéacétylédéacétylé le chitosane obtenu etréréussiràà former un film.
RéféRéférences :
CazóCazón, P., Morales-SáSánchez, E.,VeláVelázquez, G., &VáVázquez, M. (2022).
Measurement of the water vapor permeability of chitosan films: a laboratory experiment on food
packaging materials. Journal of Chemical Education, 99(6),2403–2403–2408.
https://doi.org/10.1021/acs.jchemed.2c00449- Aldila, H., Asmar, Fabiani, V. A., Dalimunthe, D. Y., & Irwanto, R. (2020). The effect of
deproteinization temperature and NaOH concentration on deacetylation step in optimizing extraction
of chitosan from shrimp shells waste. IOP Conference Series, 599(1), 012003.
https://doi.org/10.1088/1755-1315/599/1/012003 -
Siripatrawan, U., Vitchayakitti, W. (2016). Improving functional properties of chitosan films as active food packaging by incorporating with propolis, Food
Hydrocolloids 61 (695-702) https://doi.org/10.1016/j.foodhyd.2016.06.001