Pockmarks - Adele GIOBBINI et Audrey ROUCHON
Projet de Matéo Francoise, par Adele Giobbini et Audrey Rouchon.
26/01/2024 :
Les pockmarks sont des cratères (dépressions) situées sur le fond marin, pouvant atteindre 350m de diamètre, 35m de profondeur et une densité de 160/km2 (Belfast Bay, Maine). Ils sont formés par l’échappement de fluides/ gaz naturel biogénique vers la surface, créant ainsi des cratères.
Matériel :
- cristallisoir (le plus gros)
- bicarbonate de sodium NaHCO3
- acide (citrique ? À commander ?) C6H8O7
- sable (pour sédiment effervescent)
- sable (+ argile) (pour fond marin)
- eau
Protocole :
Pour un kilogramme de sable effervescent :
- Dans un récipient, on mélange 100g d’acide citrique, 50g de bicarbonate de sodium et 850g de sable.
Pour le sable « fond marin »:
Nous allons tester différentes méthodes :
- du sable seul (de différentes granulométries)
- du sable fin avec de l’argile (nous testerons plusieurs proportions)
Problème : si le fond du cristallisoir est tapissé de sable effervescent, le gaz risque de s’échapper vers les bords du cristallisoir et ne formera pas de pockmarks. Pour remédier à cela, nous laisserons une bande de sable non effervescent tout autour du sable effervescent, pour contrer cet effet. Nous testerons plusieurs largeurs de bande.
Dans le cristallisoir, mettre 1 cm de sable effervescent (85% de sédiment, ici, le sable; 10% d’acide citrique et 5% de bicarbonate de soude) : en effet, la masse molaire de l’acide citrique est de 176,12 g/mol, et celle du bicarbonate de sodium est de 84 g/mol. On a donc presque un facteur de 1 à 2 (84 / 176,12 = 0,48), donc il faut presque deux fois plus de masse d’acide citrique que de bicarbonate de sodium pour respecter les coefficients molaires de la réaction acido-basique.
- NaHCO3 + R-COOH CO2 + H2O + RCOO− + Na+
On observe donc une libération de CO2, qui permet de reconstituer la libération de gaz, nécessaire à la formation des PockMarks.
Puis, mettre 3 cm de sable fin (pour reconstituer le fond marin).
Enfin, recouvrir d’eau.
Problème : pour filmer, toujours à la même hauteur et au même angle, il nous faut un trépied.
02/02/2024 :
Informations :
Giant sea-bed pockmarks: Evidence for gas escape from Belfast Bay, Maine: https://pubs.geoscienceworld.org/gsa/geology/article-abstract/22/1/59/205977/Giant-sea-bed-pockmarks-Evidence-for-gas-escape
https://fr.wikipedia.org/wiki/Pockmark
 https://www.sciencedirect.com/topics/earth-and-planetary-sciences/pockmark
https://www.sciencedirect.com/topics/earth-and-planetary-sciences/pockmark
A la place du bicarbonate de sodium, nous utilisons du carbonate de potassium (K2CO3). Cela change donc nos calculs car la masse molaire n’est pas la même :
Masse molaire du carbonate de potassium : 138 g/mol
Masse molaire de l’acide citrique : 176 g/mol
Donc on environ un facteur de 0,8 : nous avons donc mis 1 gramme d’acide citrique pour 0,8 gramme de carbonate de potassium pour respecter le coefficient stœchiométrique.
- Protocole :
Pour cette première expérience, nous avons utilisé :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- microbalance
- papier pH
- aluminium
- sable
Premièrement, nous avons faire une première expérience pour tester si l’effervescent fonctionnait. Nous avons mélangé 8 grammes de carbonate de potassium et 10 grammes d’acide citrique. La réaction a fonctionné 👍(ça fé dé bulles). Nous avons vérifié si tout l’acide avait été neutralisé, grâce au papier pH : affirmatif (pH de 6).
Puis, nous avons testé une première expérience, en mettant une couche de sable effervescent (un volume de mélange effervescent (acide citrique + carbonate de potassium) pour deux volumes de sable fin sec), puis une couche de sable fin sans mélange effervescent, que nous avons enfin recouvert d’eau :
(j'imaginais un truc comme ça pour les images, je vous laisse modifier) Mélange effervescent + sable.
Couche de sable effervescent + grosse couche de sable fin.
Bubulle.
Nous avons pu voir du positif :
- nous avons mis de l’effervescent sur tout le fond du cristallisoir et l’air ne s’est pas échappé sur les cotés
- L’air s’est bien échappé et est remonté à travers les sédiments
- à la fin de l’expérience, nous avons testé le pH : l’acide a bien été neutralisé car le pH était de 6. Cela signifie une que le sable, une fois séché, pourra être réutilisé pour cette expérience.
Nous avons rencontrer certains problèmes :
- comment verser l’eau ?
- comment faire pour que l’eau ne soit pas trouble ?
- Sûrement trop de mélange effervescent
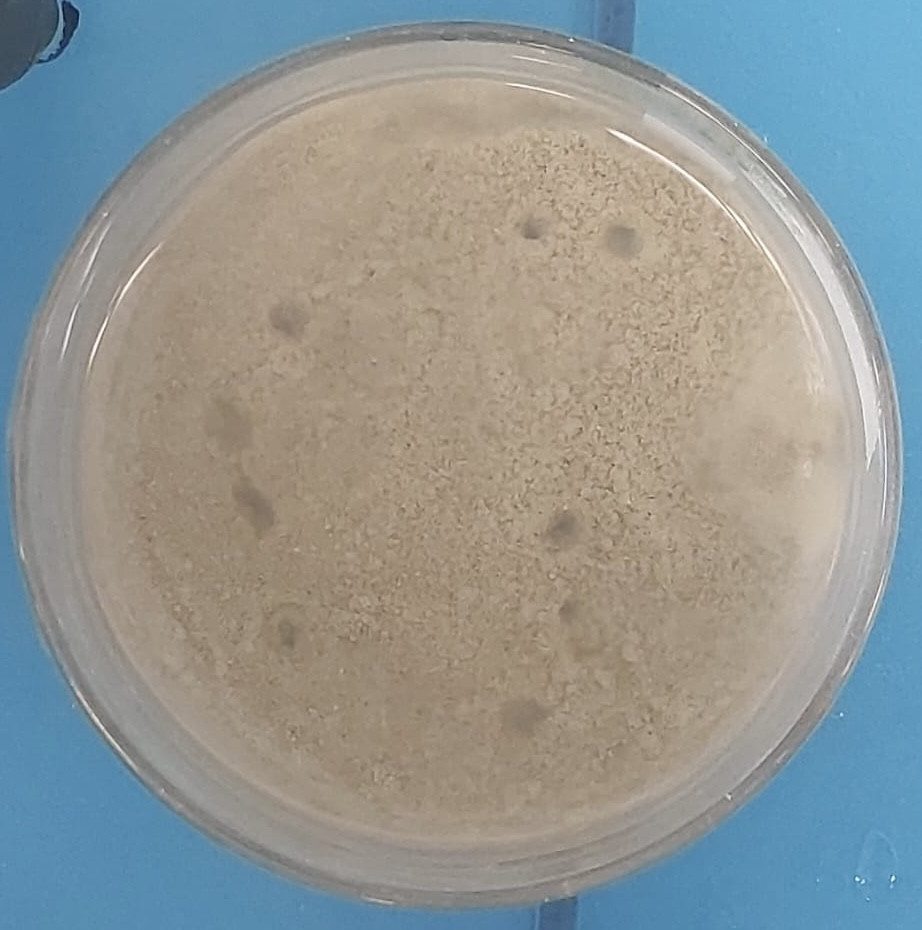
- pas vraiment de formation de pockmarks (certains petits « cratères »)
Remontée d’une bulle.
Vers la fin de la réaction effervescente, nous pouvons observer des marques à la surface du sédiment.
9/02/2024 :
Le sable que nous avions laissé à sécher la semaine dernière est devenu un sable « kinétique » : les grains étaient assez cohésifs.
Nous avons donc essayé avec ce sable là, car un problème que nous avions pu rencontrer avec le sable fin était que celui ci s’affaissait tout de suite sans laisser de cratère visible.
Dans cette deuxième expérience, nous avons utilisé :
- béchers
- bécher avec du scotch (pour verser l’eau)
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable kinétique (recyclé de la semaine précédente)
Cette fois ci, nous avons mis moins d’effervescent car nous avions vu la semaine dernière que ça bullait trop. Nous avons mis 5g d’acide citrique et 4g de carbonate de potassium.
Nous avons mis du sable kinétique, dans l’espoir de pallier à l’effet d’effondrement.
Pour les problèmes de versement d’eau, nous avons essayé de fabriquer un arrosoir avec un bécher et du scotch.
Update : fail.
Nous avons réessayé avec des plus gros trous, et c’est le prototype que nous avons utilisé pour l’expérience 2.
Update : le versement était trop puissant et à remanié le sédiment: gros fail.
Les résultats, autrement, étaient sensiblement similaires aux expériences de la semaine. L’effervescence était toujours trop forte et le sable ne gardait toujours pas les cratères. 
Pour cette troisième expérience, cette fois-ci avec du sable « normal » (non kinétique) qui avait été humidifié puis séché, mais qui était encore un peu humide ce qui fait qu’il était plus dense (on s’est dit que les cratères allaient peut être être plus visibles, mais surtout c’était plus pratique pour mieux répartir le mélange effervescent).
Nous avons mis encore moins d’effervescent : 1g d’acide citrique et 0,8g de carbonate de potassium.
Protocole :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable légèrement humide
Nous avons fait comme précédemment : nous avons mélangé le mélange effervescent avec du sable pour la partie inférieure puis nous avons recouvert d’une bonne couche de sable. Nous avons essayé une autre technique pour verser l’eau : juste le bréchet, sans scotch, mais très rapidement. Cela a un peu remanié les sédiments supérieurs, ils se sont redéposés ensuite de façon non uniforme : fail.
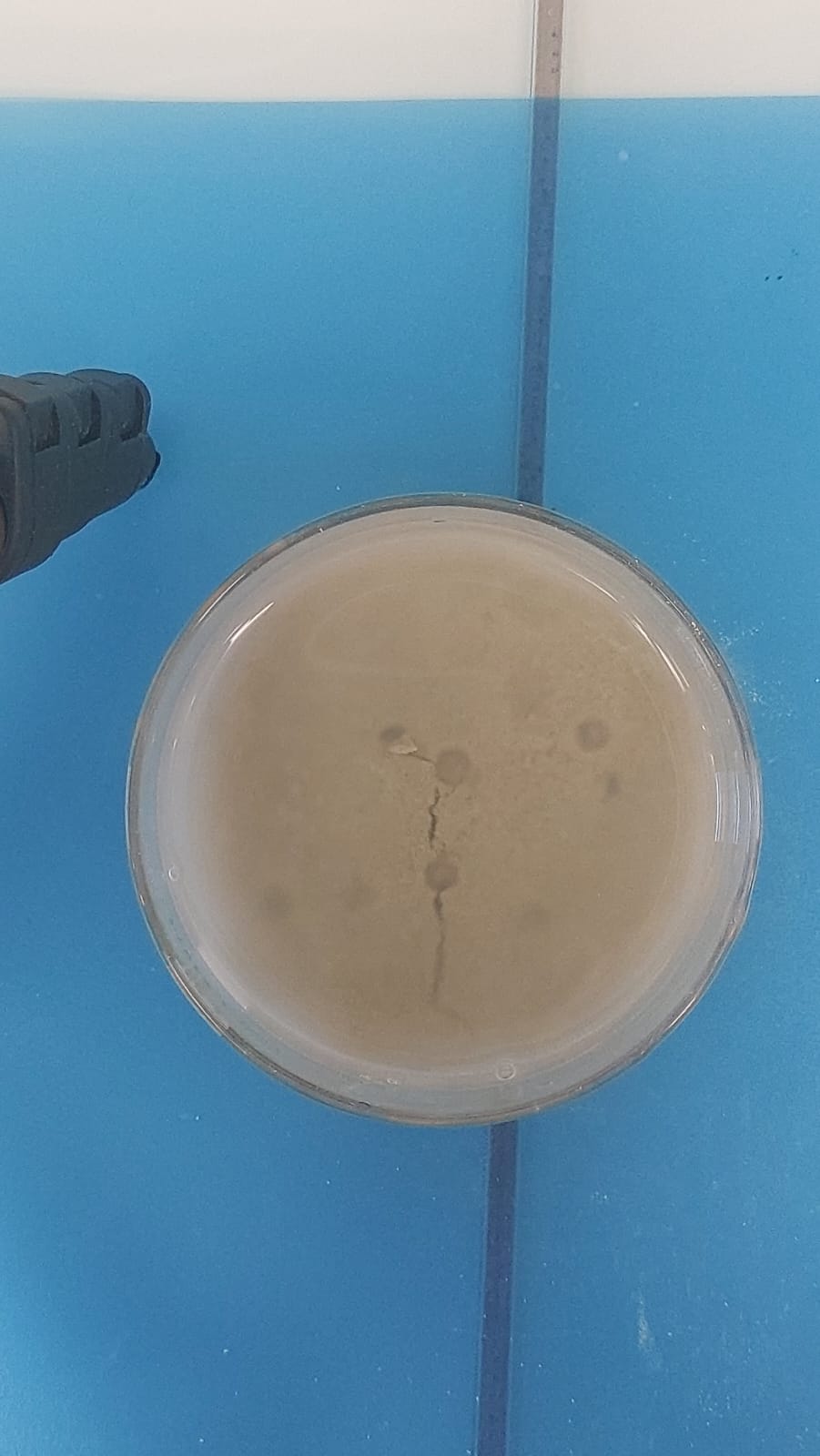
Comme précédemment, le sable ne tenait pas : les cratères ne se formaient pas. La forme que nous pouvons observer est due au versement de l’eau. Par contre, la dose d’effervescent était correcte : un peu de bulles bien comme il faut (peut etre meme pas assez mais mieux vaut parfois). En effet, l’eau en surface était donc moins trouble et nous voyons mieux ce qu’ils e passait).
Nous avons essayé une autre fois de créer un arrosoir : ça ne coulait pas super bien mais bon ça va. Par contre…
Cassé.
Nous avons donc abandonné l’idée arrosoir pour trouver des alternatives. Nous avons essayé avec une seringue et cela semble fonctionner plutôt bien.
Pour cette quatrième expérience, nous avons cherché à trouver une alternative au sable uniquement : nous avons mélangé donc 1/3 d’argile (42g) avec 2/3 de sable (84g). Nous avons aussi mis le mélange effervescent juste au centre.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable légèrement humide
- argile verte (illite)
- seringue
Nous avons comme précédemment mis une couche de sable (ici mélangé à de l’argile) avec du mélange effervescent, puis une couche de sable- argile.
Cette fois ci, sûrement à cause du fait que nous avions mis l’effervescent majoritairement au centre, ce qui a créé un maxi cratère/ volcan !
Et pouf plus de dinos.
CRATEEEEEEEEERE !!!!!!!!!
L’argile permet de garder la forme du cratère, et l’eau pénètre tout de même. C’est peut être un peu trop impressionnant pour un pockmark.
PB :
- il faut changer la dose de notre mélange effervescent car pas la bonne masse molaire
- Il faut trouver comment recycler le sable-argile
- notre modèle ne représente pas super bien la réalité car en réalité, les pockmarks sont plutôt des dépressions liées à l’affaissement du sédiment (car la glace fond et laisse un trou), et non pas des cratères.
- Il est difficile de mesurer le pH dans notre dernière expérience, l’eau de surface étant verte car mélangée à l’illite, le papier pH devient vert (il faudrait attendre plusieurs heure que l’argile sédimente: flemme).
16/02/2024:
Nous avons recalculé notre équation pour le mélange car nous avons changé de carbonate sans revérifier l’équation. Nous nous sommes rendu compte que les coefficients stœchiométriques avaient changé et qu’il fallait 3 moles de carbonate de potassium pour 2 moles d’acide citrique. Il faut donc mettre 0,96g d’acide pour 1g de carbonate, plutôt que 1g d’acide pour 0,8g de carbonate comme nous faisions précédemment.
3 K2CO3 + 2 C6H8O7 <-> 2 C6H5K3O7 + 3 H2O + 3 CO2
La masse molaire du carbonate de potassium est de 138,2 g/moles et celle de l’acide citrique est de de 192,1. Pour refaire l’équation en respectant les coefficients, il faut donc 414,6 grammes de carbonates et 384,2 d’acide, soit 1g de carbonate et 0,96 d’acide pour environ 2 grammes d’effervescent. Nous avons calculé pour 2 grammes d’effervescents car nous avons vu dans les expériences précédentes que c’était la quantité la plus adapté pour le moment.
Nous avons aussi lavé l’argile-sable de la semaine précédente, et comme le sable est plus gros et sédimente plus vite, nous avons pu faire un tri granulométrique à l’eau (malheureusement, nous n’avons pas pu conserver tout l’argile, uniquement l’argile de surface).
Pour cette cinquième expérience, nous allons donc utiliser ces nouvelles quantité pour le mélange effervescent, et garder la meme proportion d’argile- sable (1/3 et 2/3). Nous allons cependant mettre du mélange effervescent partout sur le fond (et non pas que au centre).
Protocole :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable légèrement humide
- argile verte (illite)
- seringue
Nous avons utilisé 50g d’argile pour 100g de sable humide de la semaine précédente.
Mélange sable-argile : l’argile n’a pas été broyée assez finement, nous avons tout de même essayé comme car : mais le relief en lien avec la réaction a été quelque peu caché par ces gros cailloux de surface.
La façon dont j’ai versé l’eau a aussi laissé une trace en surface : cette expérience était un peu un fail.
Il n’y a cette fois ci sûrement pas assez d’effervescent ou trop de sédiments : même si nous avons mis du mélange effervescent partout sur le fond, nous n’avons overseer de cratère qu’au centre (2 cratères).
Nous avons utilisé un autre papier pH, qui, avec notre nouvelle équation, nous permet d’obtenir une réaction à pH 7 !
A gauche, pH de l’acide citrique. Au centre, pH de l’expérience 5 (à la fin de l’expérience). A droite, pH du carbonate de potassium.
Pour régler le problème de l’argile, nous l’avons tamisée et nous avons re-broyé les gros cailloux. Nous avons aussi mélangé le reste d’argile de la semaine précédente à notre poudre d’argile (recyclage ou quoi).
Pour cette sixième expérience, nous avons doublé les doses de mélange effervescent (2g de carbonate de potassium et 1,92g d’acide citrique).
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable légèrement humide
- sable sec
- argile verte (illite)
- seringue
Pour la partie inférieure, nous avons mélangé le mélange effervescent avec 25g de sable humide. Puis, nous avons mis 75g de sable sec et 50g d’argile pour la partie supérieure. Le problème était que sans l’argile, le sable humide a déjà réagit avec le mélange effervescent (car avant l’argile absorbait l’humidité).
Nous avons pu observer un seul cratère se former : cela est du peut être au fait que nous n’avions pas mis d’argile dans la couche inférieure et que donc une couche « de gaz » s’est formée entre nos deux couches.
Il serait peut être utile de broyer notre mélange effervescent : nous nous sommes rendu compte que toutes les billes de carbonate de potassium n’étaient pas en contact avec toutes les billes d’acide citrique, et que donc a la fin de notre réaction, lorsque nous mélangions, la réaction recommençait.
Pour cette septième expérience, nous avons utilisé uniquement du sable sec pour contrer l’effet de l’effervescent qui commençait avant avec le sable humide. Nous avons aussi mis de l’argile partout pout homogénéiser les deux couches et pas qu’une couche de gaz se forme entre les deux.
Nous avons utilisé:
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable sec
- argile verte (illite)
- seringue
Nous avons mis 100g de sable sec et 50g d’argile. Nous en avons versé une petite partie pour faire le fond (avec des l’effervescent mélangé) puis le reste par dessus. L’effervescent était de 2g-1,92g.
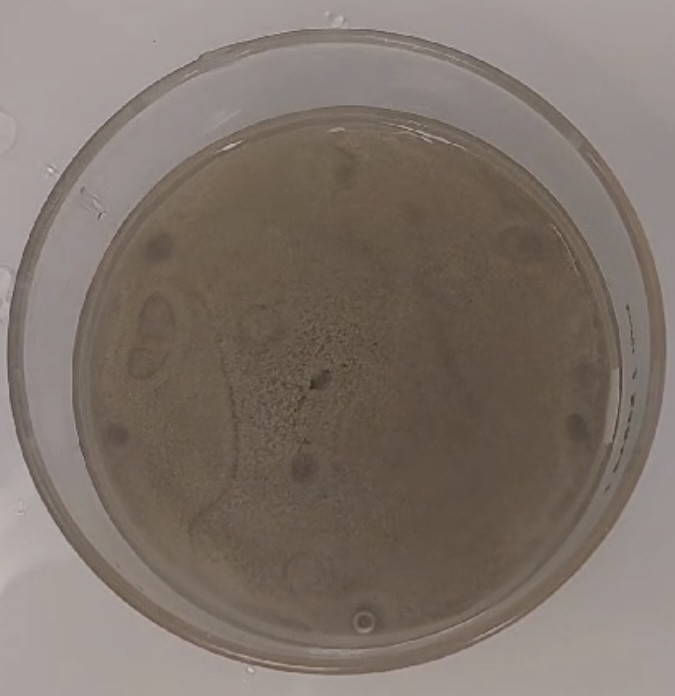
CRATÈRES !
CRATÈRES !
Nous avons toujours ce problème de gaz qui reste coincé, mais tout de même un peu moins.
Pour cette huitième expérience, nous avons essayé de faire un réplicat de l’expérience précédente : même quantité de mélange effervescent (broyé au mortier), même quantité d’argile-sable, nous avons versé l’eau de la même façon.
Nous avons utilisé:
- béchers
- cristallisoir
- acide citrique (1,92g)
- carbonate de potassium (2g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable sec (100g)
- argile verte (illite) (50g)
- seringue
Problèmes : L’eau a eu du mal a descendre jusqu’au mélange effervescent et nous avons eu pas mal de gaz coincé : peut être utiliser moins d’argile la prochaine fois car cela fait une couche trop étanche, à la fois pour l’eau et pour le gaz.
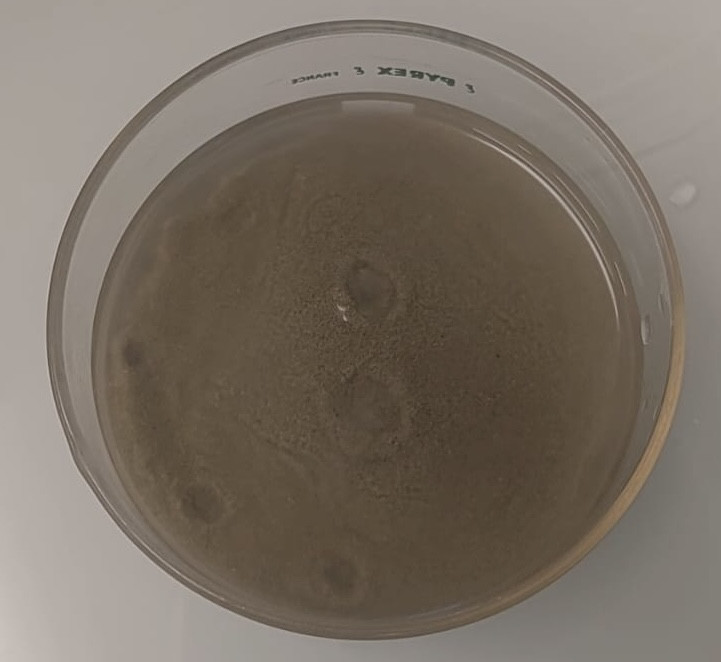
Nous avons tout de même eu quelques cratères au début, qui se sont vite transformés en un seul gros cratère à cause du gaz coincé.
Oh tiens gros cratère.
01/03/2024 :
Nous avons réussi à récupérer le sable d’il y a 3 semaines (sable mélangé avec de l’argile avec l’argile qui a pu être extraite lors de la séance précédente): 
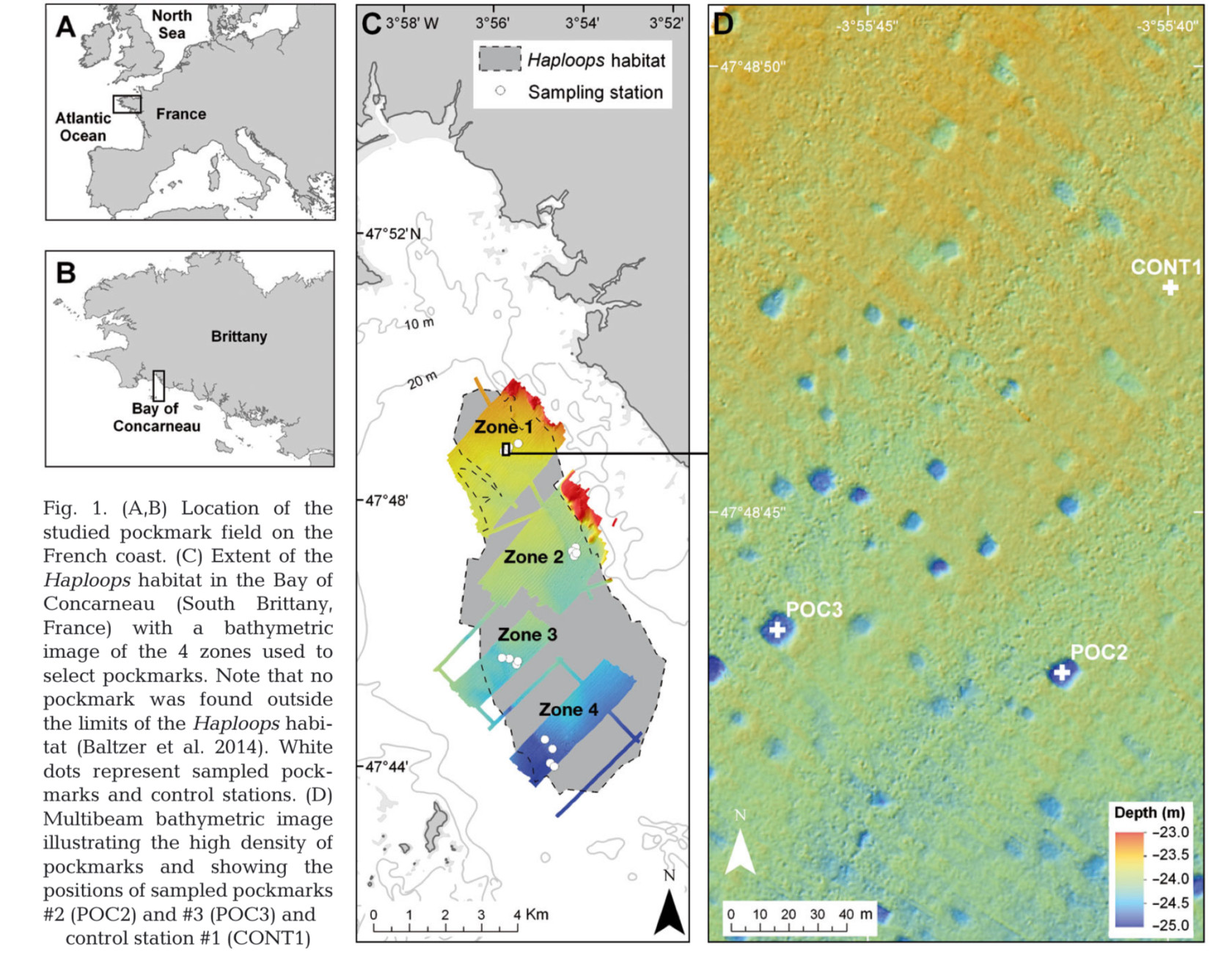
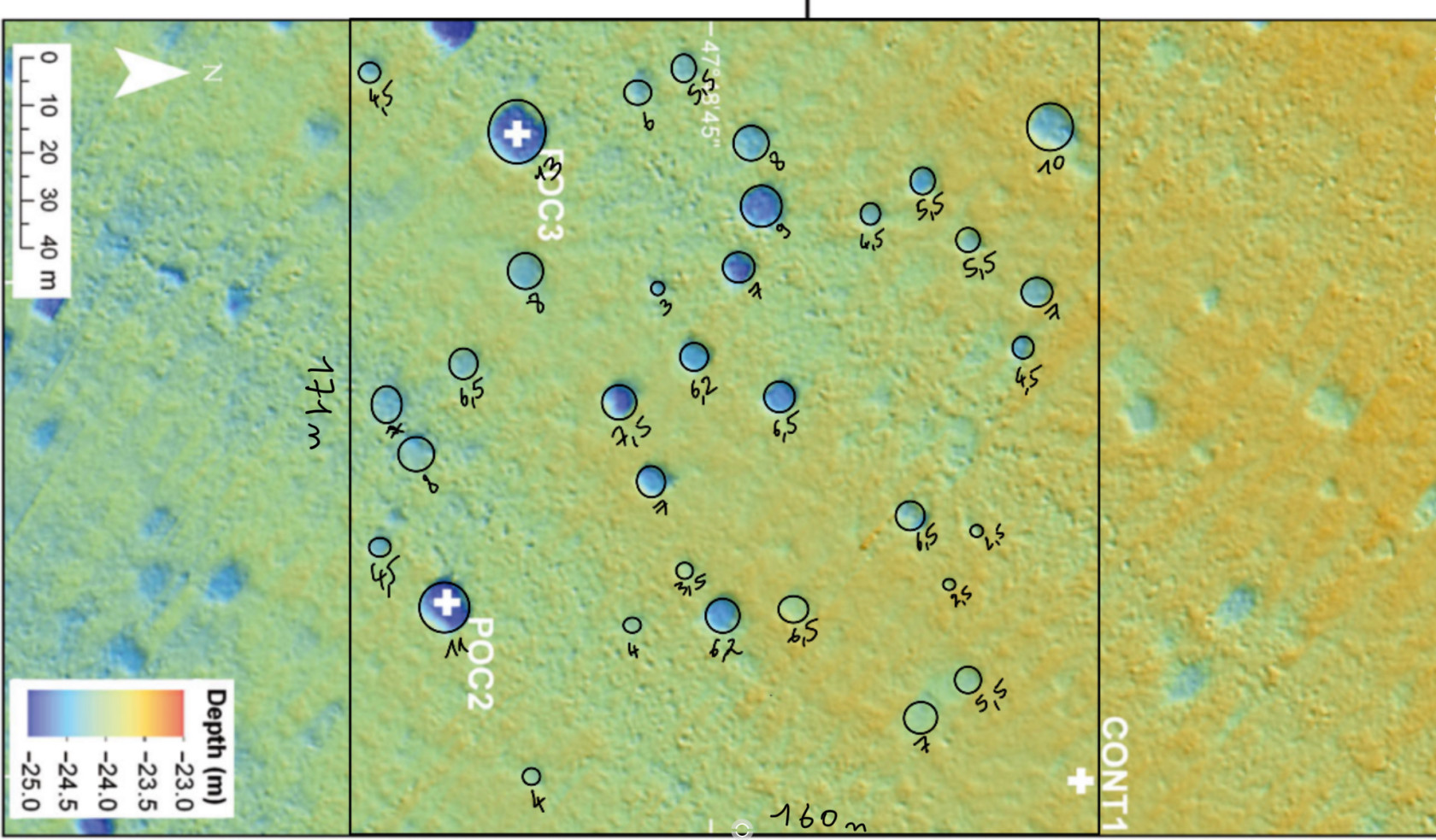
Voici une comparaison entre nos pockmarks et les pockmarks trouvés dans la nature :
Pockmarks de « Role of pockmarks in diversity and species assemblages of coastal macrobenthic communities » - Dubois et al. (2015).
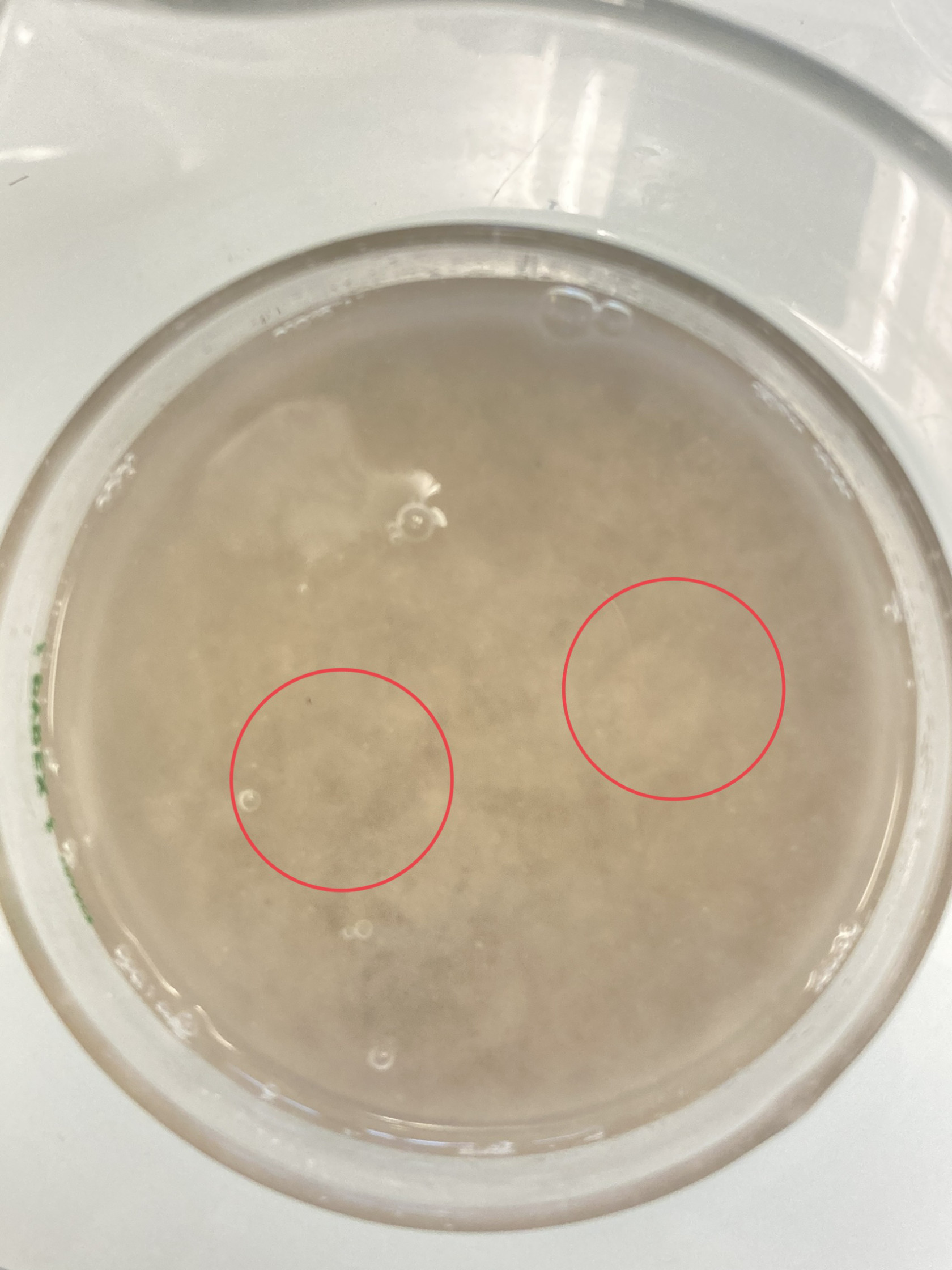
Photo des pockmarks que nous avons obtenus en laboratoire (expérience sept).
En arrivant au labo, nous avons mis a chauffer le mélange sable-argile de la séance précédente, pour essayer de récupérer l’argile sèche d’un coté, et le sable de l’autre.
Puis, nous avons re-broyé de l’argile.
Expérience : Pour cette neuvième expérience, nous avons utilisé 2g carbonate de potassium et 1,92 d’acide citrique.
Nous broyons aussi ce mélange effervescent pour l’homogénéiser (éviter que certains grains de carbonate de potassium et d’acide citrique ne se touchent pas).
Nous allons aussi essayer de mettre moins d’argile pour contrer la couche de gaz qui se forme : 25g d’argile pour 100g de sable.
Nous allons donc faire :
- une couche sable-argile-mélange effervescent broyé
- une couche sable-argile
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (1,92g)
- carbonate de potassium (2g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable sec (100g)
- argile verte (illite) (25g)
- seringue
Nous avons donc fait mis ces deux couches dans un cristallisoir et nous avons versé l’eau avec la seringue.
Résultats : Les résultats n’étaient pas phénoménaux : nous n’avions pas assez d’argile pour que les pockmarks tiennent.
Problème : plus assez d’argile. Les bulles n’étaient pas très fortes.
La réaction a été neutralisée.
Expérience : Pour cette dixième expérience, nous avons diminué de 25% les quantités de sédiment :
100g de sable -> 75g
50g de sable -> 37,5g
Nous avons utilisé 2g de carbonate de potassium et 1,92g d’acide citrique.
Nous avons fait une couche sable-argile-effervescent et une autre couche plus épaisse sable-argile.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (1,92g)
- carbonate de potassium (2g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable sec (75g)
- argile verte (illite) (37,5g)
- seringue
Résultats : La quantité de sédiment nous semble plutôt correcte, le gaz restait moins coincé (il avait moins de trajet à remonter).
Problème : notre méthode pour verser l’eau fait arriver l’eau d’abord sur les cotés. C’est donc là que se sont formés les pockmarks (qui se sont donc formés plus vite car ils avaient moins de sédiment à remonter). L’eau ne descends pas jusqu’en bas.
Il faut donc qu’on trouve un moyen pour que l’eau soit uniformément repartie.
La réaction a été neutralisée.
Expérience : Pour cette onzième expérience, nous avons mis 75g de sable et 37,5g d’argile. Nous avons mis cependant le double de l’effervescent. Nous avons aussi essayé de mieux verser l’eau avec la seringue.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable sec (75g)
- argile verte (illite) (37,5g)
- seringue
Résultats : Nous avons réussi à obtenir de super pockmarks. Problème : L’eau ne s’est pas uniformément réparti (elle a atteint seulement le centre).
La réaction à bien été neutralisée (papier pH à 7).
Nous allons essayer de la refaire la semaine prochaine.
Nous avons aussi recyclé notre argile-sable. La mixture de la séance précédente que nous avions mis à sécher au « four » n’a pas vraiment bien séché : nous l’avons remélangé à notre mélange sable-argile de aujourd’hui.
08/03/2024 :
En arrivant au FabLab de Géosciences, nous avons vu que l’argile et le sable que nous avions laissé sécher une semaine n’ont pas bien séché : nous avons mis à sécher au dessiccateur l’argile (pendant 2h à 75°C).
Aujourd’hui, nous allons essayer de refaire l’expérience 11.
Expérience : Pour cette douzième expérience, nous avons mis 75g de sable et 37,5g d’argile, avec un mélange effervescent à 4g de carbonate de potassium et 3,84g d’acide citrique. Nous avons utilisé une plus grande seringue (de 60mL). Nous avons aussi récupéré un trépied et une règle pour filmer et faire les mesures.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable séché recyclé de la semaine précédente (75g)
- argile verte (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
Nous avons broyé le mélange effervescent. Nous avons mis une couche de sédiment très fine (pour homogénéiser) puis une couche de sédiment mélangé avec du mélange effervescent, puis une couche de sédiment sans effervescent à nouveau et enfin de l’eau (autant d’eau que de sédiment).
Résultats :
Sable qui commence à être mouillé par l’eau : les pockmarks commencent à apparaître.
Les pockmarks de l’expérience douze après avoir enlevé l’eau.
Problème : L’eau a eu du mal à atteindre le sédiment car nous l’avions un peu tassé (pour mimer le poids de l’eau mais fail un peu).
Nous avons mesuré le pH : la réaction a été neutralisée.
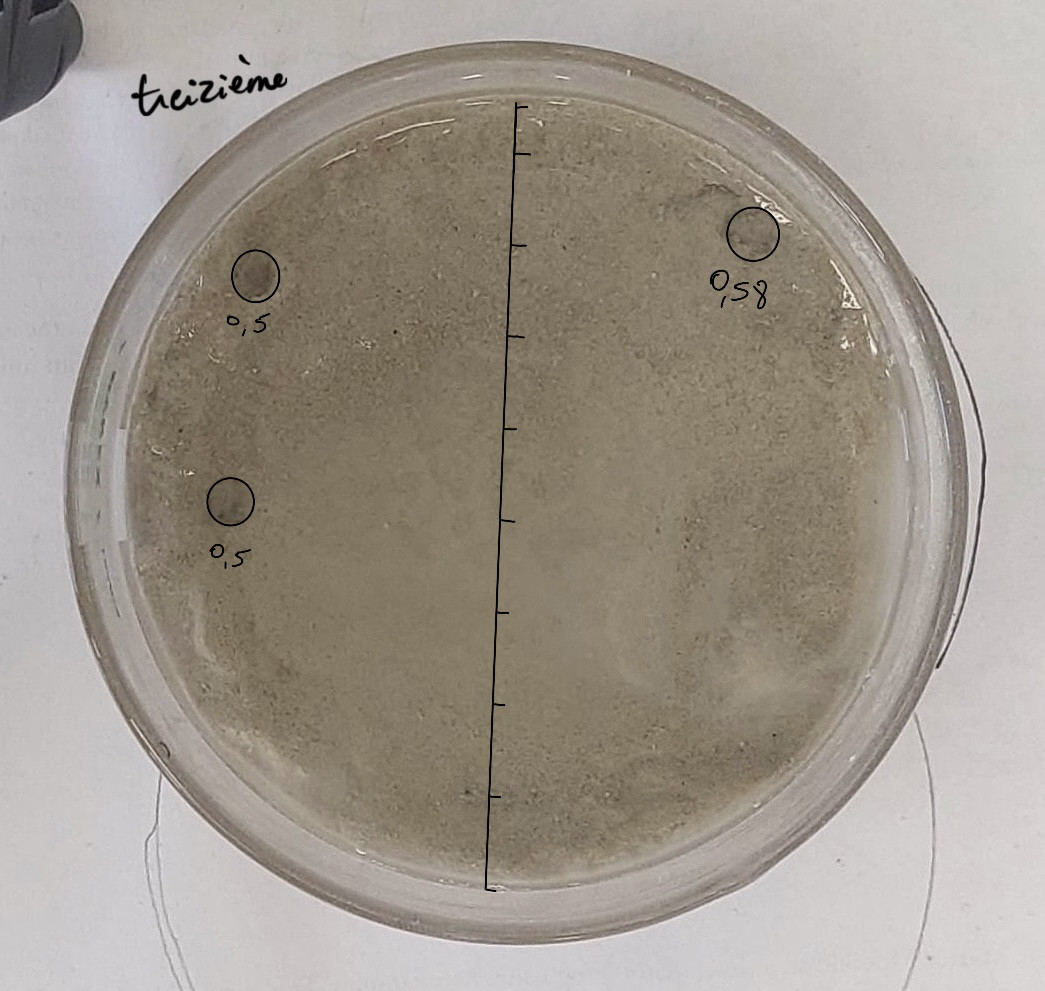
Expérience : Pour cette treizième expérience, nous avons essayé de faire la même chose mais de moins tasser.
Nous avons mis 75g de sable et 37,5g d’argile, avec un mélange effervescent à 4g de carbonate de potassium et 3,84g d’acide citrique.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable séché recyclé de la semaine précédente (75g)
- argile verte (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
Nous avons broyé le mélange effervescent. Nous avons mis une couche de sédiment très fine (pour homogénéiser) puis une couche de sédiment mélangé avec du mélange effervescent, puis une couche de sédiment sans effervescent à nouveau et enfin de l’eau (autant d’eau que de sédiment).
Résultats :
Problème : Cette fois ci, l’eau s’est mal répartie : l’eau va d’abord sur les cotés et donc c’est là que les pockmarks se sont formés.
Pockmarks de l’expérience 13 : les pockmarks sont sur le coté.
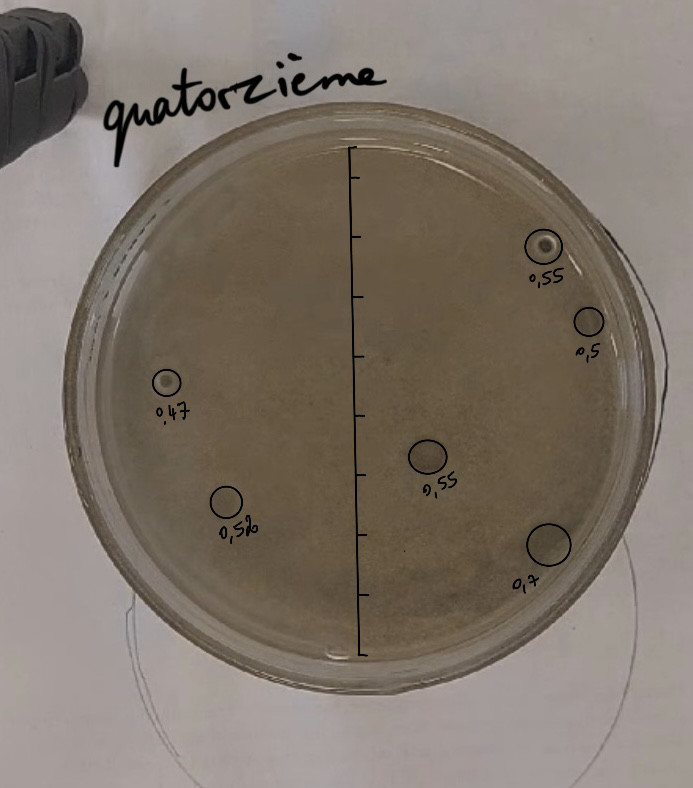
Pour cette quatorzième expérience, nous avons mis l’effervescent au centre, pour éviter les pockmarks sur les cotés (sur les cotés, ils sont trop écrasés et donc mesurer leur diamètre est compliqué. Nous avons broyé le mélange effervescent. Nous avons mis une couche de sédiment très fine (pour homogénéiser) puis une couche de sédiment mélangé avec du mélange effervescent (au centre) et du mélange sable-argile sur le pourtour, puis une couche de sédiment sans effervescent à nouveau et enfin de l’eau (autant d’eau que de sédiment).
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable séché recyclé de la semaine précédente (75g)
- argile verte (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
Mélange sable-argile+ mélange effervescent au centre et sable-argile sur les pourtour.
Nous avons moins tassé, mais l’eau à toujours eu du mal à aller jusqu’en bas. On observe des pockmarks sur les cotés tout le même.
La réaction a été neutralisée.
Une fois retournées au FabLab de Géosciences, nous avons pu retrouver l’argile que nous avons laissé 3h au dessiccateur à 75°C. 
L’argile est - presque- pure : nous pouvons donc la réutiliser. Il reste à nettoyer l’eau.
15/03/2024 :
Nous avons commencé par aller au FabLab de Géosciences pour voir si le mélange argile-sable avait séché. Et en effet, nous avons pu retirer l’argile qui s’est décollée du sable. 
Nous l’avons ensuite mélangé à l’argile que nous avions aussi récupéré en la dessicant la semaine dernière et nous les avons broyé pour retrouvé de l’argile prête à l’emploi !
Puis, nous avons lavé le sable (dans lequel il restait un tout petit peu d’argile, mais qui n’était pas réutilisable) et laissé à sécher.
Ensuite, nous nous sommes rendues au FabLab de Biologie, nous nous avons assemblé le trépied pour filmer les expériences. Pour toujours filmer nos expériences sous le même angle, nous avons préparé un repère en plastique, avec deux cercles pour les pieds du trépied, et un grand pour le cristallisoir. En effet, la semaine passée, de l’eau était tombée sur notre repère en papier, et l’avait déformé. Afin d’éviter de nouveau de problème, nous en avons fait un en plastique. 
Nous pouvons passer à une nouvelles expérience, où nous allons reproduire les expériences de la semaine dernière pour avoir des replicas pour ensuite étudier le diamètre des pockmarks. Nous allons calculer le diamètre en fonction de la hauteur de sédiment.
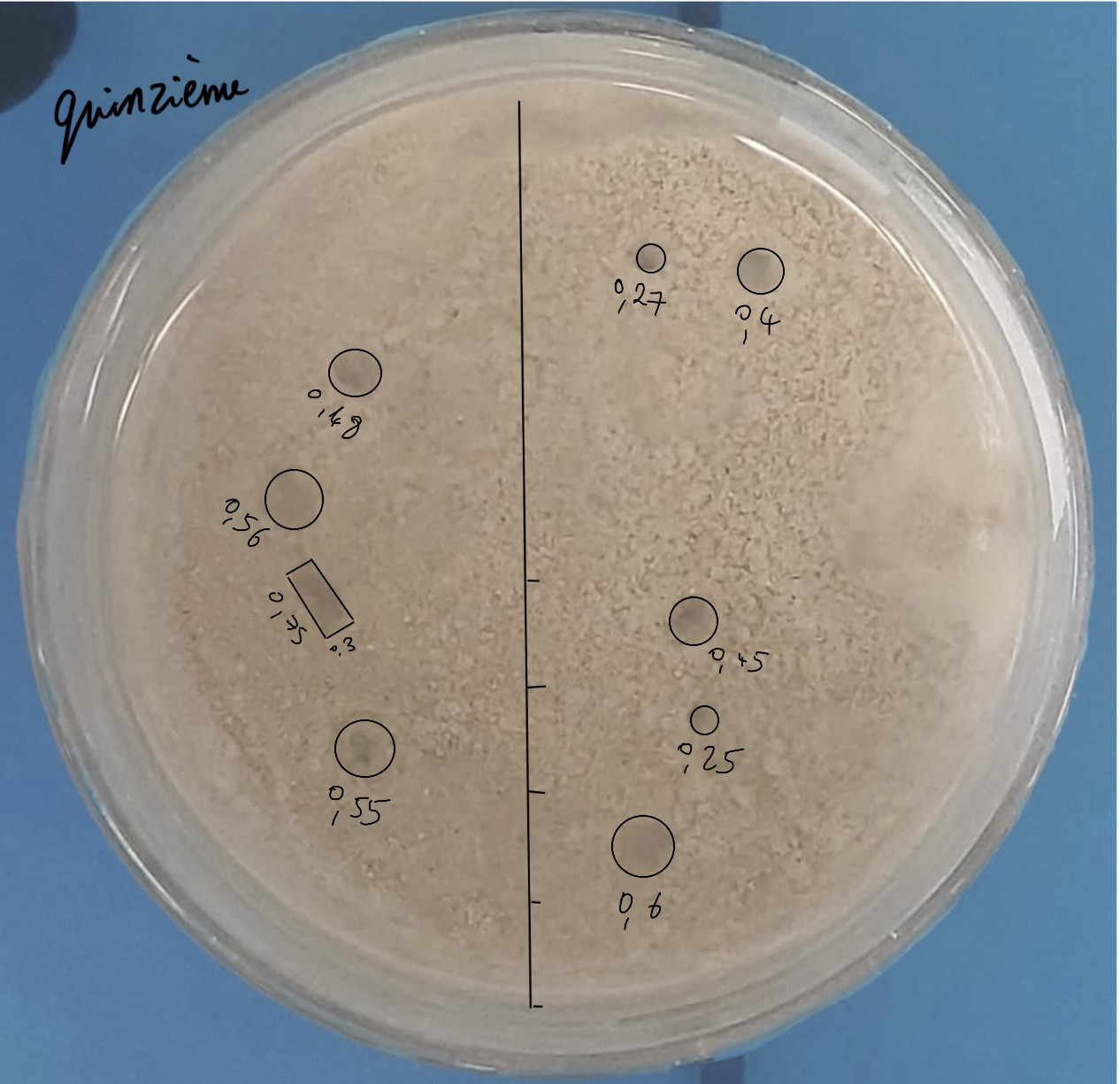
Pour cette quinzième expérience, nous utilisons de d’argile recyclée et du sable (non recyclé). Nous avons broyé le mélange effervescent. Nous avons mis une couche de sédiment très fine (pour homogénéiser) puis une couche de sédiment mélangé avec du mélange effervescent et enfin une couche de sédiment sans effervescent. Nous avons ajouté de l’eau avec la seringue (autant d’eau que de sédiment).
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75g)
- argile verte recyclée des séances précédentes (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
Notre sédiment fait 1,5 cm de haut environ. Nous avons essayé de mettre autant d’eau que de sédiment. Mais le problème est que l’eau a toujours du mal à infiltrer correctement le sédiment et la réaction n’a pas pu se faire entièrement. 
Les pockmarks sont un peu flous mais nous en avons eu beaucoup.
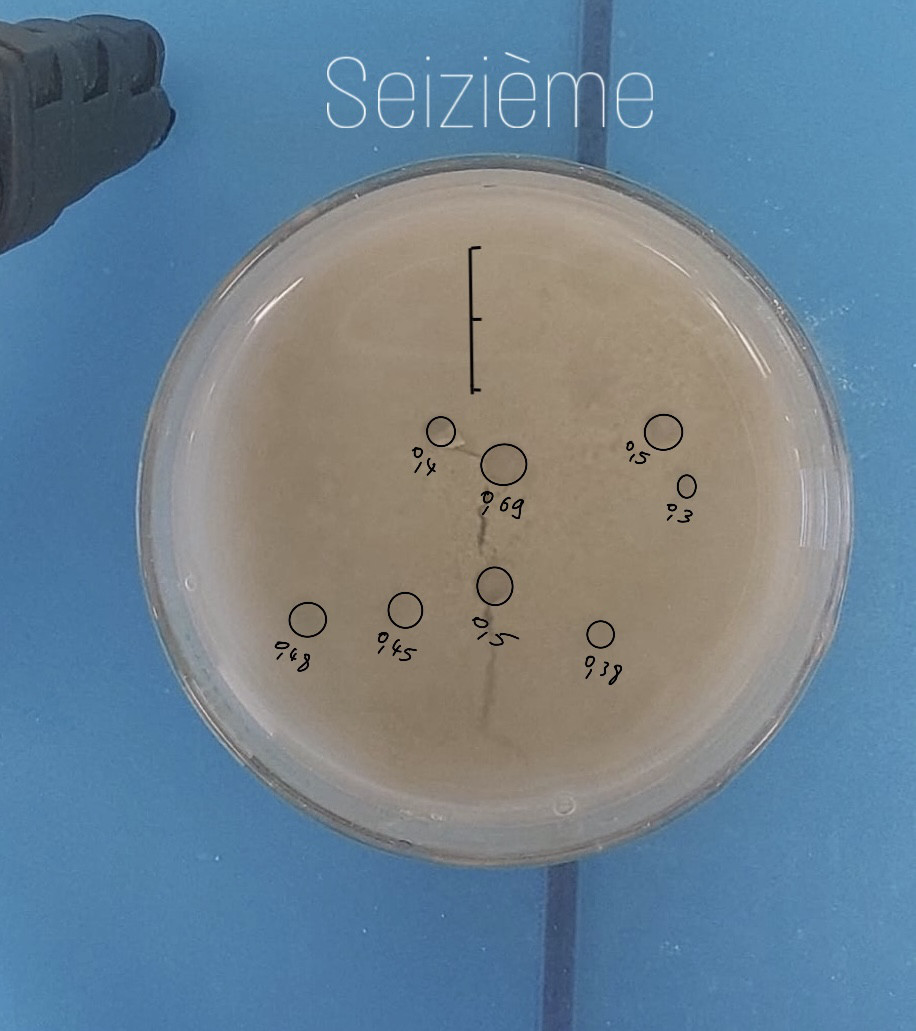
Pour cette seizième expérience, nous utilisons de d’argile recyclée et du sable (non recyclé). Nous avons broyé le mélange effervescent. Nous avons mis une couche de sédiment très fine (pour homogénéiser) puis une couche de sédiment mélangé avec du mélange effervescent et enfin une couche de sédiment sans effervescent. Nous avons ajouté de l’eau avec la seringue (autant d’eau que de sédiment).
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75g)
- argile verte recyclée des séances précédentes (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Nous avons eu l'idée d'utiliser désormais une maryse pour vider et nettoyer les béchers et le cristallisoir lors de nos expériences. En effet, le sable rayait fortement les verreries et produisait un bruit très désagréable. Nous avons fait exactement la même expérience que précédemment. Le sédiment était aussi aux alentours de 1,5 - 1,6 cm.
Avec nos diverses photos, nous pouvons maintenant calculer le diamètre et la densité des pockmarks.
Nous avons pu voir que les expériences 1, 2, 3, 4, 5, et 9 ne sont pas exploitables.
En revanche, les 6, 7, 8, 10, 11, 12, 13, 14, 15, 16 sont exploitables pour mesurer et observer des pockmarks !
22/03/2024 :
Nous avons commencé par vider l'eau stagnante au dessus de notre mélange sable-argile, afin que celui-ci soit sec pour la prochaine semaine. Nous avons ensuite mis à sécher notre argile que nous avons fait décanter, sans sable, dans le dessiccateur à 75°C pour 3 heures.
Nous sommes ensuite passées aux calculs de proportion de pockmarks par rapport à la surface totale du cristallisoir. Le cristallisoir ayant un diamètre de 8,5 cm, son rayon est de 4,25 cm ou 42,5 mm.
Son aire est donc égale à (42,5)²*π = 5674,5mm²
Calculs proportion expérience 6 :
Un seul pockmarks de 8mm de diamètre, avec un diamètre moyen de 8mm :
4²*π= 50,3mm²
50,3/5674,5*100= 0,89% de surface couverte par les pockmarks pour l'expérience 6.
Aire moyenne des pockmarks : 50,3 mm²
Calculs proportion expérience 7 :
Quatre pockmarks de 3, 8, 4, et 5.5 mm de diamètre, avec un diamètre moyen de 5,125mm :
1->1.5²*π= 7mm²
2->4²*π= 50.3mm²
3->2²*π= 12.6mm²
4->2,75²*π= 23.75mm²
7+50.3+12.6+23.75=93.65mm² de pockmarks.
93.65/5674.5*100= 1.65% de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 93.65/4 = 23,41 mm²
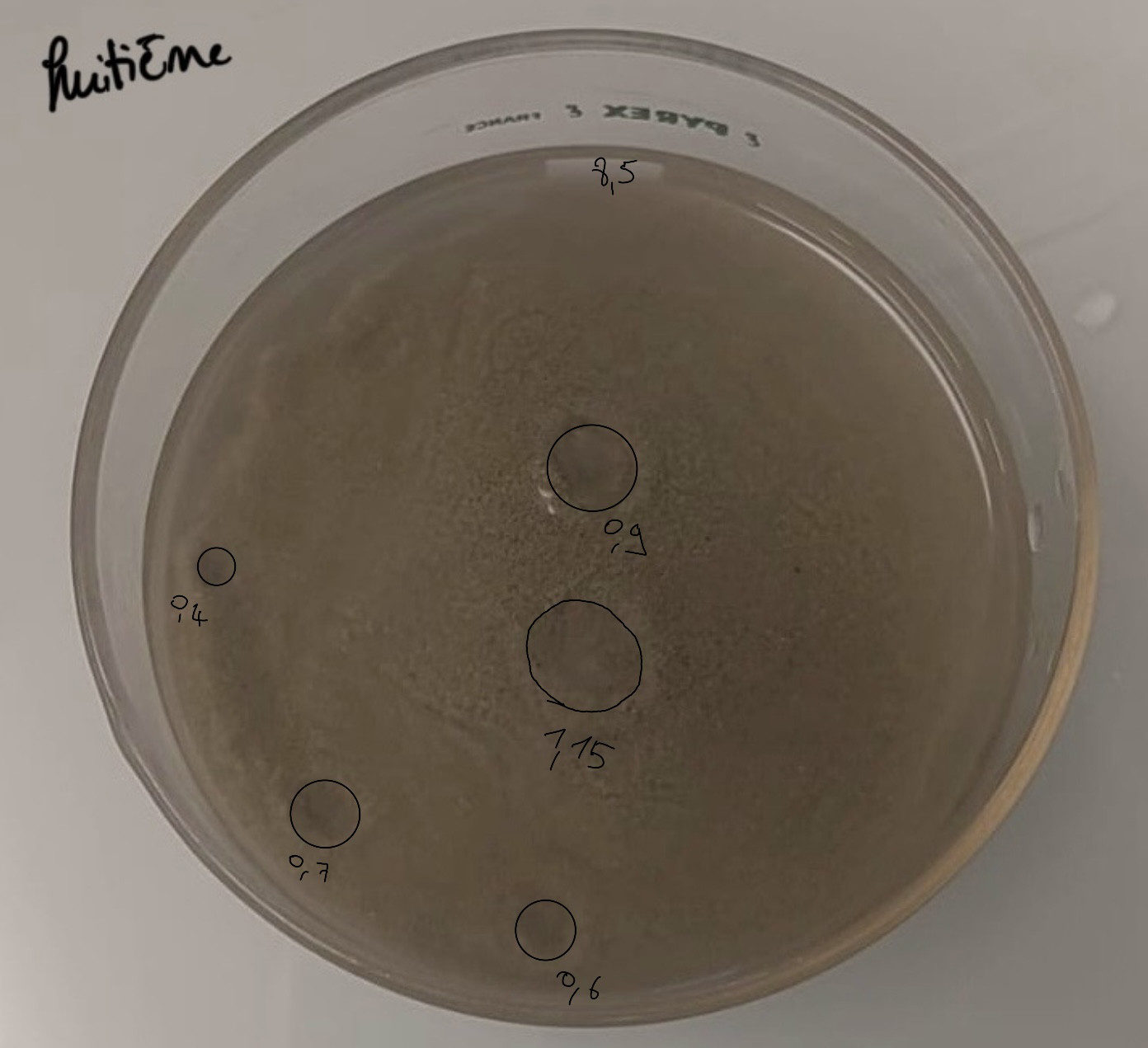
Calculs proportion expérience 8 :
Cinq pockmarks de 9, 4, 7, 11.5, et 6 mm de diamètre :
1->4.5²*π= 63.61mm²
2->2²*π= 12.6mm²
3->3.5²*π= 38.48mm²
4->5.75²*π= 103.87mm²
5->3²*π= 28.27mm²
63.61+12.6+38.48+103.87+28.27=246.83mm² de pockmarks.
246.83/5674.5*100= 4.35% de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 246,83/5 = 49,37mm²
Calculs proportion expérience 10 :
Dix pockmarks de 5, 5, 5, 6, 6, 4, 4, 4.5, et 7mm de diamètre et un avec une forme particulière ressemblant à un rectangle de 15*5 mm de coté.
1->2,5²*π= 19.63mm²
2->2,5²*π= 19.63mm²
3->2,5²*π= 19.63mm²
4->3²*π= 28.27mm²
5->3²*π= 28.27mm²
6->2²*π=12.57mm²
7->2²*π=12.57mm²
8->2.25²*π=15.90mm²
9->3.5²*π=38.48mm²
10->15*5=75mm² car respecte plus la forme d'un rectangle.
19.63+19.63+19.63+28.27+28.27+12.57+12.57+15.90+38.48+75=269.95mm² de pockmarks.
269.95/5674.5*100= 4.76% de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 269,95/10 = 26,995 mm²
Calculs proportion expérience 11 :
Il y a 3 pockmarks de 4, 6, et 7.5 mm de diamètre :
1 -> 2²*π = 12,57 mm²
2 -> 3²*π = 28,27 mm²
3 -> 3,75²*π = 44,18 mm²
12,57 + 28,27 + 44,18 = 85,02 mm²
85,02/5674,5 * 100 = 1,5 % de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 85,02/3 = 28,34 mm²
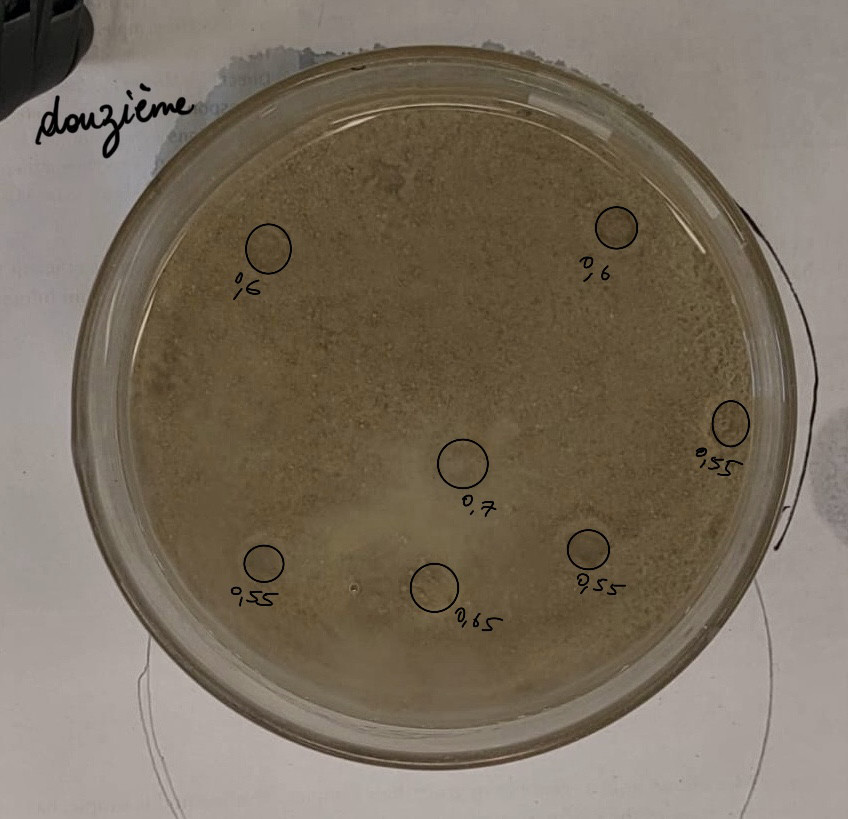
Calculs proportion expérience 12 :
Il y a 7 pockmarks de 6, 6, 7, 5.5, 5.5, 5.5, et 6.5 mm de diamètre :
1 -> 3²*π = 28,27 mm²
2 -> 3²*π = 28,27 mm²
3 -> 3,5²*π = 38,48 mm²
4 -> 2,75²*π = 23,76 mm²
5 -> 2,75²*π = 23,76 mm²
6 -> 3,25²*π = 33,18 mm²
7 -> 2,75²*π = 23,76 mm²
28,27 + 28,27 + 38,48 + 23,76 + 23,76 + 33,18 + 23,76 = 199,48 mm²
199,48/5674,5 * 100 = 3,52 % de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 199,48/7 = 28,49 mm²
Calculs proportion expérience 13 :
Il y a 3 pockmarks de 5, 5, 5.8 mm de diamètre :
1 -> 8,5²*π = 19,63 mm²
2 -> 2,5²*π = 19,63 mm²
3 -> 2,9²*π = 26,42 mm²
19,63 + 19,63 + 26,42 = 65,68 mm²
65,68/5674,5 * 100 = 1,16 % de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 65,68/3 = 21,89 mm²
Calculs proportion expérience 14 :
Il y a 6 pockmarks de 4.7, 5.2, 5.5, 5.5, 5, et 7 mm de diamètre :
1 -> 2,35²*π = 17,35 mm²
2 -> 2,6²*π = 21,24 mm²
3 -> 2,75²*π = 23,76 mm²
4 -> 2,75²*π = 23,76 mm²
5 -> 2,5²*π = 19,63 mm²
6 -> 3,5²*π = 38,48 mm²
17,35 + 21,24 + 23,76 + 23,76 + 19,63 + 38,48 = 144,22 mm²
144,22/ 5674,5 * 100 = 2,54 % de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 144,22/6 = 24,03 mm²
Calculs proportions expérience 15 :
Il y a 9 pockmarks de 2.7, 4, 4.5, 2.5, 6, 5.5, 5.6, 4.8, et un pockmark rectangulaire de 7,5x3 mm :
1 -> 1,35²*π = 5,73 mm²
2 -> 2²*π = 12,57 mm²
3 -> 2,25²*π = 15,9 mm²
4 -> 1,25²*π = 4,91 mm²
5 -> 3²*π = 28,27 mm²
6 -> 2,75²*π = 23,76 mm²
7 -> 2,8²*π = 24,63 mm²
8 -> 2,4²*π = 18,09 mm²
9 -> 7,5*3 = 22,5 mm²
5,73 + 12,57 + 15,9 + 4,91 + 28,27 + 23,76 + 24,63 + 18,09 + 22,5 = 156,36 mm²
156,36/5674,5 * 100 = 2,755 % de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 156,36/9 = 17,37 mm²
Diamètre moyen des pockmarks : 3,956
Calculs proportion expérience 16 :
Il y a 8 pockmarks de 5, 3, 4, 6.9, 5, 3.8, 4.5 et 4.8 mm de diamètre :
1 -> 2,5²*π = 19,63 mm²
2 -> 1,5²*π = 7,06 mm²
3 -> 2²*π = 12,57 mm²
4 -> 3,45²*π = 37,39 mm²
5 -> 2,5²*π = 19,63 mm²
6 -> 1,9²*π = 11,34 mm²
7 -> 2,25²*π = 15,9 mm²
8 -> 2,4²*π = 18,09 mm²
19,63 + 7,06 + 12,57 + 37,39 + 19,63 + 11,34 + 15,9 + 18,09 = 141,61 mm²
141,61/5674,5 * 100 = 2,49 % de surface occupée par les pockmarks.
Aire moyenne des pockmarks : 141,61/8 = 17,7
Diamètre moyen des pockmarks : 4,74 mm
Nous obtenons un diamètre moyen de pockmarks de 5,798mm.
Nous avons ensuite voulu comparer ces données avec des données de la littérature :
« Role of pockmarks in diversity and species assemblages of coastal macrobenthic communities » - Dubois et al. (2015).
Nous avons utilisé une image de pockmarks de Dubois et al. 2015, et nous avons utilisé la même méthode que pour nos expériences.
Le carré que nous avons sélectionné fait 171x160 m = 27 360 m²
Il y a 34 pockmarks
1 -> 7m -> 38,48m²
2-> 5,5m -> 23,76m²
3-> 2,5m -> 4,91m²
4-> 2,5m -> 4,91m²
5-> 4m -> 12,57m²
6-> 11m -> 95,03m²
7-> 4m -> 12,57m²
8-> 6,2m -> 30,19m²
9-> 3,5m -> 9,62m²
10-> 6,5m -> 33,18m²
11-> 6,5m -> 33,18m²
12-> 8m -> 50,3m²
13-> 4,5m -> 13,9m²
14-> 7m -> 38,48m²
15-> 7,5m -> 44,18m²
16-> 7m -> 38,48m²
17-> 6,5m -> 33,18m²
18-> 8m -> 50,3m²
19-> 6,5m -> 33,18m²
20-> 6,2m -> 33,18m²
21-> 3m -> 7,06m²
22-> 7m -> 38,48m²
23-> 4,5m -> 15,9m²
24-> 7m -> 38,48m²
25-> 9m -> 63,62m²
26-> 8m -> 50,3m²
27-> 4,5m -> 15,9m²
28-> 4,5m -> 15,9m²
29-> 5,5m -> 23,76m²
30-> 5,5m -> 23,76m²
31-> 10m -> 78,53m²
32-> 5,5m -> 23,76m²
33-> 6m -> 28,27m²
34-> 13m -> 137,73m²
La surface recouverte de pockmarks est de 1105,56m².
1105,56/27 360 * 100 = 4,04% de surface occupée par les pockmarks.
On peut voir qu’on est un peu dans les mêmes ordres de grandeurs. Malheureusement, c’est car, dans la nature, les pockmarks sont très nombreux et petits proportionnellement à nos expériences modèles.
29/03/2024 :
Nous avons recyclé le mélange sable-argile que vous avions laissé la semaine dernière.
Puis, nous nous sommes renseigné sur les pockmarks « naturels » et les nôtres, et nous avons essayé de voir si notre modèle est analogue à ce que nous trouvons. Malheureusement, il nous manque beaucoup de données.
Nous avions vu la semaine dernière que nos pockmarks étaient plus gros et moins nombreux que dans la nature. C’est peut être lié à la nature et à la profondeur de notre sédiment.
En effet, nous avons un mélange sable-argile. Nous sommes arrivés à une proportion de 1 part de sable pour 1/2 part d’argile car si nous mettons trop d’argile, l’eau ne circule plus, et si nous n’en mettons pas assez, les pockmarks ne se forment pas.
Nous allons essayer de faire varier la hauteur de sédiment pour voir si cela va impacter la taille de nos pockmarks.
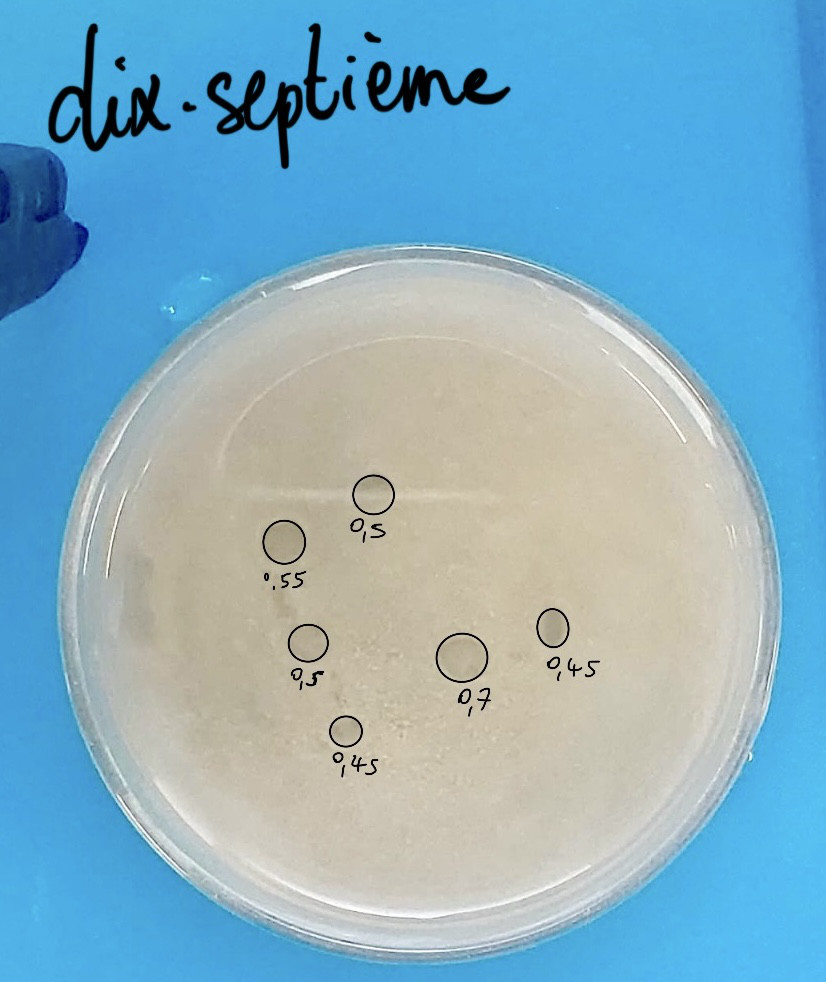
Expérience : Pour cette dix-septième expérience, nous avons essayé d’avoir une hauteur de cm de 2cm, contre 1,5cm habituellement. Nous avons donc ajouté x0,25 notre sédiment pour avoir 0,25 fois plus de sédiment : nous nous retrouvons avec environ 2cm de sédiment.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75 + 18,75 = 93,75 g)
- argile verte recyclée des séances précédentes (illite) (37,5 + 9,375= 46,875g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : Nous avons obtenu ni plus ni moins de pockmarks que pour les expériences précédentes : nous en avons 6, alors que en moyenne nous avons 5,6 pockmarks par expérience. Les pockmarks de cette expérience ont un diamètre moyen de 5,2mm (contre 5,798mm). Ajouter du sédiment n’a pas réduit le nombre de pockmarks ni agrandit la taille.
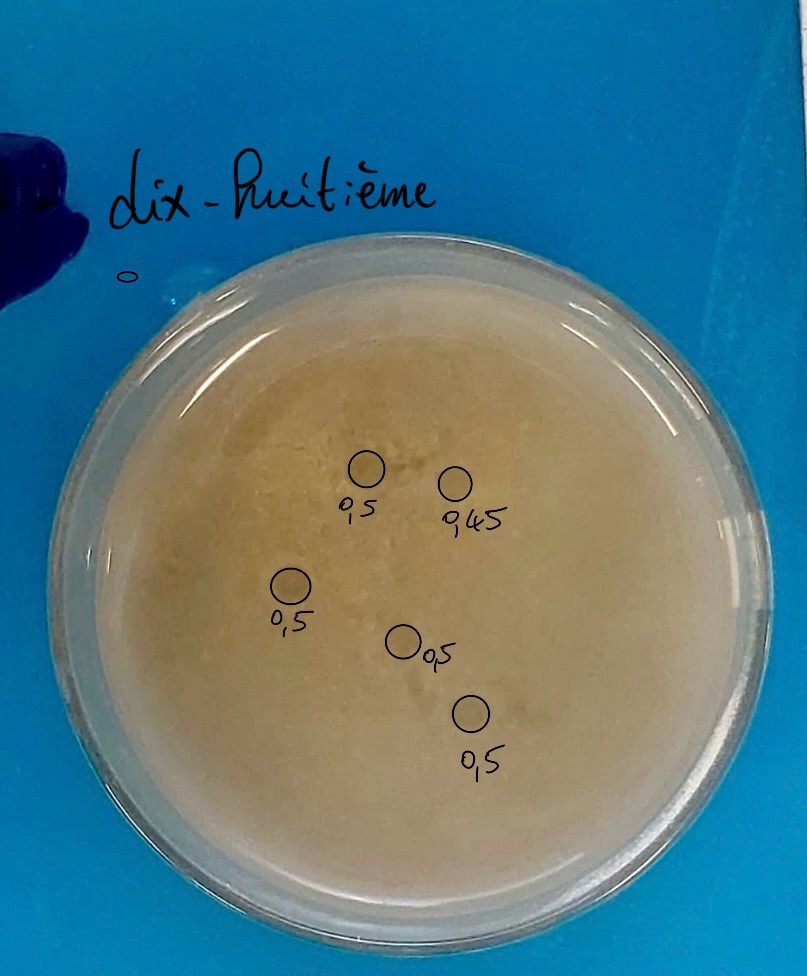
Expérience : Pour cette dix-huitième expérience, nous avons mis 0,25 fois moins de sédiment, pour avoir 1cm de sédiment. C’est ce que nous avons obtenu.
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75-18,75 = 56,25g)
- argile verte recyclée des séances précédentes (illite) (37,5- 9,375 = 28,125g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : Nous avons obtenu ni plus ni moins de pockmarks que pour les expériences précédentes : nous en avons 5, alors que en moyenne nous avons 5,6 pockmarks par expérience. Les pockmarks de cette expérience ont un diamètre moyen de 4,9mm (contre 5,798mm). Enlever du sédiment n’a pas augmenté le nombre de pockmarks, cela a peut être un peu diminué leur taille.
05/04/2024 :
Cette séance, nous allons continuer nos expériences, pour avoir un sédiment de 3cm et un sédiment de 0,75cm.
Expérience : Pour cette dix-neuvième expérience, nous avons mis 2 fois plus de sédiments qu’habituellement, pour avoir une épaisseur de sédiment de 3cm (contre 1,5cm habituellement).
Nous avons utilisé :
- béchers
- cristallisoir
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75 * 2 = 150g)
- argile verte recyclée des séances précédentes (illite) (37,5 * 2 = 75g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : Nous observons un craquèlement et une remonté gazeuse bizarre : nous nous demandons si cela est lié au sédiment en lui-même, vu que l’eau ne semble pas avoir atteint l’effervescent.
Nous avons malheureusement cassé (😞) le cristallisoir que nous utilisions depuis le début. Nous en avons trouvé un autre, un peu plus grand. Nous avons pris sa mesure pour pouvoir ultérieurement l’utiliser lors du calcul des pockmarks.
Nous avons cherché à faire une expérience témoin, sans effervescent, pour voir si la remontée gazeuse était en lien avec l’effervescent ou non. Nous avons donc versé 75g de sable avec 37,5g d’argile uniquement dans le cristallisoir. Nous avons du utiliser un nouveau cristallisoir vu que l’autre s’est cassé. Notre sédiment est aussi aux alentours de 1,4 cm, juste un peu plus petit qu’avec l’ancien cristallisoir.
Expérience : vingtième expérience (témoin).
Nous avons utilisé :
- béchers
- cristallisoir (le nouveau)
- eau minérale
- spatule
- cuillère
- balance
- sable (75g)
- argile verte recyclée des séances précédentes (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : Nous avons observé une remonté de gaz qui a formé un cratère, mais qui n’est pas homologue aux pockmarks que nous trouvons lorsque nous ajoutons de l’effervescent. Ce gaz est en moins grande quantité et est plus disparate, ne permettant pas (ou presque) la formation de pockmarks.
Nous avons aussi cherché à refaire notre expérience de base, mais dans le nouveau cristallisoir pour voir si nous observions des différences.
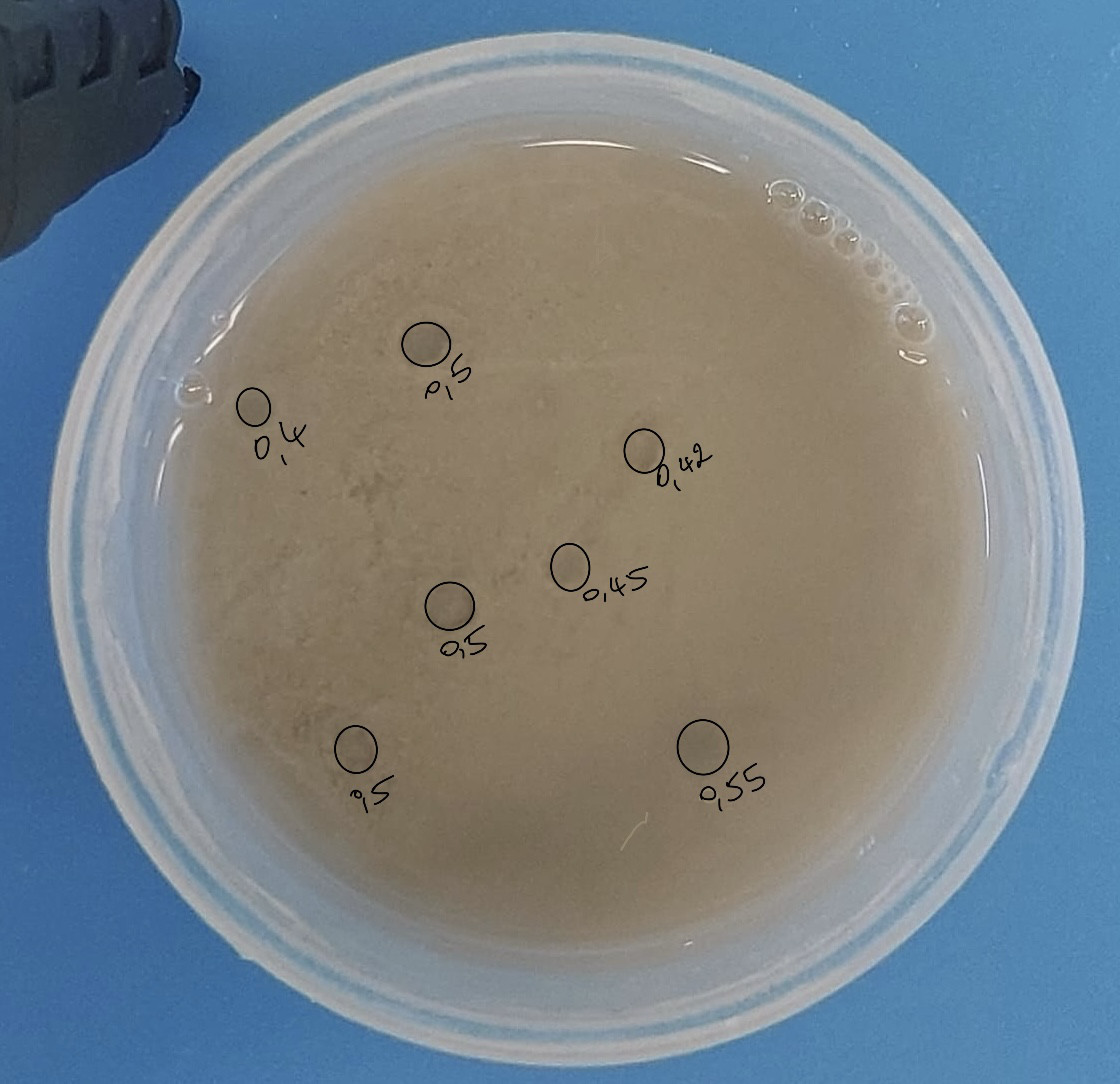
Expérience : Pour cette vingt-et-unième expérience, nous avons aussi cherché à refaire notre expérience de base, mais dans le nouveau cristallisoir pour voir si nous observions des différences.
Nous avons utilisé :
- béchers
- cristallisoir (le nouveau)
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75g)
- argile verte recyclée des séances précédentes (illite) (37,5g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : Nous observons 7 pockmarks, de diamètre moyen de 4,7 mm.
Expérience : Pour cette vingt-deuxième expérience, nous cherchons à avoir un sédiment de 0,75cm : nous allons donc mettre moitié moins de sable et d’argile.
Nous avons utilisé :
- béchers
- cristallisoir (le nouveau)
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75/2 = 37,5g)
- argile verte recyclée des séances précédentes (illite) (37,5/2 = 18,75g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : Le très fin sédiment, face à l’effervescent, a été remué et a bullé de partout (pshhhiiiiiiiiiit). 2 pockmarks ont pu se former mais le sédiment a été très remanié.
(Photo)
Pour cette vingt-troisième expérience, tout pareil (on refait celle de base)
26/04/2024 :
Aujourd’hui, nous allons refaire les expériences des séances précédentes, pour avoir une reproductibilité :
- 2 fois plus de sédiment : 3cm
- 2 fois moins : 0,75 cm
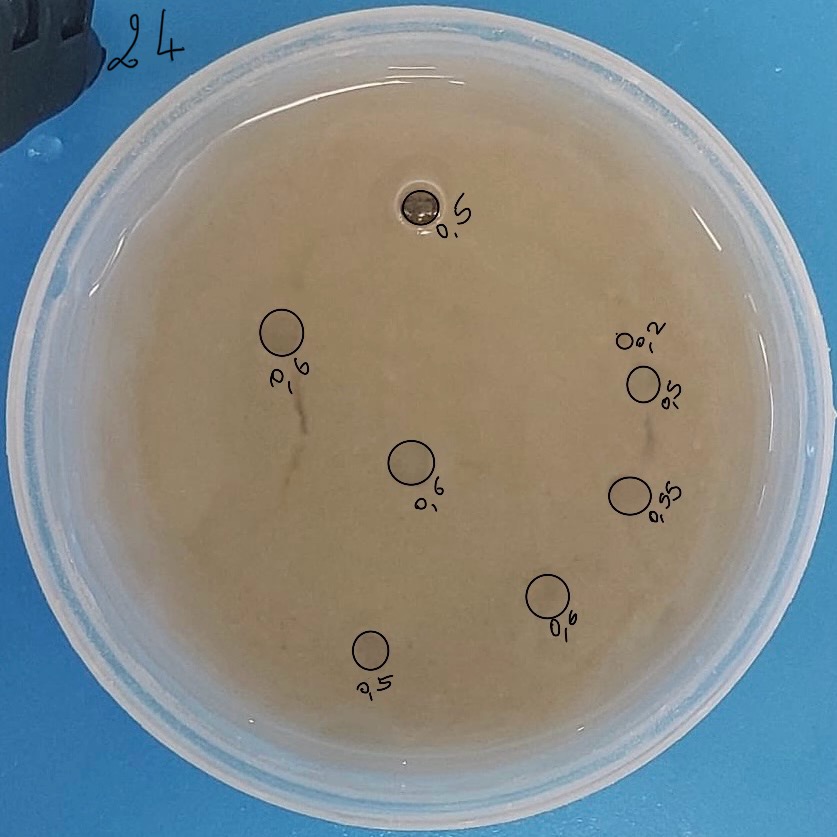
Expérience : Pour cette vingt-quatrième expérience, nous refaisons l’expérience 19, c’est-à-dire que nous allons chercher à avoir 3 cm de sédiment.
Nous avons utilisé :
- béchers
- cristallisoir en plastique
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75 * 2 = 150g)
- argile verte (illite) (37,5 * 2 = 75g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : En utilisant exactement les memes doses, nous avons eu 2,7cm de sédiment et non 3 cm. Peut être est-ce parce que le nouveau cristallisoir a des dimensions différentes.
Nous avons eu 8 pockmarks, d’un diamètre moyen de 5,1 mm.
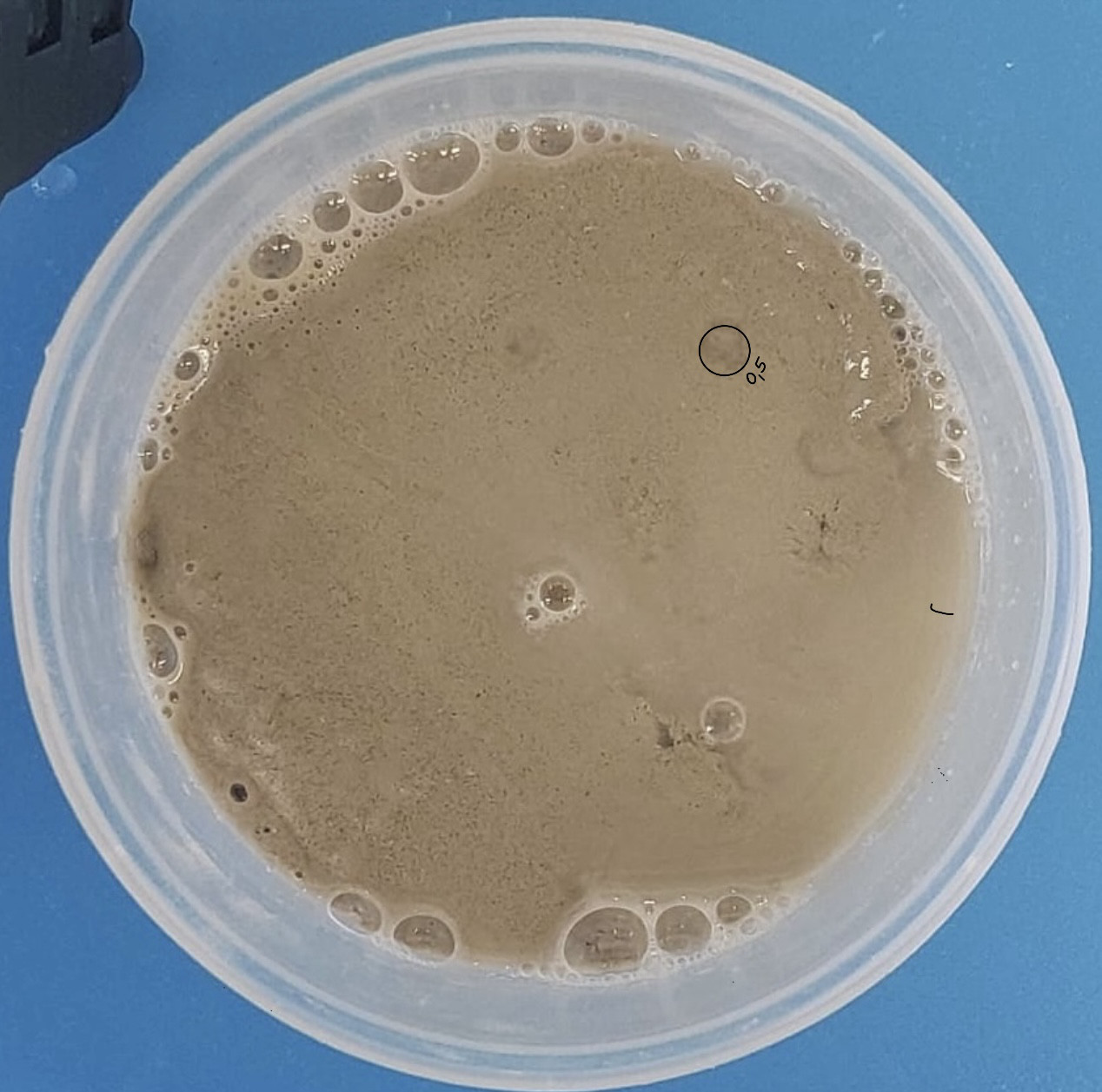
Expérience : Pour cette vingt-cinquième expérience, nous allons refaire l’expérience 22, c’est à dire que nous allons mettre moitié moins de sédiment, donc 0,75 cm.
Nous avons utilisé :
- béchers
- cristallisoir (le nouveau)
- acide citrique (3,84g)
- carbonate de potassium (4g)
- eau minérale
- spatule
- cuillère
- balance
- papier pH
- sable (75/2 = 37,5g)
- argile verte recyclée des séances précédentes (illite) (37,5/2 = 18,75g)
- seringue de 60 mL
- trépied
- règle papier
- maryse
Résultats : On au eu quelques pockmarks mais pas des masses non plus. On a pu calculer les diamètre d’un seul pockmark.
Nous avons pris le pH de l’expérience 24 pendant que nous faisions la 25e. Nous avons vu que le pH était basique. En effet, normalement, nous avons un pH de 8 à la fin de chaque expérience. Nous avons donc considéré que nos réactions étaient neutralisées. C’est peut être aussi car le papier pH est un outil difficile à manipuler, surtout dans une solution colorée par l’argile verte.
Or, lorsque nous mettons plus de sédiment, on voit que notre réaction à plus de mal à se neutraliser.
De plus, en arrivant au FabLab de géosciences, nous avons vu que l’argile de la séance passée avait réagit bizarrement : nous pensons que c’est le carbonate qui a réagit :
Nous pensons que cela a quelque chose à voir avec l’agile (illite), qui doit elle aussi réagir avec l’acide. Nous avons donc fait plusieurs petites expériences.
Nous avons mis de l’argile dans l’eau et avons pris le pH : pH 10.
Nous avons mis de l’acide dans de l’eau : pH 2.
Nous avons mis de l’acide dans de l’eau, mais en présence d’argile : pH 5.
Nous voyons donc que l’illite est très basique ! Donc c’est normal que plus nous mettons d’argile (comme par exemple pour avoir 3 cm de sédiment), plus il est difficile de neutraliser la réaction, comme nous l’avons vu pour les expériences 19 et 24. 
De gauche à droite : Eau et argile ; Eau, argile et acide citrique ; Eau et acide.
Il serait donc peut être judicieux d’adapter la quantité d’acide à la quantité d’illite, si nous voulons recycler les déchets. Nous ne pensons pas que le pH de notre solution puisse avoir un effet sur les pockmarks. C’est plutôt l’épaisseur de sédiment qui va impacter leur création.