Pockmarks (M. Francoise)
Projet de Matéo Françoise, par Adele Giobbini et Audrey Rouchon.
26/01/2024 :
Les pockmarks sont des cratères (dépressions) situées sur le fond marin, pouvant atteindre 350m de diamètre, 35m de profondeur et une densité de 160/km2 (Belfast Bay, Maine). Ils sont formés par l’échappement de fluides/ gaz naturel biogénique vers la surface, créant ainsi des cratères.
Matériel :
- cristallisoir (le plus gros)
- bicarbonate de sodium NaHCO3
- acide (citrique ? À commander ?) C6H8O7
- sable (pour sédiment effervescent)
- sable (+ argile) (pour fond marin)
- eau
Protocole :
Pour un kilogramme de sable effervescent :
- Dans un récipient, on mélange 100g d’acide citrique, 50g de bicarbonate de sodium et 850g de sable.
Pour le sable « fond marin »:
Nous allons tester différentes méthodes :
- du sable seul (de différentes granulométries)
- du sable fin avec de l’argile (nous testerons plusieurs proportions)
Problème : si le fond du cristallisoir est tapissé de sable effervescent, le gaz risque de s’échapper vers les bords du cristallisoir et ne formera pas de pockmarks. Pour remédier à cela, nous laisserons une bande de sable non effervescent tout autour du sable effervescent, pour contrer cet effet. Nous testerons plusieurs largeurs de bande.
Dans le cristallisoir, mettre 1 cm de sable effervescent (85% de sédiment, ici, le sable; 10% d’acide citrique et 5% de bicarbonate de soude) : en effet, la masse molaire de l’acide citrique est de 176,12 g/mol, et celle du bicarbonate de sodium est de 84 g/mol. On a donc presque un facteur de 1 à 2 (84 / 176,12 = 0,48), donc il faut presque deux fois plus de masse d’acide citrique que de bicarbonate de sodium pour respecter les coefficients molaires de la réaction acido-basique.
- NaHCO3 + R-COOH CO2 + H2O + RCOO− + Na+
On observe donc une libération de CO2, qui permet de reconstituer la libération de gaz, nécessaire à la formation des PockMarks.
Puis, mettre 3 cm de sable fin (pour reconstituer le fond marin).
Enfin, recouvrir d’eau.
Problème : pour filmer, toujours à la même hauteur et au même angle, il nous faut un trépied.
02/02/2024 :
Informations :
Giant sea-bed pockmarks: Evidence for gas escape from Belfast Bay, Maine: https://pubs.geoscienceworld.org/gsa/geology/article-abstract/22/1/59/205977/Giant-sea-bed-pockmarks-Evidence-for-gas-escape
https://fr.wikipedia.org/wiki/Pockmark
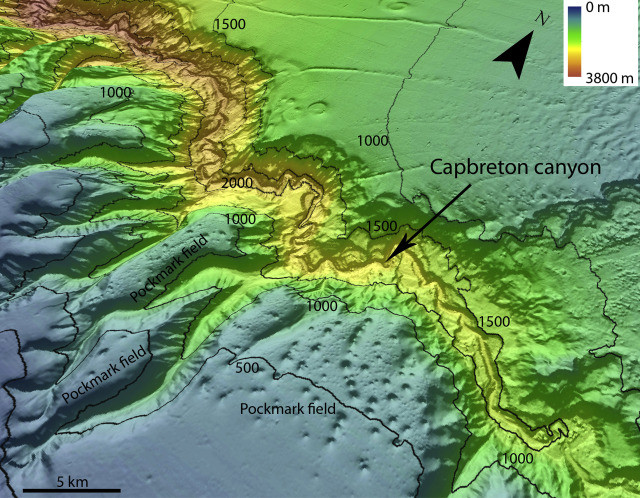 https://www.sciencedirect.com/topics/earth-and-planetary-sciences/pockmark
https://www.sciencedirect.com/topics/earth-and-planetary-sciences/pockmark
A la place du bicarbonate de sodium, nous utilisons du carbonate de potassium (K2CO3). Cela change donc nos calculs car la masse molaire n’est pas la même :
Masse molaire du carbonate de potassium : 138 g/mol
Masse molaire de l’acide citrique : 176 g/mol
Donc on environ un facteur de 0,8 : nous avons donc mis 1 gramme d’acide citrique pour 0,8 gramme de carbonate de potassium pour respecter le coefficient stœchiométrique.
Protocole :
Pour cette expérience, nous avons utilisé :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- microbalance
- papier pH
- aluminium
- sable
Premièrement, nous avons faire une première expérience pour tester si l’effervescent fonctionnait. Nous avons mélangé 8 grammes de carbonate de potassium et 10 grammes d’acide citrique. La réaction a fonctionné 👍(ça fé dé bulles). Nous avons vérifié si tout l’acide avait été neutralisé, grâce au papier pH : affirmatif (pH de 6).
Puis, nous avons testé une première expérience, en mettant une couche de sable effervescent (un volume de mélange effervescent pour deux volumes de sable fin sec) :

