Pockmarks (M. Francoise)
Projet de MatéMatéo FrançFrançoise, par Adele Giobbini et Audrey Rouchon.
26/01/2024 :
Les pockmarks sont des cratècratères (dédépressions) situésituées sur le fond marin, pouvant atteindre 350m de diamèdiamètre, 35m de profondeur et une densitédensité de 160/km2 (Belfast Bay, Maine). Ils sont forméformés par l’él’échappement de fluides/ gaz naturel biogébiogénique vers la surface, crécréant ainsi des cratècratères.
MatéMatériel :
- cristallisoir (le plus gros)
- bicarbonate de sodium NaHCO3
- acide (citrique ?
ÀÀ commander ?) C6H8O7 - sable (pour
sésédiment effervescent) - sable (+ argile) (pour fond marin)
- eau
Protocole :
Pour un kilogramme de sable effervescent :
- Dans un
rérécipient, onmémélange 100gd’d’acide citrique, 50g de bicarbonate de sodium et 850g de sable.
Pour le sable «« fond marin »»:
Nous allons tester diffédifférentes méméthodes :
- du sable seul (de
diffédifférentesgranulomégranulométries) - du sable fin avec de
l’l’argile (nous testerons plusieurs proportions)
ProblèProblème : si le fond du cristallisoir est tapissétapissé de sable effervescent, le gaz risque de s’és’échapper vers les bords du cristallisoir et ne formera pas de pockmarks. Pour reméremédier àà cela, nous laisserons une bande de sable non effervescent tout autour du sable effervescent, pour contrer cet effet. Nous testerons plusieurs largeurs de bande.
Dans le cristallisoir, mettre 1 cm de sable effervescent (85% de sésédiment, ici, le sable; 10% d’d’acide citrique et 5% de bicarbonate de soude) : en effet, la masse molaire de l’l’acide citrique est de 176,12 g/mol, et celle du bicarbonate de sodium est de 84 g/mol. On a donc presque un facteur de 1 àà 2 (84 / 176,12 = 0,48), donc il faut presque deux fois plus de masse d’d’acide citrique que de bicarbonate de sodium pour respecter les coefficients molaires de la réréaction acido-basique.
- NaHCO3 + R-COOH CO2 + H2O + RCOO
−− + Na+
On observe donc une libélibération de CO2, qui permet de reconstituer la libélibération de gaz, nénécessaire àà la formation des PockMarks.
Puis, mettre 3 cm de sable fin (pour reconstituer le fond marin).
Enfin, recouvrir d’d’eau.
ProblèProblème : pour filmer, toujours àà la mêmême hauteur et au mêmême angle, il nous faut un trétrépied.
02/02/2024 :
Informations :
Giant sea-bed pockmarks: Evidence for gas escape from Belfast Bay, Maine: https://pubs.geoscienceworld.org/gsa/geology/article-abstract/22/1/59/205977/Giant-sea-bed-pockmarks-Evidence-for-gas-escape
https://fr.wikipedia.org/wiki/Pockmark
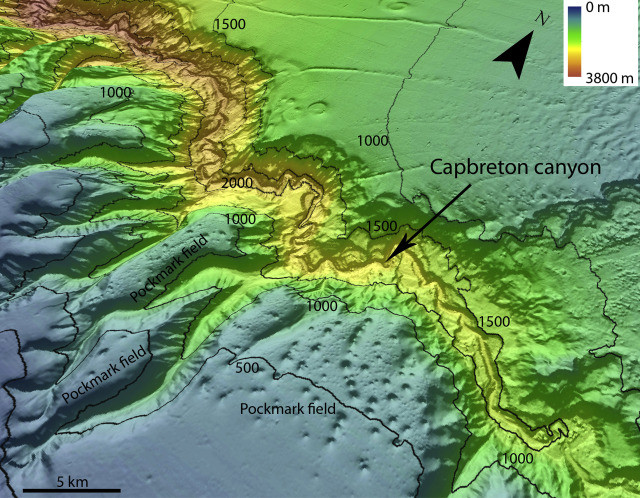 https://www.sciencedirect.com/topics/earth-and-planetary-sciences/pockmark
https://www.sciencedirect.com/topics/earth-and-planetary-sciences/pockmark
A la place du bicarbonate de sodium, nous utilisons du carbonate de potassium (K2CO3). Cela change donc nos calculs car la masse molaire n’est pas la même :
Masse molaire du carbonate de potassium : 138 g/mol
Masse molaire de l’acide citrique : 176 g/mol
Donc on environ un facteur de 0,8 : nous avons donc mis 1 gramme d’acide citrique pour 0,8 gramme de carbonate de potassium pour respecter le coefficient stœchiométrique.
Protocole :
Pour cette expérience, nous avons utilisé :
- béchers
- cristallisoir
- acide citrique
- carbonate de potassium
- eau minérale
- spatule
- cuillère
- microbalance
- papier pH
- aluminium
- sable
Premièrement, nous avons faire une première expérience pour tester si l’effervescent fonctionnait. Nous avons mélangé 8 grammes de carbonate de potassium et 10 grammes d’acide citrique. La réaction a fonctionné 👍(ça fé dé bulles). Nous avons vérifié si tout l’acide avait été neutralisé, grâce au papier pH : affirmatif (pH de 6).
Puis, nous avons testé une première expérience, en mettant une couche de sable effervescent (un volume de mélange effervescent pour deux volumes de sable fin sec) :

