Mise au point d’un échantillon d’eau venu de l’espace de prototypage de la cuve de la découpeuse laser (Omax) sur un milieu LB
Informations :
· Alan Kernanec
· alan.kernanec@sorbonne-universite.fr
- FabManagers espace Biologie/Chimie
· 27/05/24
Contexte :
Nous voulons voir si l’échantillon d’eau qui provient de l’espace prototypage contient des bactéries ou des colonies spécifiques.
Objectifs :
Nous avons fait des tests sur un milieu gélosé LB qui est composé de agar-agar, de LB et d’eau distillé.
Consommables :
· Agar-Agar
· LB
· Eau distillé
· Cristal violet
· Lugol
· Ethanol
· Fuchsine
· Javel
Matériel et Machines utilisés :
· Tube à essai
· Ense de platine
· P1000
· Pipette pasteur en verre
· Bécher
· Bec bunsen
· Agitateur magnétique
· Boîte de pétri
· Lame de microscope
· Pince
· Bac en verre
· Microscope
· Portoir
· Poubelle DASRI
· Balance de précision
Protocole :
1- Préparation du milieux LB de volume 200mL dans une bouteille en verre.
2- Mettre la bouteille dans l’autoclave. Pour la préparation de l’autoclave mettre un fond d’eau distillé au fond. Puis lancer le programme 20min à 121°C.
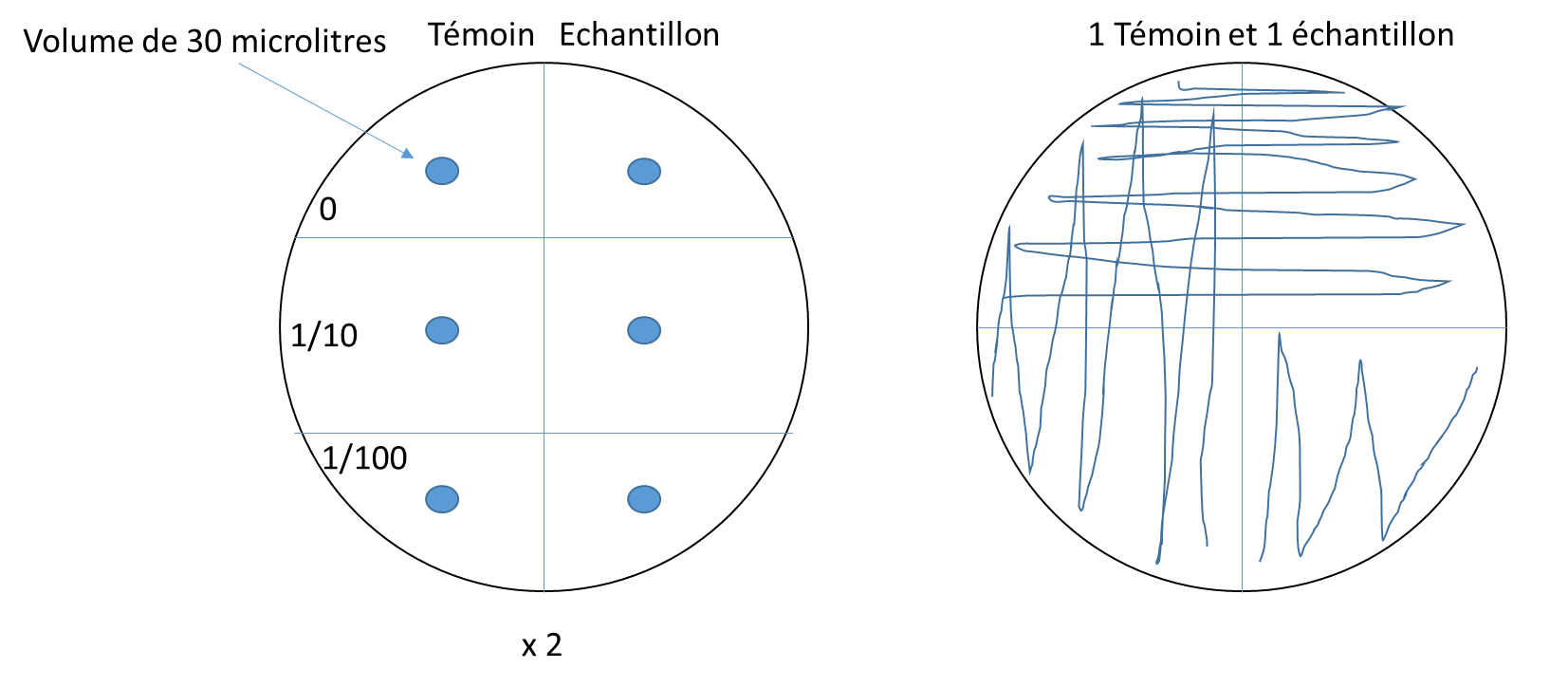
3- Allumer la PSM et procéder au nettoyage de la surface. Par la suite annoter les boîtes de pétri (2 boîtes séparé en 6 parties et 2 boîtes en ensemencement en strie standard). Penser à mettre la date et la nature du milieu et rajouter T pour témoins et E pour échantillon.
4- Par la suite, procéder au coulage des boîtes sous PSM et attendre qu’elles se solidifient.
5- Puis procéder à l’ensemencement des boîtes comme indiqué ci-dessous :
6- Puis mettre les boîtes retournés 24h à l’incubateur à 37°C.
7- Observation des boîtes
8- Lancer une coloration de Gram :
Procédure :
1. Fixation : Fixer les bactéries sur une lame de verre en les chauffant légèrement. Cela peut être fait en passant la lame au-dessus d'une flamme.
2. Coloration initiale : Appliquer le cristal violet sur les bactéries. Laisser agir pendant environ 1 minute.
3. Fixation du cristal violet : Ajouter le Lugol (solution d'iode) sur le cristal violet. Laisser agir pendant environ 1 minute. Cette étape fixe le cristal violet dans la paroi cellulaire.
4. Décoloration : Laver la lame à l'éthanol ou à l'alcool éthylique. Cela élimine le cristal violet des bactéries. La durée de décoloration doit être surveillée attentivement, car elle varie selon les types de bactéries.
5. Contre-coloration : Appliquer la fuchsine sur les bactéries. Laisser agir pendant 1 minutes. La fuchsine colore les bactéries qui ont perdu le cristal violet.
6. Lavage final : Rincer la lame à l'eau pour éliminer l'excès de colorant.
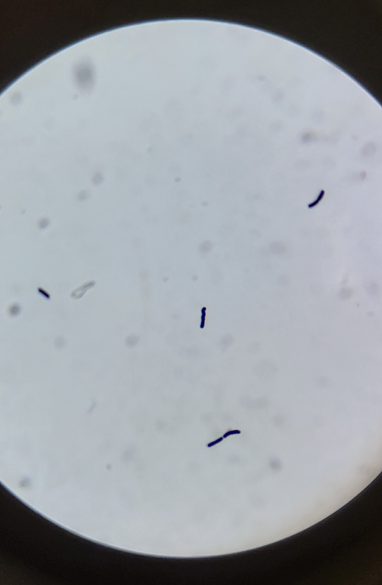
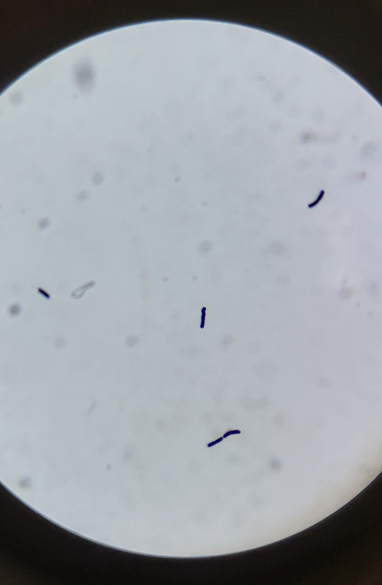
7. Observation : Observer les bactéries au microscope. Les bactéries qui conservent la coloration violette sont appelées "Gram-positives", tandis que celles qui prennent la coloration safranine sont appelées "Gram-négatives".
Résultats :
· Gram-positif : Bactéries avec une paroi cellulaire épaisse qui retient le cristal violet.
· Gram-négatif : Bactéries avec une paroi cellulaire plus mince qui ne retient pas le cristal violet et prend la coloration rose.
9- Et nous observation au microscope des Bacillus violet.