Test oxydase
1) Intérêt
La recherche de l’oxydase présente un intérêt taxonomique en ce qui concerne les bactéries
à Gram -.
2) Principe
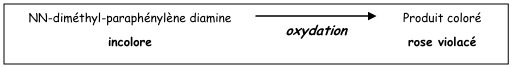
Le test consiste à mettre en évidence la capacité que possède la bactérie à oxyder un réactif incolore (la NN-diméthyl-paraphénylène diamine) en un dérivé rose violacé.
3) Technique
- Placer un disque oxydase sur une lame à l’aide d’une pince stérilisée au bec électrique.
- Avec une pipette Pasteur prélever une colonie sur milieu solide et la déposer
doucement sur le disque.
Remarques :
- Il existe des disques mais aussi des bandelettes oxydases.
- Ne pas utiliser l’anse métallique pour prélever les bactéries. En effet, le métal peut
être recouvert d’un oxyde et donner un résultat faussement positif. - Le milieu solide ne doit pas contenir d’indicateur de pH, ni de glucides.
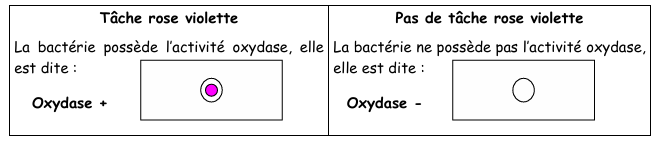
4) Lecture
La réaction entre la bactérie et le disque ne met que quelques secondes à se faire.
Causes d’erreurs :
- Réalisation du test sur un milieu glucidique (une fermentation peut cacher une
respiration) Humidification trop importante du disque, entraînant une élimination du réactifrespiration- Quantité de bactéries insuffisante ( prélever plusieurs colonies si une ne suffit pas)
- Réactif périmé (l tester avec une souche oxydase + et une souche oxydase -)
- Utilisation d’un instrument « oxydase + » ( anse de platine, objet métallique)
- Lecture trop tardive : au delà de 30 secondes