Groupe 4 - Action solubilisant des tensioactifs
Liste des participants :
- Mariam El Nagar - Mariam.El_Nagar@etu.sorbonne-universite.fr
- Irem Janset Ersan - Irem_Janset.Ersan@etu.sorbonne-universite.fr
- Lilia Hadoum - Lilia.Hadoum@etu.sorbonne-universite.fr
- Phuong Anh Ho - Phuong_Anh.Ho@etu.sorbonne-universite.fr
- Sophie Yu-Can Huang - Sophie_Yu-Can.Huang@etu.sorbonne-universite.fr
- Alae khelladi - Alae.Khelladi@etu.sorbonne-universite.fr
La PremièPremière SéSéance de FabLab
25 Septembre 2025
DéDémarche :
Nous cherchons àà mettre en éévidence expéexpérimentalement l'influence de la concentration en tensioactif, en particulier le SDS (molémolécule àà caractècaractère amphiphile, avec une têtête hydrophile ionique et une queue hydrophobe, qui permet de piépiéger des molémolécules ex: salissures, insolubles dans l’l’eau) sur la capacitécapacité de la solution àà solubiliser une espèespèce insoluble dans l'eau.
Pour mettre en éévidence ce phénomèphénomène, nous prendrons comme modèmodèle de salissure une molémolécule de couleur orange (585-620nm): le 1- (2-pyridyl azo)-2-naphthol (PAN). En absence du tensioactif, on s’s’attend àà 2 phases (phase aqueuse et phase insoluble colorécolorée). En revanche, en préprésence de celui-ci, l’l’action solubilisante devrait permettre le mémélange des deux phases et on devrait obtenir une solution colorécolorée.
Pour quantifier la part de PAN passent en phase aqueuse, nous réréaliserons les mesures d'absorbance (λλ~450-490 nm, complécomplémentaire au orange). Si le colorant est non solubilisésolubilisé, on s’s’attend àà mesurer une faible absorbance de la phase aqueuse et inversement, une augmentation de celle-ci si le colorant se solubilise grâgrâce au tensioactif, lors de la formation des premièpremières micelles. Nous prépréparerons plusieurs solutions de concentrations diffédifférentes en tensioactifs dans lesquelles nous introduirons du colorant PAN puis nous mesurerons l’l’absorbance de la phase aqueuse afin de quantifier la quantitéquantité de PAN passépassée en phase aqueuse . GrâGrâce àà cette premièpremière expéexpérience, nous pourrons dédéterminer la CMC (= la concentration en tensioactif dans un milieu au-dessus de laquelle des micelles se forment spontanéspontanément) du tensioactif appeléappelé SDS [dodédodécylsulfate de sodium], par mesure d’d’absorbance et de conductivitéconductivité. Les mesures nous permettront de tracer deux graphiques repréreprésentant l’él’évolution de l’l’absorbance ou de la conductivitéconductivité en fonction de la concentration en SDS afin de trouver quantitativement la valeur la plus préprécise de CMC du SDS.
Nous avons fait 2 groupes de 3:
Groupe de dissolution de SDS :
- Sophie
- Anh
- Mariam
Les matématériaux utiliséutilisés par le groupe
- SDS en poudre
- De l'eau
distillédistillée - Gants (car SDS et solvants sont irritants)
- Lunettes et blouses
- 1 fiole
jaugéjaugée de 1L pour la solutionmèmère de SDS - Balance de
préprécision - Entonnoir
- Spatule
mémétallique - Des
bébéchers poubelles
Le protocole suivi pour cette partie:
[ prépréparation de la solution mèmère ]
On prend la masse molaire de (SDS) : 288,38 g/mol
-
Peser 10.368 g de SDS
ààl’l’aided’d’une balance depréprécision etd’d’une capsuleàà peser pour avoir 1L de solutionmèmère de 36 mmol.L-1 . (Nb: Masseréréelle de SDSprélevéprélevée = 10.3601g) -
Avec un entonnoir, verser le SDS
prélevéprélevé dans la fiolejaugéjaugée contenantdéjàdéjà un fond d'eau. -
Rincer avec de
l’l’eaudistillédistillée la capsule etl’l’entonnoir afin derécupérécupérer le maximum desolutésoluté. -
Introduire dans la fiole
jaugéjaugéed’d’abord environ 800 mLd’d’eaudistillédistillée pour bien agiter et dissoudre le SDScomplècomplètement. Une fois dissous,complécompléter le volumeàà 1L avec del’l’eaudistillédistilléeààl’l’aided’d’une pipette pasteur. -
Boucher et
homogénéhomogénéiser le tout.
Groupe de dissolution de PAN:
- Irem
- Lilia
- Alae
Les matématériaux utiliséutilisés par le groupe
- Colorant PAN en poudre
- Solvant pour le PAN: cyclohexane
- Gants
- Lunettes et blouse
- Spatule
mémétallique - Entonnoir
- Balance de
préprécision - 1 fiole de 100 mL pour le PAN
- Capsule
àà peser - Un
bébécher poubelle
Le protocole suivi pour cette partie:
Afin de réréaliser une solution de 100mL de PAN saturésaturée àà ~1,6 ×× 10⁻³³.
On prend la masse molaire de (PAN) : 249,27 g/mol.
-
A
l’l’aided’d’une balance depréprécision,d’d’une capsule depesépesée etd’d’une spatulemémétallique peser une masse 0,04 g de PAN solide -
Poser la capsule de
pesépesée sur la balance et effectuer la tare -
A
l’l’aide de la spatulemémétallique peser 0,04 g de PAN -
Verser un fond de cyclohexane dans la fiole
jaugéjaugée de 100 ml -
A l'aide de l'entonnoir,
transfétransférer cette masse dans la fiolejaugéjaugée, prendre soin de rincer au cyclohexane la capsule depesépesée etl’l’entonnoir afin derécupérécupérer lesolutésoluté dans la fiolejaugéjaugée. -
Ajouter du cyclohexane dans la fiole
jaugéjaugéejusqu’jusqu’aux ⅔ puis agiter par rotation pour favoriser la dissolution du solide. -
CompléCompléter la fiole avec du cyclohexanejusqu’jusqu’au trait de jauge. -
Boucher la fiole et
homogénéhomogénéiser par retournement.
RésuméRésumé de la premièpremière séséance:
Pendant cette premièpremière séséance de FabLab nous avons pu dissoudre le PAN dans le cyclohexane et prépréparer la solution mèmère de SDS àà partir des groupes de 3. La prépréparation de la solution mèmère a pris du temps car le SDS a forméformé de la mousse donc l'éétape de la dissolution n'éétait pas complècomplète. Lors de la prépréparation de la solution mèmère de SDS, l’l’agitation de la solution a entraînéentraîné la formation de mousse. Afin d’éd’éviter ce phénomèphénomène, il aurait étéété préfépréférable d’d’ajouter l’l’eau progressivement et sous agitation douce. L’L’utilisation d’d’un bain àà ultrasons a pu faciliter la dissolution sans génégénérer de mousse excessive. Nous allons éégalement utiliser une autre technique en ééclatant les bulles avec une spatule fine en ajoutant de l'eau distillédistillée sur les bords. Nous allons prépréparer les solutions filles pendant la prochaine séséance en utilisant des pipettes graduégraduées plutôplutôt que des pipettes jaugéjaugées pour plus de facilitéfacilité pendant la pratique.
La DeuxièDeuxième SéSéance de FabLab
29 Septembre 2025
Le protocole suivi pour cette partie:
Les matématériaux:
- Fiole
jaugéjaugée 1L contenant la solutionmèmère de SDS - 2
BéBéchers (1 pour la solutionmèmère + 1bébécher poubelle) - 10 fioles
jaugéjaugées de 100mL - Pipettes
graduégraduées - Pipettes pasteur
- Eau
distillédistillée
Tableau pour la dilution de SDS [ prépréparation des solutions filles ]
Solutions |
S1 (solution |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
S8 |
S9 |
S10 |
|
|
0 |
45
|
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
Concentration fille (mmol/L) |
36 ( |
16.2 |
14.4 |
12.6 |
10.8 |
9 |
7.2 |
5.4 |
3.6 |
1.8 |
|
Concentration avec la masse de SDS |
35.93 |
16.17 |
14.37 |
12.58 |
10.78 |
8.98 |
7.19 |
5.39 |
3.59 |
1.79 |
-
PréPréleverVmèVmère (cf. tableau) de la solutionmèmèreààl’l’aided’d’une pipettejaugéjaugée etd’d’une poireàà pipeter. -
Introduire la solution
prélevéprélevée dans la fiolejaugéjaugée de 100mL. -
Remplir avec de
l’l’eaudistillédistilléejusqu’àjusqu’à ⅓ de la fiole. -
Boucher et agiter.
-
CompléCompléter au trait de jauge avec une pipette pasteur. -
Boucher et
homogénéhomogénéiser. -
RépéRépéter lesmêmêmeséétapes pour toutes les autres solutions filles [ faire attentionàà bienéétiqueter et nommer les solutions (S1, S2,……) pourééviter les confusions lors des manipulations ]
Mesures de conductivitéconductivité - protocole détaillédétaillé
La conductivitéconductivité est une technique couramment utiliséutilisée pour dédéterminer la CMC des tensioactifs ioniques comme le SDS, qui se comporte comme les éélectrolytes dans l’l’eau. Cette technique ne peut pas êêtre appliquéappliquée aux tensioactifs non ioniques car ceux-ci ont un effet nénégligeable sur la conductivitéconductivité de la solution.
Les matématériaux:
- 10
bébéchers de 50mL - 10 solutions filles (S1, S2,...S10)
- Eau
distillédistillée - Papier absorbant
- 2 solutions
éétalon KCl de concentrations 10^-5M et 0.1M ConductimèConductimètre
PréPréparation avant mesures - calibration du conductimèconductimètre [ sauf si il est déjàdéjà calibrécalibré ]
-
Rincer la sonde
ààl’l’eaudistillédistillée, essuyerdédélicatement, sans frotter avec du papier -
RéRéaliser la calibration de deux solutionséétalons : immerger dans la solutionéétalon 1, attendre que la valeur se stabilise et rincer de nouveaul’él’électrodeààl’l’eaudistillédistillée. Immerger dans la solutionéétalon 2, et refaire leséétapesprécéprécédentes de nouveau. -
VéVérifier que la compensation automatique detempétempérature est active [ Tàà 25°°C si possible ] -
Rincer de nouveau
l’él’électrodeààl’l’eaudistillédistillée avant de passer aux mesures.
Mesure [ pour chaque solution fille ]
-
TransféTransférer 40 ou 50 mL de solution SDS dans unbébécher propre. -
Rincer la sonde dans de
l’l’eaudistillédistillée puis dans une petite portion del’él’échantillon. -
Immerger la sonde dans le
bébécher sans toucher les parois, agiter doucement pourhomogénéhomogénéiser etééviter les bullesd’d’air autour deséélectrodes. -
Attendre la stabilisation de la lecture et noter la
conductivitéconductivité [µS·µS·cm⁻¹¹ ] et latempétempératureaffichéaffichée. -
Faire 3 mesures successives [ rincer la sonde entre chaque ] et garder la moyenne
±±éécart-type afind’d’avoir une valeur pluspréprécise. -
RépéRépéter pour toutes les solutions filles lemêmême processus, de la plusdiluédiluéeàà la plusconcentréconcentrée afin de ne pas semémélanger [ ou inversement ]
Objectif de la séséance :
Lors de cette séséance, nous avons préparépréparé une sésérie de solutions filles àà partir d'une solution mèmère, en vue de mesurer leur conductivitéconductivité. L’L’objectif final sera de mesurer éégalement l’l’absorbance lors de la prochaine séséance.
Preparation des solutions filles :
Avant de passer àà l'éétape de la dilution, nous avons complétécomplété la dissolution du SDS en remplissant au trait de jauge de la fiole jaugéjaugée avec de l'eau distillédistillée. MalgréMalgré les préprécautions et l'éélimination des bulles par bain ultrason, la formation de mousse éétait inéinévitable. Pour quantifier l'erreur dans la solution mèmère, nous avons mesurémesuré le volume de bulles dans celle-ci, en prenant en compte leur diamèdiamètre (2.5cm) et leur hauteur (1cm). Ces mesures seront intégréintégrées dans nos calculs finaux pour ajuster les volumes réréels des solutions préparépréparées.
Nous avons commencécommencé par prépréparer plusieurs solutions filles, en respectant rigoureusement les volumes àà préprélever (5 mL, 10 mL, 15mL, 20mL, 25mL, 30mL, 35mL, 40mL, 45mL) auxquelles nous avons ajoutéajouté de l'eau distillédistillée pour avoir un volume de 100 mL chacune. Pour garantir une préprécision maximale, nous avons ajoutéajouté l’l’eau distillédistillée trètrès dédélicatement jusqu’jusqu’au trait de jauge, afin d’éd’éviter la formation de bulles ou de mousse.
ÉÉlimination de la mousse
Afin de limiter les erreurs dues àà la mousse, nous avons placéplacé toutes les solutions filles dans un bain àà ultrasons. Cela a permis de réréduire la mousse préprésente sur les parois des bébéchers, mais certaines solutions en contenaient encore légèlégèrement aprèaprès traitement.
En conséconséquence, pour quelques solutions filles, le volume mesurémesuré a dépassédépassé légèlégèrement le trait de jauge, ce qui a entraînéentraîné une augmentation de la marge d’d’erreur dans les volumes finaux.
Mesure de la conductivitéconductivité
Une fois les solutions prêprêtes, nous avons débutédébuté les mesures de conductivitéconductivité. Avant cela, nous avons procédéprocédé àà la calibration du conductimèconductimètre àà l’l’aide de deux solutions éétalons. Chaque solution fille a étéété mesurémesurée deux fois avec les deux solutions éétalons, afin de garantir la precision des valeurs. Dans un premier temps, nous avons fait une sésérie de mesures aprèaprès l'éétalonnage de l'appareil avec du KCl (10^-5 M), σσ = 84μ84μS/cm. Puis, nous avons répétérépété la procéprocédure avec une deuxièdeuxième solution éétalon KCl (0.1M), σσ = 12.88 mS/cm.
Enfin, nous avons mesurémesuré la conductivitéconductivité de chaque solution fille. Toutes les valeurs obtenues ont étéété soigneusement noténotées en vue d’d’une comparaison et d’d’une analyse plus approfondie lors de la prochaine séséance.
- Solution
éétalon 1: KClσσ =84μ84μS/cm (10^-5M) - T=
25°25°C
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| 45.16 | 24.43 | 22.33 | 20.95 | 19.25 | 17.68 | 15.17 | 11.29 | 7.83 | 3.947 |
- Solution
éétalon: KClσσ = 12.88 mS/cm (0.1M) - T=
25°25°C
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| 2547 | 1363 | 1261 | 1186 | 1095 | 1011 | 843.4 | 631.5 | 442.4 | 221.8 |
Conclusion :
La prépréparation des solutions a étéété globalement réréussie, malgrémalgré quelques incertitudes liéliées àà la préprésence de mousse. Les mesures de conductivitéconductivité ont pu êêtre réaliséréalisées dans de bonnes conditions aprèaprès l’él’étalonnage de l’l’appareil. Lors de la prochaine séséance, nous poursuivrons l’l’analyse en mesurant l’l’absorbance des mêmêmes solutions, ce qui nous permettra de mieux caractécaractériser leur comportement.
TroisièTroisième séséance de FabLab
2 octobre 2025
Le protocole suivi pour cette partie:
MatéMatériel:
- 10
bébéchers de ~20 mL - Cuves jetables pour mesurer dans le
spectrophotomèspectrophotomètre SpectrophotomèSpectrophotomètre capable de mesurer 300-700 nm- Pipette
jaugéjaugée de 10 mL - Micropipette 500
μμL pourpréprélever le volume de PAN CôCône en plastique jetableBéBécher poubelleBéBécher pour verser les solutionsààpréprélever- Les 10 solutions filles
diluédiluée - Solution de PAN
- 10 pipettes pasteur
- Eau
distillédistillée
RéRéalisation des solutions de SDS contenant du pan:
-
ÉÉtiqueter 10 petitsbébéchers.PréPréleveràà l'aide d'une pipettejaugéjaugée (prépréalablementrincérincéàà l'eaudistillédistillé etàà la solution fille qui vaêêtreprélevéprélevée) 10mL de solution filles de SDS [préparépréparée lors de laséséance 1 ] dans unbébécher. -
Sous sorbonne,
prépréleveràà l'aide d'une micropipetteréglérégléàà500µ500µL ayantàà sonextrémitéextrémité uncôcône jetable en plastique, 500μμL de la solutionsaturésaturée de PAN [préparépréparé lors de laséséance 1 ] dans du cyclohexane. AjoutéAjouté ces500µ500µL de PAN aubébécher de solution de SDS.-
Agiter doucement
-
Sous sorbonne, laisser
éévaporer le cyclohexane ~ 20 min pour permettre ledédéveloppement de couleur. Siéévaporation trop lente, laissez plus longtemps - surtout ne pas chauffer directement. -
PréPréparer aussi untétémoin en faisant exactement lamêmême manipulation mais avec del’l’eauàà la place du SDS, laisseréévaporer. Cetétémoin servira de comparaison etàà mettreààzézéro lespectrophotomèspectrophotomètre [ il contient du PANtraitétraité de lamêmêmefaçfaçon mais sans SDS ]
Mesure d'absorbance:
L’L’un des objectifs de la mesure d'absorbance est de prouver expéexpérimentalement que les tensioactifs permettent effectivement de solubiliser un composécomposé initialement insoluble, dans l’l’eau. En effet grâgrâce àà cette manipulation il sera possible de visualiser ce phénomèphénomène àà la fois au niveau macroscopique (on passe de deux phases distinctes àà un mémélange unicolore) mais éégalement au niveau microscopique grâgrâce àà la dédétermination de la CMC par la suite.
Pour chaque solution fille:
- Allumer le
spectrophotomèspectrophotomètre,rérégler la longueurd’d’ondeàà 478 nm. - Remplir une cuve jetable avec le
tétémoin [préparépréparé ] afin de faire la miseààzézéro. PréPrélever la partie aqueuse du liquide du premierééchantillonàà la pipette pasteur, le verser dans la cuve puis ledédéposer dans lespectrophotomèspectrophotomètre de sorteàà ce que les faces lisses de la cuve soientparallèparallèles et en direction du faisceau.- [ Marquez le
cotécoté de la cuve au marqueurindéléindélébile pour garder lamêmême orientation et nommer tous lesééchantillons par la suite ] - Attendre la stabilisation de la lecture et noter
l’l’absorbance et latempétempératureaffichéaffichée. RéRéaliser 3répérépétitions [ jeter la cuve, remplir une nouvelle, replacer et mesureràà nouveau ] afind’d’enregistrer les valeurs A₁, A₂, A₃ et calculer la moyenne etl’él’écart-type afind’d’avoir une valeur plusprépréciseRépéRépéter pour toutes les solutions filles lemêmême processus, de la plusdiluédiluéeàà la plusconcentréconcentrée afin de ne pas semémélanger [ ou inversement ]
Objectif de la séséance :
Lors de cette séséance nous avons dans un premier temps, réréaliser les solutions àà analyser par absorbance constituéconstitué de solution fille de tensioactif SDS avec un ajout de PAN colorant orange insoluble dans l'eau. Puis dans un second temps, nous sommes passépassé àà l'analyse de mesure d'absorbance par spectrophotoméspectrophotométrie de ces solutions.
Traitement des donnédonnées pour dédétermination de la CMC par conductivitéconductivité :
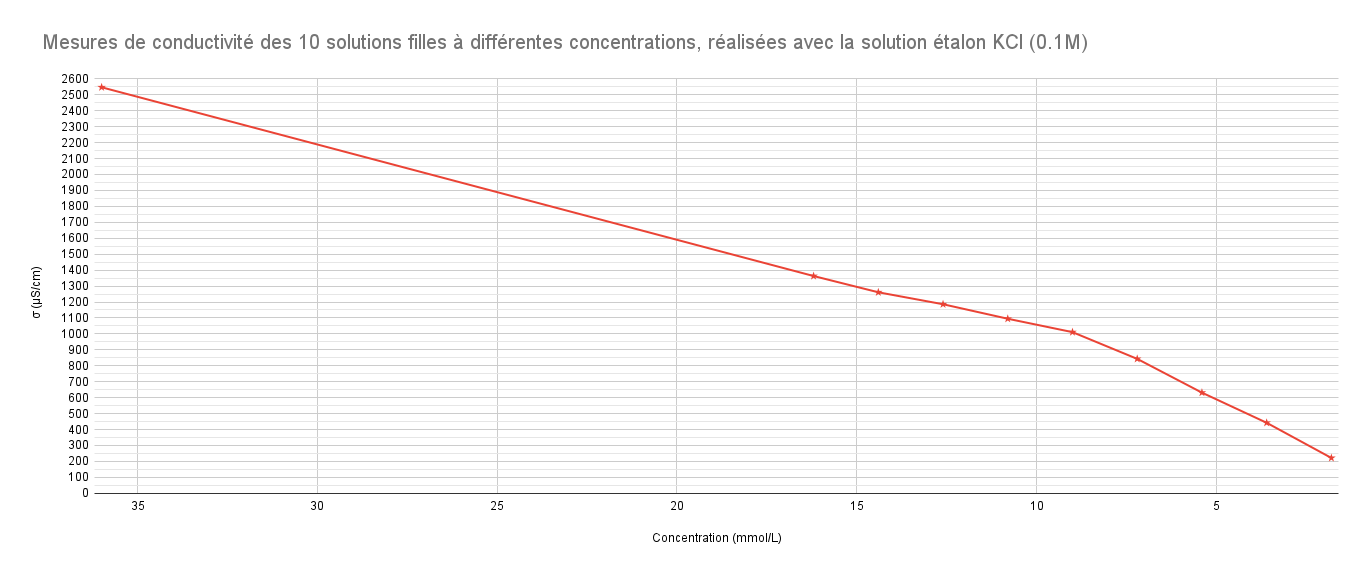
Nous avons éégalement amélioréamélioré la repréreprésentation graphique des valeurs de conductivitéconductivité. Pour chaque sésérie de valeurs mesurémesurée aprèaprès callibration avec une solution éétalon (KCl 0.1M ou 10^-5M), on constate que sur la repréreprésentation graphique, le point de pivot de la courbe correspond àà la conductivitéconductivité de la solution àà 9 mmol/L. Bien que les valeurs diffèdiffèrent avec calibrage d'une solution éétalon àà l'autre, on peut voir qu'elles sont toujours exploitables et permettent de dédéterminer la CMC.
Pour cela, on obtient un graphique avec l'allure de deux droites qui se coupent en un point, l'abscisse x de ce dernier correspond alors àà la CMC. Nous devons alors éévaluer quelle serait la "meilleure courbe" àà prendre en compte en faisant apparaitre ou non sur l'une des deux droite la conductivitéconductivité de la solution àà 9 mmol/L. Un outil qui nous permet d'éévaluer ce point est le R^2, plus il est proche de 1, plus le modèmodèle de rérégression est préprécis.
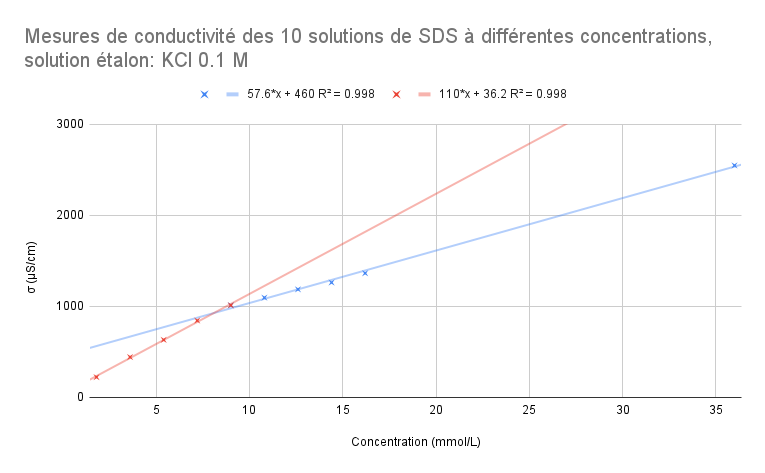
Pour les mesures réaliséréalisées aprèaprès calibrage avec la solution éétalon KCl σσ = 12.88 mS/cm (0.1M):
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentration (mmol/L) | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
| 2547 | 1363 | 1261 | 1186 | 1095 | 1011 | 843.3 | 631.5 | 442.4 | 221.8 |
Pour ce graphique, le point àà 9 mmol/L fait partie de la droite rouge et de la droite bleue. On peut voir que R^2 est aussi assez proche de 1 donc nos valeurs sont cohécohérentes avec le modèmodèle de rérégression linélinéaire. En mettant en ééquation les deux ééquations de droite, on obtient:
57.6x + 460 = 110x +36.2
x = 8.09 mmol/L
- Si on
enlèenlève le pointàà 9 mmol/L de la droite en rouge, on a R^2=0.998 et R^2=0.999
57.6x + 460 = 114x + 21.3
x = 8.37 mmol/L - Si on
enlèenlève le pointàà 9 mmol/L de la droite en bleu, on a R^2=0.999 et R^2=0.998
58.3x + 441 = 110x + 36.2
x = 7.83 mmol/L
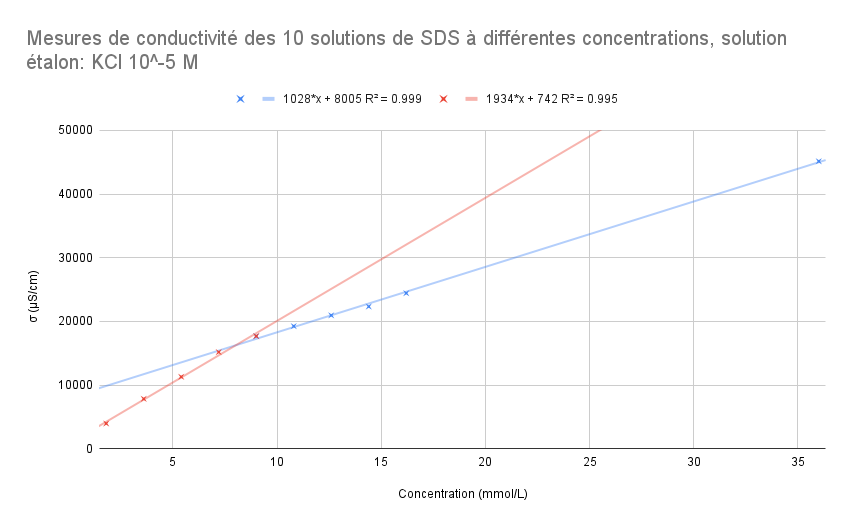
Pour les mesures réaliséréalisées aprèaprès calibrage avec la solution éétalon KCl σσ = 84μ84μS/cm (10^-5M):
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentration (mmol/L) | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
| 45160 | 24430 | 22330 | 20950 | 19250 | 17680 | 15170 | 11290 | 7830 | 3947 |
Pour ce graphique, le point àà 9 mmol/L fait partie de la droite rouge et de la droite bleue.En mettant en ééquation les deux ééquations de droite, on obtient:
1028x + 8005 = 1934x +742
x = 8.02 mmol/L
- Si on
enlèenlève le pointàà 9 mmol/L de la droite en rouge, on a R^2=0.999 et R^2=0.999
1028x + 8005 = 2063x + 277
x = 7.47 mmol/L - Si on
enlèenlève le pointàà 9 mmol/L de la droite en bleu, on a R^2=0.999 et R^2=0.995
1037x + 7758 = 1934x +742
x = 7.82 mmol/L
Conclusion:
On sait que la valeur théthéorique de la CMC du SDS est àà 8.2 mmol/L. On choisira le modèmodèle de rérégression pour lequel l'abscisse de l'intersection des deux droites sera le plus proche de cette valeur. On a alors:
|
Solution |
Solution |
|
57.6x + 460 = 110x +36.2 |
1028x + 8005 = 1934x +742 x = 8.02 mmol/L |
  |
Traitement des donnédonnées pour dédétermination de la CMC par l’l’absorbance
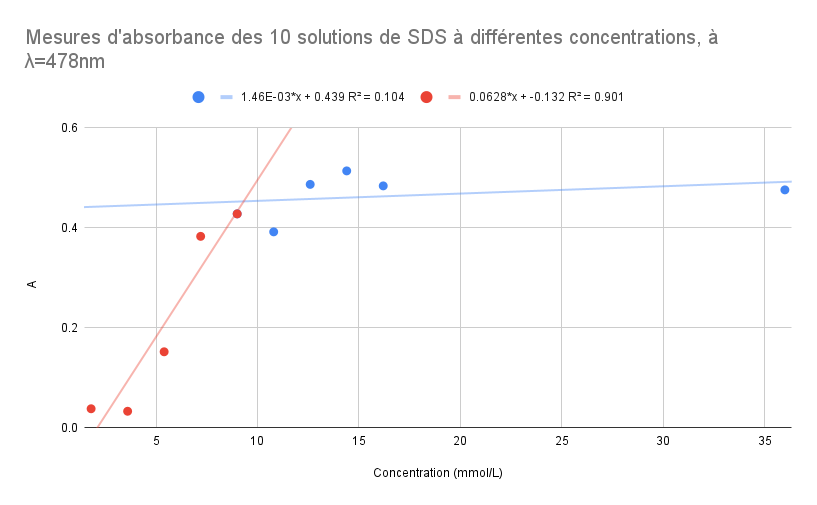
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentration (mmol/L) | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
| Absorbance | 0.476 | 0.484 | 0.514 | 0.487 | 0.392 | 0.428 | 0.383 | 0.152 | 0.033 | 0.038 |
Par le mêmême raisonnement, on va ajuster le point àà 9mmol/L pour obtenir le modèmodèle de rérégression le plus préprécis et cohécohérent avec la valeur théthéorique.
Pour ce graphique, le point àà 9 mmol/L fait partie de la droite rouge et de la droite bleue.En mettant en ééquation les deux ééquations de droite, on obtient:
1.46E-03*x + 0.439 = 0.0628*x + -0.132
x = 9.30 mmol/L
- Si on
enlèenlève le pointàà 9 mmol/L de la droite en rouge, on a R^2=0.104 et R^2=0.827
1.46E-03*x + 0.439 = 0.0641*x + -0.137
x = 9.20 mmol/L - Si on
enlèenlève le pointàà 9 mmol/L de la droite en bleu, on a R^2=0.043 et R^2=0.901
9.36E-04*x + 0.454 = 0.0628*x + -0.132
x = 9.47 mmol/L
Conclusion:
On peut voir sur le graphique et aussi àà partir de notre R^2 que notre modèmodèle de rérégression n'est pas préprécis. Les points de mesures ne sont pas bien alignéalignés pour bien dédéterminer le point de pivot et par conséconséquent la CMC. La rérésolution des ééquations de droite nous donne aussi une valeur de CMC qui n'est pas proche de la valeur théthéorique. Pour cela, nous proposons de refaire les mesures d'absorbances lors de la prochaine séséance afin d'améaméliorer notre rérésultat.
La Quatrième Séance de FabLab
06/10/2025
Lors de cette séance nous avons divisé le groupe en deux, trois d'entre nous: Anh, Mariam et Lilia on refait les mesures d'absorbance pendant que les trois autres: Irem, Sophie et Alae on commencer à rédiger le compte rendus. Les mesures ont été réaliser en suivant le même protocole qu'à la séance précédente et répété trois fois.
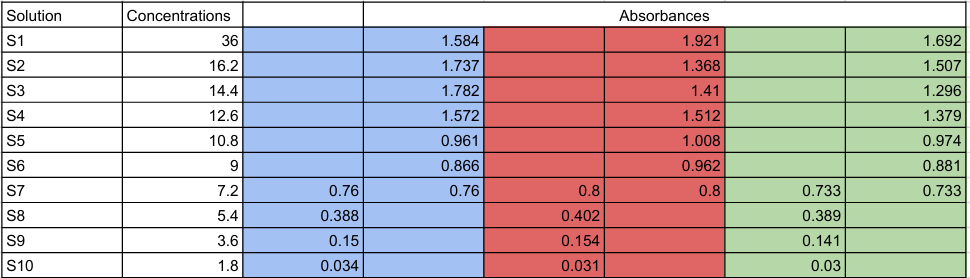
Voici les mesures obtenue à l'issue des trois expériences:
Valeur de la CMC pour les différentes mesures
bleu:x≈11,16mmol/L
rouge:x≈9,75mmol/L
vert:x≈10,11mmol/L
Les CMC obtenus sont moins proche de la valeur théorique que celle obtenue lors de la séance précédente qui est de 9.30 mmol/L , cela peut être due a la durée écoulé entre la réalisation des solutions filles et les mesures.