Groupe 4 - Action solubilisant des tensioactifs
Liste des participants :
- Mariam El Nagar - Mariam.El_Nagar@etu.sorbonne-universite.fr
- Irem Janset Ersan - Irem_Janset.Ersan@etu.sorbonne-universite.fr
- Lilia Hadoum - Lilia.Hadoum@etu.sorbonne-universite.fr
- Phuong Anh Ho - Phuong_Anh.Ho@etu.sorbonne-universite.fr
- Sophie Yu-Can Huang - Sophie_Yu-Can.Huang@etu.sorbonne-universite.fr
- Alae khelladi - Alae.Khelladi@etu.sorbonne-universite.fr
La Première Séance de FabLab
25 Septembre 2025
Démarche :
Nous cherchons à mettre en évidence expérimentalement l'influence de la concentration en tensioactif, en particulier le SDS (molécule à caractère amphiphile, avec une tête hydrophile ionique et une queue hydrophobe, qui permet de piéger des molécules ex: salissures, insolubles dans l’eau) sur la capacité de la solution à solubiliser une espèce insoluble dans l'eau.
Pour mettre en évidence ce phénomène, nous prendrons comme modèle de salissure une molécule de couleur orange (585-620nm): le 1- (2-pyridyl azo)-2-naphthol (PAN). En absence du tensioactif, on s’attend à 2 phases (phase aqueuse et phase insoluble colorée). En revanche, en présence de celui-ci, l’action solubilisante devrait permettre le mélange des deux phases et on devrait obtenir une solution colorée.
Pour quantifier la part de PAN passent en phase aqueuse, nous réaliserons les mesures d'absorbance (λ~450-490 nm, complémentaire au orange). Si le colorant est non solubilisé, on s’attend à mesurer une faible absorbance de la phase aqueuse et inversement, une augmentation de celle-ci si le colorant se solubilise grâce au tensioactif, lors de la formation des premières micelles. Nous préparerons plusieurs solutions de concentrations différentes en tensioactifs dans lesquelles nous introduirons du colorant PAN puis nous mesurerons l’absorbance de la phase aqueuse afin de quantifier la quantité de PAN passée en phase aqueuse . Grâce à cette première expérience, nous pourrons déterminer la CMC (= la concentration en tensioactif dans un milieu au-dessus de laquelle des micelles se forment spontanément) du tensioactif appelé SDS [dodécylsulfate de sodium], par mesure d’absorbance et de conductivité. Les mesures nous permettront de tracer deux graphiques représentant l’évolution de l’absorbance ou de la conductivité en fonction de la concentration en SDS afin de trouver quantitativement la valeur la plus précise de CMC du SDS.
Nous avons fait 2 groupes de 3:
Groupe de dissolution de SDS :
- Sophie
- Anh
- Mariam
Les matériaux utilisés par le groupe
- SDS en poudre
- De l'eau distillée
- Gants (car SDS et solvants sont irritants)
- Lunettes et blouses
- 1 fiole jaugée de 1L pour la solution mère de SDS
- Balance de précision
- Entonnoir
- Spatule métallique
- Des béchers poubelles
Le protocole suivi pour cette partie:
[ préparation de la solution mère ]
On prend la masse molaire de (SDS) : 288,38 g/mol
-
Peser 10.368 g de SDS à l’aide d’une balance de précision et d’une capsule à peser pour avoir 1L de solution mère de 36 mmol.L-1 . (Nb: Masse réelle de SDS prélevée = 10.3601g)
-
Avec un entonnoir, verser le SDS prélevé dans la fiole jaugée contenant déjà un fond d'eau.
-
Rincer avec de l’eau distillée la capsule et l’entonnoir afin de récupérer le maximum de soluté.
-
Introduire dans la fiole jaugée d’abord environ 800 mL d’eau distillée pour bien agiter et dissoudre le SDS complètement. Une fois dissous, compléter le volume à 1L avec de l’eau distillée à l’aide d’une pipette pasteur.
-
Boucher et homogénéiser le tout.
Groupe de dissolution de PAN:
- Irem
- Lilia
- Alae
Les matériaux utilisés par le groupe
- Colorant PAN en poudre
- Solvant pour le PAN: cyclohexane
- Gants
- Lunettes et blouse
- Spatule métallique
- Entonnoir
- Balance de précision
- 1 fiole de 100 mL pour le PAN
- Capsule à peser
- Un bécher poubelle
Le protocole suivi pour cette partie:
Afin de réaliser une solution de 100mL de PAN saturée à ~1,6 × 10⁻³.
On prend la masse molaire de (PAN) : 249,27 g/mol.
-
A l’aide d’une balance de précision, d’une capsule de pesée et d’une spatule métallique peser une masse 0,04 g de PAN solide
-
Poser la capsule de pesée sur la balance et effectuer la tare
-
A l’aide de la spatule métallique peser 0,04 g de PAN
-
Verser un fond de cyclohexane dans la fiole jaugée de 100 ml
-
A l'aide de l'entonnoir, transférer cette masse dans la fiole jaugée, prendre soin de rincer au cyclohexane la capsule de pesée et l’entonnoir afin de récupérer le soluté dans la fiole jaugée.
-
Ajouter du cyclohexane dans la fiole jaugée jusqu’aux ⅔ puis agiter par rotation pour favoriser la dissolution du solide.
-
Compléter la fiole avec du cyclohexane jusqu’au trait de jauge.
-
Boucher la fiole et homogénéiser par retournement.
Résumé de la première séance:
Pendant cette première séance de FabLab nous avons pu dissoudre le PAN dans le cyclohexane et préparer la solution mère de SDS à partir des groupes de 3. La préparation de la solution mère a pris du temps car le SDS a formé de la mousse donc l'étape de la dissolution n'était pas complète. Lors de la préparation de la solution mère de SDS, l’agitation de la solution a entraîné la formation de mousse. Afin d’éviter ce phénomène, il aurait été préférable d’ajouter l’eau progressivement et sous agitation douce. L’utilisation d’un bain à ultrasons a pu faciliter la dissolution sans générer de mousse excessive. Nous allons également utiliser une autre technique en éclatant les bulles avec une spatule fine en ajoutant de l'eau distillée sur les bords. Nous allons préparer les solutions filles pendant la prochaine séance en utilisant des pipettes graduées plutôt que des pipettes jaugées pour plus de facilité pendant la pratique.
La Deuxième Séance de FabLab
29 Septembre 2025
Le protocole suivi pour cette partie:
Les matériaux:
- Fiole jaugée 1L contenant la solution mère de SDS
- 2 Béchers (1 pour la solution mère + 1 bécher poubelle)
- 10 fioles jaugées de 100mL
- Pipettes graduées
- Pipettes pasteur
- Eau distillée
Tableau pour la dilution de SDS [ préparation des solutions filles ]
Solutions |
S1 (solution mère) |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
S8 |
S9 |
S10 |
|
Vmère à prélever (mL) |
0 |
45
|
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
Concentration fille (mmol/L) |
36 (cmère) |
16.2 |
14.4 |
12.6 |
10.8 |
9 |
7.2 |
5.4 |
3.6 |
1.8 |
|
Concentration avec la masse de SDS prélevée (=10.3601g) |
35.93 |
16.17 |
14.37 |
12.58 |
10.78 |
8.98 |
7.19 |
5.39 |
3.59 |
1.79 |
-
Prélever Vmère (cf. tableau) de la solution mère à l’aide d’une pipette jaugée et d’une poire à pipeter.
-
Introduire la solution prélevée dans la fiole jaugée de 100mL.
-
Remplir avec de l’eau distillée jusqu’à ⅓ de la fiole.
-
Boucher et agiter.
-
Compléter au trait de jauge avec une pipette pasteur.
-
Boucher et homogénéiser.
-
Répéter les mêmes étapes pour toutes les autres solutions filles [ faire attention à bien étiqueter et nommer les solutions (S1, S2,…) pour éviter les confusions lors des manipulations ]
Mesures de conductivité - protocole détaillé
La conductivité est une technique couramment utilisée pour déterminer la CMC des tensioactifs ioniques comme le SDS, qui se comporte comme les électrolytes dans l’eau. Cette technique ne peut pas être appliquée aux tensioactifs non ioniques car ceux-ci ont un effet négligeable sur la conductivité de la solution.
Les matériaux:
- 10 béchers de 50mL
- 10 solutions filles (S1, S2,...S10)
- Eau distillée
- Papier absorbant
- 2 solutions étalon KCl de concentrations 10^-5M et 0.1M
- Conductimètre
Préparation avant mesures - calibration du conductimètre [ sauf si il est déjà calibré ]
-
Rincer la sonde à l’eau distillée, essuyer délicatement, sans frotter avec du papier
-
Réaliser la calibration de deux solutions étalons : immerger dans la solution étalon 1, attendre que la valeur se stabilise et rincer de nouveau l’électrode à l’eau distillée. Immerger dans la solution étalon 2, et refaire les étapes précédentes de nouveau.
-
Vérifier que la compensation automatique de température est active [ T à 25 °C si possible ]
-
Rincer de nouveau l’électrode à l’eau distillée avant de passer aux mesures.
Mesure [ pour chaque solution fille ]
-
Transférer 40 ou 50 mL de solution SDS dans un bécher propre.
-
Rincer la sonde dans de l’eau distillée puis dans une petite portion de l’échantillon.
-
Immerger la sonde dans le bécher sans toucher les parois, agiter doucement pour homogénéiser et éviter les bulles d’air autour des électrodes.
-
Attendre la stabilisation de la lecture et noter la conductivité [ µS·cm⁻¹ ] et la température affichée.
-
Faire 3 mesures successives [ rincer la sonde entre chaque ] et garder la moyenne ± écart-type afin d’avoir une valeur plus précise.
-
Répéter pour toutes les solutions filles le même processus, de la plus diluée à la plus concentrée afin de ne pas se mélanger [ ou inversement ]
Objectif de la séance :
Lors de cette séance, nous avons préparé une série de solutions filles à partir d'une solution mère, en vue de mesurer leur conductivité. L’objectif final sera de mesurer également l’absorbance lors de la prochaine séance.
Preparation des solutions filles :
Avant de passer à l'étape de la dilution, nous avons complété la dissolution du SDS en remplissant au trait de jauge de la fiole jaugée avec de l'eau distillée. Malgré les précautions et l'élimination des bulles par bain ultrason, la formation de mousse était inévitable. Pour quantifier l'erreur dans la solution mère, nous avons mesuré le volume de bulles dans celle-ci, en prenant en compte leur diamètre (2.5cm) et leur hauteur (1cm). Ces mesures seront intégrées dans nos calculs finaux pour ajuster les volumes réels des solutions préparées.
Nous avons commencé par préparer plusieurs solutions filles, en respectant rigoureusement les volumes à prélever (5 mL, 10 mL, 15mL, 20mL, 25mL, 30mL, 35mL, 40mL, 45mL) auxquelles nous avons ajouté de l'eau distillée pour avoir un volume de 100 mL chacune. Pour garantir une précision maximale, nous avons ajouté l’eau distillée très délicatement jusqu’au trait de jauge, afin d’éviter la formation de bulles ou de mousse.
Élimination de la mousse
Afin de limiter les erreurs dues à la mousse, nous avons placé toutes les solutions filles dans un bain à ultrasons. Cela a permis de réduire la mousse présente sur les parois des béchers, mais certaines solutions en contenaient encore légèrement après traitement.
En conséquence, pour quelques solutions filles, le volume mesuré a dépassé légèrement le trait de jauge, ce qui a entraîné une augmentation de la marge d’erreur dans les volumes finaux.
Mesure de la conductivité
Une fois les solutions prêtes, nous avons débuté les mesures de conductivité. Avant cela, nous avons procédé à la calibration du conductimètre à l’aide de deux solutions étalons. Chaque solution fille a été mesurée deux fois avec les deux solutions étalons, afin de garantir la precision des valeurs. Dans un premier temps, nous avons fait une série de mesures après l'étalonnage de l'appareil avec du KCl (10^-5 M), σ = 84μS/cm. Puis, nous avons répété la procédure avec une deuxième solution étalon KCl (0.1M), σ = 12.88 mS/cm.
Enfin, nous avons mesuré la conductivité de chaque solution fille. Toutes les valeurs obtenues ont été soigneusement notées en vue d’une comparaison et d’une analyse plus approfondie lors de la prochaine séance.
- Solution étalon 1: KCl σ = 84μS/cm (10^-5M)
- T= 25°C
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| σ (mS/cm) | 45.16 | 24.43 | 22.33 | 20.95 | 19.25 | 17.68 | 15.17 | 11.29 | 7.83 | 3.947 |
- Solution étalon: KCl σ = 12.88 mS/cm (0.1M)
- T= 25°C
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| σ (μS/cm) | 2547 | 1363 | 1261 | 1186 | 1095 | 1011 | 843.4 | 631.5 | 442.4 | 221.8 |
Conclusion :
La préparation des solutions a été globalement réussie, malgré quelques incertitudes liées à la présence de mousse. Les mesures de conductivité ont pu être réalisées dans de bonnes conditions après l’étalonnage de l’appareil. Lors de la prochaine séance, nous poursuivrons l’analyse en mesurant l’absorbance des mêmes solutions, ce qui nous permettra de mieux caractériser leur comportement.
Troisième séance de FabLab
2 octobre 2025
Le protocole suivi pour cette partie:
Matériel:
- 10 béchers de ~20 mL
- Cuves jetables pour mesurer dans le spectrophotomètre
- Spectrophotomètre capable de mesurer 300-700 nm
- Pipette jaugée de 10 mL
- Micropipette 500 μL pour prélever le volume de PAN
- Cône en plastique jetable
- Bécher poubelle
- Bécher pour verser les solutions à prélever
- Les 10 solutions filles diluée
- Solution de PAN
- 10 pipettes pasteur
- Eau distillée
Réalisation des solutions de SDS contenant du pan:
-
Étiqueter 10 petits béchers. Prélever à l'aide d'une pipette jaugée (préalablement rincé à l'eau distillé et à la solution fille qui va être prélevée) 10mL de solution filles de SDS [ préparée lors de la séance 1 ] dans un bécher.
-
Sous sorbonne, prélever à l'aide d'une micropipette réglé à 500µL ayant à son extrémité un cône jetable en plastique, 500 μL de la solution saturée de PAN [ préparé lors de la séance 1 ] dans du cyclohexane.
- Ajouté ces 500µL de PAN au bécher de solution de SDS.
-
Agiter doucement
-
Sous sorbonne, laisser évaporer le cyclohexane ~ 20 min pour permettre le développement de couleur. Si évaporation trop lente, laissez plus longtemps - surtout ne pas chauffer directement.
-
Préparer aussi un témoin en faisant exactement la même manipulation mais avec de l’eau à la place du SDS, laisser évaporer. Ce témoin servira de comparaison et à mettre à zéro le spectrophotomètre [ il contient du PAN traité de la même façon mais sans SDS ]
Mesure d'absorbance:
L’un des objectifs de la mesure d'absorbance est de prouver expérimentalement que les tensioactifs permettent effectivement de solubiliser un composé initialement insoluble, dans l’eau. En effet grâce à cette manipulation il sera possible de visualiser ce phénomène à la fois au niveau macroscopique (on passe de deux phases distinctes à un mélange unicolore) mais également au niveau microscopique grâce à la détermination de la CMC par la suite.
Pour chaque solution fille:
- Allumer le spectrophotomètre, régler la longueur d’onde à 478 nm.
- Remplir une cuve jetable avec le témoin [ préparé ] afin de faire la mise à zéro.
- Prélever la partie aqueuse du liquide du premier échantillon à la pipette pasteur, le verser dans la cuve puis le déposer dans le spectrophotomètre de sorte à ce que les faces lisses de la cuve soient parallèles et en direction du faisceau.
- [ Marquez le coté de la cuve au marqueur indélébile pour garder la même orientation et nommer tous les échantillons par la suite ]
- Attendre la stabilisation de la lecture et noter l’absorbance et la température affichée.
- Réaliser 3 répétitions [ jeter la cuve, remplir une nouvelle, replacer et mesurer à nouveau ] afin d’enregistrer les valeurs A₁, A₂, A₃ et calculer la moyenne et l’écart-type afin d’avoir une valeur plus précise
- Répéter pour toutes les solutions filles le même processus, de la plus diluée à la plus concentrée afin de ne pas se mélanger [ ou inversement ]
Objectif de la séance :
Lors de cette séance nous avons dans un premier temps, réaliser les solutions à analyser par absorbance constitué de solution fille de tensioactif SDS avec un ajout de PAN colorant orange insoluble dans l'eau. Puis dans un second temps, nous sommes passé à l'analyse de mesure d'absorbance par spectrophotométrie de ces solutions.
Traitement des données pour détermination de la CMC par conductivité :
Nous avons également amélioré la représentation graphique des valeurs de conductivité. Pour chaque série de valeurs mesurée après callibration avec une solution étalon (KCl 0.1M ou 10^-5M), on constate que sur la représentation graphique, le point de pivot de la courbe correspond à la conductivité de la solution à 9 mmol/L. Bien que les valeurs diffèrent avec calibrage d'une solution étalon à l'autre, on peut voir qu'elles sont toujours exploitables et permettent de déterminer la CMC.
Pour cela, on obtient un graphique avec l'allure de deux droites qui se coupent en un point, l'abscisse x de ce dernier correspond alors à la CMC. Nous devons alors évaluer quelle serait la "meilleure courbe" à prendre en compte en faisant apparaitre ou non sur l'une des deux droite la conductivité de la solution à 9 mmol/L. Un outil qui nous permet d'évaluer ce point est le R^2, plus il est proche de 1, plus le modèle de régression est précis.
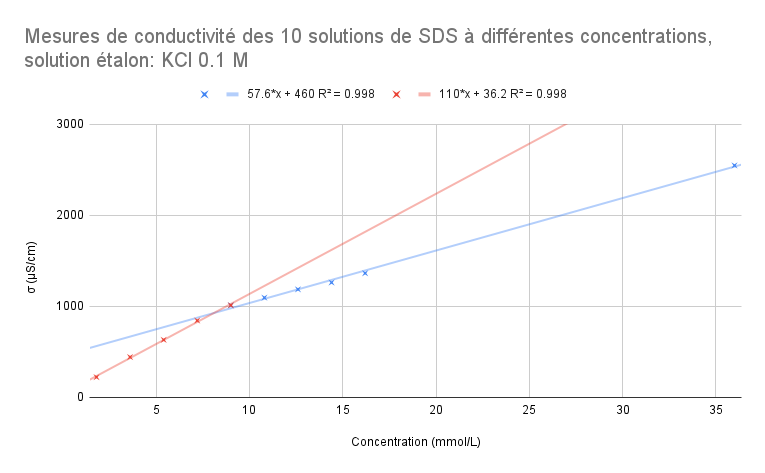
Pour les mesures réalisées après calibrage avec la solution étalon KCl σ = 12.88 mS/cm (0.1M):
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentration (mmol/L) | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
| σ (μS/cm) - Étalon KCl (0.1M) | 2547 | 1363 | 1261 | 1186 | 1095 | 1011 | 843.3 | 631.5 | 442.4 | 221.8 |
Pour ce graphique, le point à 9 mmol/L fait partie de la droite rouge et de la droite bleue. On peut voir que R^2 est aussi assez proche de 1 donc nos valeurs sont cohérentes avec le modèle de régression linéaire. En mettant en équation les deux équations de droite, on obtient:
57.6x + 460 = 110x +36.2
x = 8.09 mmol/L
- Si on enlève le point à 9 mmol/L de la droite en rouge, on a R^2=0.998 et R^2=0.999
57.6x + 460 = 114x + 21.3
x = 8.37 mmol/L - Si on enlève le point à 9 mmol/L de la droite en bleu, on a R^2=0.999 et R^2=0.998
58.3x + 441 = 110x + 36.2
x = 7.83 mmol/L
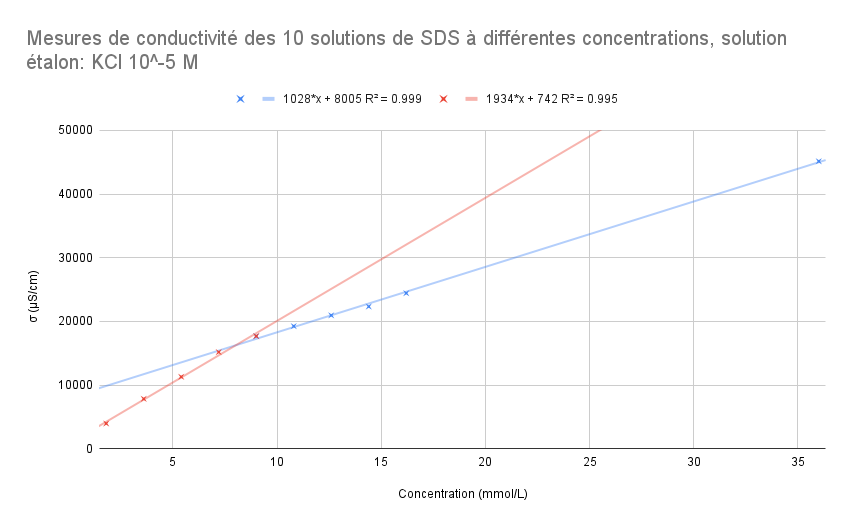
Pour les mesures réalisées après calibrage avec la solution étalon KCl σ = 84μS/cm (10^-5M):
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentration (mmol/L) | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
| σ (μS/cm) - Étalon KCl (10^-5M) | 45160 | 24430 | 22330 | 20950 | 19250 | 17680 | 15170 | 11290 | 7830 | 3947 |
Pour ce graphique, le point à 9 mmol/L fait partie de la droite rouge et de la droite bleue.En mettant en équation les deux équations de droite, on obtient:
1028x + 8005 = 1934x +742
x = 8.02 mmol/L
- Si on enlève le point à 9 mmol/L de la droite en rouge, on a R^2=0.999 et R^2=0.999
1028x + 8005 = 2063x + 277
x = 7.47 mmol/L - Si on enlève le point à 9 mmol/L de la droite en bleu, on a R^2=0.999 et R^2=0.995
1037x + 7758 = 1934x +742
x = 7.82 mmol/L
Conclusion:
On sait que la valeur théorique de la CMC du SDS est à 8.2 mmol/L. On choisira le modèle de régression pour lequel l'abscisse de l'intersection des deux droites sera le plus proche de cette valeur. On a alors:
|
Solution étalon σ = 12.88 mS/cm (0.1M) |
Solution étalon KCl σ = 84μS/cm (10^-5M) |
|
57.6x + 460 = 110x +36.2 |
1028x + 8005 = 1934x +742 x = 8.02 mmol/L |
 |
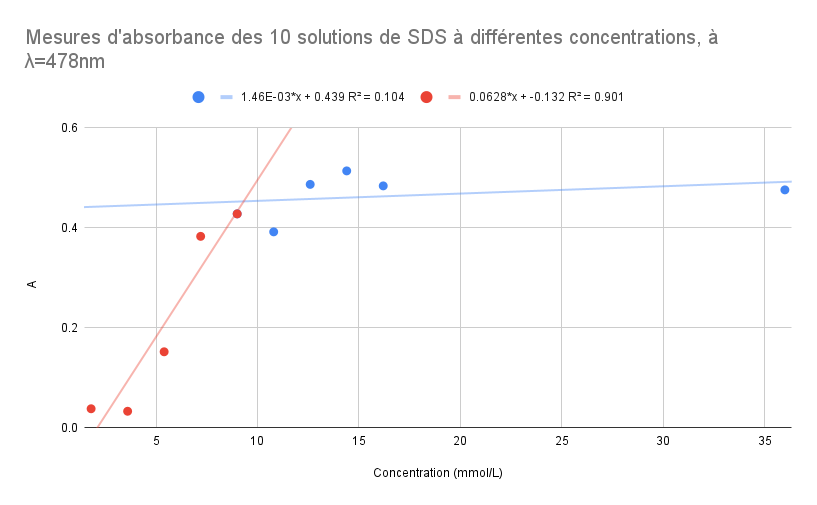
Traitement des données pour détermination de la CMC par l’absorbance
| Solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentration (mmol/L) | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
| Absorbance | 0.476 | 0.484 | 0.514 | 0.487 | 0.392 | 0.428 | 0.383 | 0.152 | 0.033 | 0.038 |
Par le même raisonnement, on va ajuster le point à 9mmol/L pour obtenir le modèle de régression le plus précis et cohérent avec la valeur théorique.
Pour ce graphique, le point à 9 mmol/L fait partie de la droite rouge et de la droite bleue.En mettant en équation les deux équations de droite, on obtient:
1.46E-03*x + 0.439 = 0.0628*x + -0.132
x = 9.30 mmol/L
- Si on enlève le point à 9 mmol/L de la droite en rouge, on a R^2=0.104 et R^2=0.827
1.46E-03*x + 0.439 = 0.0641*x + -0.137
x = 9.20 mmol/L - Si on enlève le point à 9 mmol/L de la droite en bleu, on a R^2=0.043 et R^2=0.901
9.36E-04*x + 0.454 = 0.0628*x + -0.132
x = 9.47 mmol/L
Conclusion:
On peut voir sur le graphique et aussi à partir de notre R^2 que notre modèle de régression n'est pas précis. Les points de mesures ne sont pas bien alignés pour bien déterminer le point de pivot et par conséquent la CMC. La résolution des équations de droite nous donne aussi une valeur de CMC qui n'est pas proche de la valeur théorique. Pour cela, nous proposons de refaire les mesures d'absorbances lors de la prochaine séance afin d'améliorer notre résultat.
La Quatrième Séance de FabLab
06/10/2025
Lors de cette séance nous avons divisé le groupe en deux, trois d'entre nous: Anh, Mariam et Lilia ont refait les mesures d'absorbance pendant que les trois autres: Irem, Sophie et Alae ont commencé à rédiger le compte rendu. Les mesures ont été réaliser en suivant le même protocole qu'à la séance précédente et répété trois fois.
Voici les mesures obtenue à l'issue des trois expériences:
| solutions | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 |
| Concentrations | 36 | 16.2 | 14.4 | 12.6 | 10.8 | 9 | 7.2 | 5.4 | 3.6 | 1.8 |
|
Absorbance
|
1.584 | 1.737 | 1.782 | 1.572 | 0.961 | 0.866 | 0.76 | 0.388 | 0.15 | 0.034 |
| 1.921 | 1.368 | 1.41 | 1.512 | 1.008 | 0.962 | 0.8 | 0.402 | 0.154 | 0.031 | |
| 1.692 | 1.507 | 1.296 | 1.379 | 0.974 | 0.881 | 0.733 | 0.389 | 0.141 | 0.03 |
Rem: Pour ce graphique, les points de même couleur représentent une série de mesures. Les droites de même couleur indiquent la régression linéaire appliquée séparément aux données avant et après la CMC
Valeur de la CMC pour les différentes mesures
bleu:x≈11,16mmol/L
rouge:x≈9,75mmol/L
vert:x≈10,11mmol/L
Conclusion: Nous avons voulu refaire les mesures d'absorbance afin d'améliorer nos valeurs expérimentales. Cependant, les CMC obtenus sont moins proche de la valeur théorique que celle obtenue lors de la séance précédente qui est de 9.30 mmol/L, cela peut être due a la durée écoulée entre la réalisation des solutions filles et les mesures.



No Comments