Groupe 5 - Séparation de deux constituants d'un mélange
Liste des participants :
- Katia Bourcier - Katia.Bourcier@etu.sorbonne-universite.fr
- Umberto-Gédéon Detomassi - Umberto-Gedeon.Detomasi@etu.sorbonne-universite.fr
- Emma Dujardin - Emma.Dujardin@etu.sorbonne-universite.fr
- Lucas Guittin Zayas - Lucas.Guittin--Zayas@etu.sorbonne-universite.fr
- Meryem Habel - Meryem.Habel@etu.sorbonne-universite.fr
- Immene Sophia Mokhtari - Immene_Sophia.Mokhtari@etu.sorbonne-universite.fr
Compte rendu fablab projet 5
Projet n°5: Séparation de deux constituants d’un mélange
Objectif de l’expérience:
Dans cette expérience, nous tentons de séparer deux solutions colorées mélangées, une bleue et une rouge, en fonction de leur affinité avec des tensioactifs chargés électriquement. En effet, nous préparerons une solution aqueuse de colorant rouge (Rouge allura, chargé négativement) et une solution aqueuse de colorant bleu (Bleu de méthylène, chargé positivement) que nous mélangerons ensemble dans deux béchers et tenterons de séparer. Les tensioactifs en question seront le CTAB (chargé positivement) et le SDS (chargé négativement), chacun réagira avec le colorant de charge opposée en formant des bulles colorées, laissant la solution colorée non compatible électriquement derrière. Ainsi, les deux solutions restantes seront rouge et bleue et, théoriquement, devraient avoir la même absorbance que les solutions initiales. Pour raisons de confort au niveau de la lecture des spectres d’absorbance, nous choisirons de concentrer nos solutions de manière à obtenir une absorbance aux alentours de 1, aux longueurs d’onde respectives pour les solutions colorées individuelles et aux DEUX longueurs d’onde (625nm et 525nm) pour le mélange.
Séance 1: Préparation des mélanges, 25/09/2025
Lors de cette séance nous nous sommes concentrés sur la préparation des solutions dont nous aurons besoin lors de l’expérience, à savoir deux solutions de tensio-actifs (CTAB et SDS) et deux solutions de colorants (rouge allura et bleu de méthylène). Nous avons formé plusieurs petits groupes pour se répartir les tâches en ce jour:
- Lucas GUITTIN-ZAYAS et Umberto-Gédéon DETOMASI se sont occupés de préparer la solution de rouge allura
- Emma DUJARDIN s’est occupée de préparer les solutions de tensio-actifs
- Immene Sophia MOKHTARI et Meryem HABEL se sont occupées de préparer la solution de bleu de méthylène
Chacun des participants s'est occupé de prendre des clichés de leurs manipulations.
Préparation du bleu de méthylène :
- Étalonnage du spectrophotomètre à 625nm
- Verser 50 mL d’eau distillée dans un bécher et quelques gouttes de colorant bleu dans un autre bécher. Nous prélèverons le colorant directement dans ce bécher.
- Ajouter 20μL de colorant à la micro-pipette, mélanger
- Mesurer l’absorbance à λ=625 nm et ajuster la concentration du colorant
- Si l’absorbance est inférieure à 1, ajouter des gouttes de colorant bleu, si supérieure, ajouter de l’eau distillée afin d'avoir une absorbance égale ou proche de 1
- Réaliser le spectre de la solution de bleu dans le domaine visible (400-800nm)
Nous avons fait plusieurs mélanges test avant d’aboutir à une bonne concentration.
- Test 1 :
Préparation 1: 10 mL d’eau distillée + 1 goutte de bleu de méthylène à la pipette pasteur
Résultat : A = 3,42 à 625 nm → La solution est trop concentrée.
- Test 2:
Préparation 2: 20 mL d’eau distillée + 1 goutte de bleu de méthylène à la pipette pasteur
Résultat : A = 3,11 à 625 nm → La solution est encore trop concentrée.
- Test 3:
Préparation 3: 200 mL d’eau distillée + 1 goutte de bleu de méthylène à la pipette pasteur.
Résultat : A = 0,242 à 625 nm → La solution n’est pas assez concentrée.
Nous nous sommes ici rendu compte que les gouttes de pipette pasteur n’avaient pas toutes le même volume et faussaient ainsi nos mesures. L’utilisation de la pipette pasteur rendait notre expérience non reproductible, nous avons donc choisi de reprendre nos mesures en utilisant une micropipette allant de 20μL à 200μL
- Test 4 (optimal) :
Préparation 4: 100 mL d’eau distillée + 20 μL de bleu de méthylène à la micro-pipette.
Résultat : A = 1,019 à 625 nm → La concentration est adaptée.
Vérification à λ= 525 nm, A = 0,093.
Nous en déduisons que le bleu de méthylène absorbe très peu dans cette région.
Nous avons personnellement trouvé ce jour là que l’absorbance de 1 était atteinte lorsque le mélange était constitué de 20μL de colorant ainsi que de 100 mL d’eau distillée.
Préparation du Rouge Allura :
- Étalonnage du spectrophotomètre à 525nm
- Verser 50 mL d’eau distillée dans un bécher et quelques gouttes de colorant rouge dans un autre bécher. Nous prélèverons le colorant directement dans ce bécher.
- Ajouter 58 μL de colorant rouge allura et mélanger.
- Mesurer l’absorbance à λ=525 nm et ajuster la concentration du colorant
- Si l’absorbance est inférieure à 1, ajouter des gouttes de colorant de Rouge Allura et, si supérieure, ajouter de l’eau distillée afin d'avoir une absorbance égale à 1
- Réaliser le spectre de la solution de Rouge Allura dans le domaine visible (400-800 nm)
Pour la solution de rouge allura, nous avons directement commencé par des mesures avec une micropipette, ce qui a permis de recommencer l’expérience de manière exacte, sans imprécision sur les gouttes de colorant.
Nous avons fait plusieurs mélanges test avant d’aboutir à une bonne concentration.
- Essai 1 : 50 mL d’eau distillée, 1 mL de colorant
- Résultat: A> 3 -> La solution est trop concentrée
- Essai 2 : 50 mL d’eau distillée, 20 μL de rouge allura
- Résultat: A= 0,741 -> La solution n’est pas assez concentrée
- Essai 3 : 50 mL d’eau distillée, 68 μL de rouge allura
- Résultat: A=1,055 -> La solution est bien concentrée
Préparation des tensioactifs :
- Solution de CTAB
- Dans une coupelle posée sur une balance tarée (de précision p=0.1mg), peser 0.25g de poudre de CTAB
- A l’aide d’un entonnoir à solide, verser la poudre de CTAB dans une fiole jaugée de 50mL
- Rincer l’entonnoir à l’eau distillée afin de minimiser les pertes
- Verser de l’eau distillée jusqu’aux ⅔ de la fiole, reboucher la fiole et secouer délicatement afin d'éviter que de la mousse se forme
- Compléter la fiole jusqu’au trait de jauge à l’eau distillée et secouer légèrement afin que l'entièreté de la poudre soit dissoute
- Solution de SDS
On cherche d'abord à calculer la masse m(SDS) de SDS à prélever:
On sait que :
-
CMC (SDS) = 0.92mM
-
CMC (CTAB) = 8.2mM
-
C (CTAB) = 0.012mol/L
C(SDS)=(CMC(SDS)*C(CTAB))/CMC(CTAB)=(8.2*0.012)/(0.92)=0.12mol/L
m(SDS)=C(SDS)*M(SDS)*Vsol=0.12*288*0.50=1.73g
- Dans une coupelle posée sur une balance tarée (de précision p=0.1mg), peser 1,73g de poudre de SDS
- A l’aide d’un entonnoir à solide, verser la poudre de SDS dans une fiole jaugée de 50mL
- Rincer l’entonnoir à l’eau distillée afin de minimiser les pertes
- Verser de l’eau distillée jusqu’aux ⅔ de la fiole, reboucher la fiole et secouer délicatement afin d'éviter que de la mousse se forme
- Compléter la fiole jusqu’au trait de jauge à l’eau distillée et secouer légèrement afin que l'entièreté de la poudre soit dissoute
Lors de la préparation de SDS, au moment de secouer une première fois (lorsque la fiole est remplie jusqu’aux ⅔), notre mélange a commencé à mousser, nous avons donc utilisé un bain à ultrasons pendant une dizaine de minutes afin de faire retomber les bulles. Nous avons pu compléter par la suite avec de l’eau distillée jusqu’au trait de jauge tout en vérifiant que la totalité de la poudre a bien été dissoute.
A la fin de cette séance, Umberto et Immene se sont occupés de réaliser de petits mélanges des solutions rouge et bleue. Le reste du groupe s’est occupé de faire la vaisselle. Nous avons ainsi remarqué lors des mesures d’absorbance des solutions violettes que le colorant bleu absorbait également en λ= 525 nm, ce qui rend l’absorption en cette longueur d’onde trop haute par rapport à ce que l’on souhaite obtenir. Nous songerons pour la prochaine fois à baisser la concentration de la solution rouge afin d’avoir des absorbances plus proches de 1, pour un mélange avec 50% de rouge et 50% de bleu.
Séance 2 : (Re)préparation des mélanges et premier test,29/09/2025
1- Erreur sur les volumes de tensioactifs
Après avoir remis quelques minutes les deux tensioactifs dans le bain à ultrason pour re dissoudre légèrement les mélanges et les débuller, nous avons pu constater que les liquides dépassaient légèrement le trait de jauge.
Nous avons pu calculer ce volume en plus avec la formule du volume d’un cylindre V=pi*r^(2)*h, avec r=1.3/2 cm et h=0.5cm. Nous obtenons :
V=pi*(1.3/2)^(2)*0.5= 0.66mL, ce volume est négligeable comparé au reste de la solution et ne sera pas problématique pour le reste de l’expérience.
2- Premier test de séparation des colorants:
Pour cette deuxième séance, nos solutions étaient toutes prêtes et nous pouvions commencer. Nous avons donc recommencé nos solutions colorées rapidement et avons pu procéder aux mélanges, composés de 50% de bleu et de 50% de rouge. L’objectif était de préparer deux solutions violettes de 500 mL, dans laquelle nous voulions mettre du SDS d’une part et du CTAB d’autre part. Pour cela, nous avons préparé deux solutions de 500mL de rouge et de bleu. Or, deux problèmes se sont posés lors de cette séance:
Nous nous sommes rendu compte que lorsque nous prélevions le colorant bleu avec la micropipette réglée à 20 μL, nous prélevions en fait 200 μL (en appuyant jusqu’au bout avant de prélever, plutôt que jusque la résistance). Nous avons donc dû refaire la solution initiale de bleu pour s’assurer que l’absorbance à 1 était bel et bien atteinte avec 100mL d’eau et 200 μL de colorant et non plus ou moins, l’erreur n’a pas tant posé de problème. Nous avons donc recalculé les volumes de colorants à prélever pour les grandes solutions colorées. A partir de cela, nous avons pu les préparer :
-une solution rouge de 500mL d’eau distillée à laquelle nous avons ajouté 1,1 mL de colorant rouge. Umberto et Lucas se sont chargés de la faire, dans une burette graduée de 500mL.
-une solution bleue de 500mL d’eau distillée à laquelle nous avons ajouté 4mL de colorant bleu. Immene, Emma et Meryem se sont chargés de la faire dans une burette graduée de 500mL. Nous nous sommes tous rendu compte que la solution bleue avait l’air un peu trop concentrée par rapport à ce qu’elle était sur de petits volumes, mais nous avons continué l’expérience avec.
Nous avons ensuite préparé deux solutions violettes de 500mL en versant 250mL de chaque solution colorée dans deux grands béchers de 800mL. Les mélanges étaient tous deux très bleus, ce qui n’était pas normal.
Par manque de temps, nous avons procédé à l’expérience en ajoutant 5mL de tensioactif dans les deux mélanges et les tuyaux reliés aux pompes à air (que nous avons par la suite actionnées, elles servent à accélérer la réaction de création des bulles). L’absorbance des solutions à 525nm et 625nm ont été prises et étaient nettement au delà de 1, et nous avons lancé le chronomètre afin de prélever des cuves toutes les 2minutes. Pendant qu’Umberto, Lucas et Emma s’occupaient de la réaction, Immene et Meryem ont essayé de trouver l’erreur qui a pu conduire à la solution bleue qui soit si concentrée.
Lors de la réaction, on a pu remarquer qu’une des deux ne moussait pas assez mais avait une assez bonne couleur, l’autre moussait sans problème mais n’avait pas la bonne couleur.
Tous les membres du groupe se sont ensuite chargés de faire la vaisselle.
A noter: il est important de poser les béchers dans une sorte de cuve/boîte où tombera la mousse car cette dernière est très épaisse, tâche beaucoup et a du mal à s’enlever.
Séance 3: Correction des mélanges et test final optimal, 02/10/2025
Pour cette séance, nous avions pour objectif de rattraper le retard prit sur les premières séances au niveau des solutions colorées. Nous avons commencé par régler l’incertitude sur la concentration en colorant bleu à utiliser, survenue à cause de l’erreur de manipulation de la micropipette. Nous avons donc refait nos mélanges sur de petites doses pour nous assurer des concentrations à choisir sur les grandes doses. Dans un bécher de 100mL, nous avons ajouté 50mL d’eau distillée avec 110μL de colorant rouge, puis, nous avons ajouté 50mL d’eau distillée. Notre choix était de procéder par “balayage”: ajouter à la solution que nous venons de faire 20μL de colorant bleu, mesurer son absorbance puis ajuster si pas assez, en prenant bien soin de REMETTRE le contenu de la cuve dans le mélange après chaque mesure d’absorbance. Nous en avons finalement conclu que les concentrations idéales pour le mélange, afin d’avoir une absorbance de 1, étaient de:
-Solution rouge: 50mL d’eau distillée et 110μL de colorant rouge allura
-Solution bleue: 50mL d’eau distillée et 200μL de colorant bleu de méthylène.
Une fois que nous nous sommes tous mis d’accord sur la qualité idéale de ce mélange, nous avons fait un produit en croix afin de trouver le volume à prélever de colorants pour des solutions de 500mL chacun. C’est là que nous nous sommes rendu compte de l’erreur survenue lors de la séance 2:
Il s’agissait d’un quiproquo qui a conduit à une erreur de calcul. En effet, chaque groupe a préparé sa solution bleue ou rouge dont l’absorbance était de 1, donc pour avoir un mélange qui vérifie ABS=1 également, nous devions doubler le volume de colorant introduit OU diviser le volume d’eau distillée utilisé. Une simple erreur de communication a conduit au fait de penser que la solution de bleu (ABS=2) était en fait de 25mL d’eau pour 200μL de colorant, soit DEUX fois la concentration requise. Nous avions donc prélevé 4mL pour le grand mélange (de 500mL) au lieu de 2mL, ce qui explique pourquoi la solution était trop bleue. Après avoir compris notre erreur, nous nous sommes empressés de refaire nos solutions avec les volumes corrects et de lancer l’expérience. Les solutions finales étaient donc les suivantes:
-Solution rouge: 500mL d’eau distillée, 1,1mL de colorant rouge allura
-Solution bleue: 500mL d’eau distillée, 2mL de colorant bleu de méthylène
-Solution violette C: 250mL de solution rouge, 250mL de solution bleue, 5mL de CTAB
-Solution violette S: 250mL de solution rouge, 250mL de solution bleue, 5mL de SDS
Notre début d’expérience ressemblait à cela:
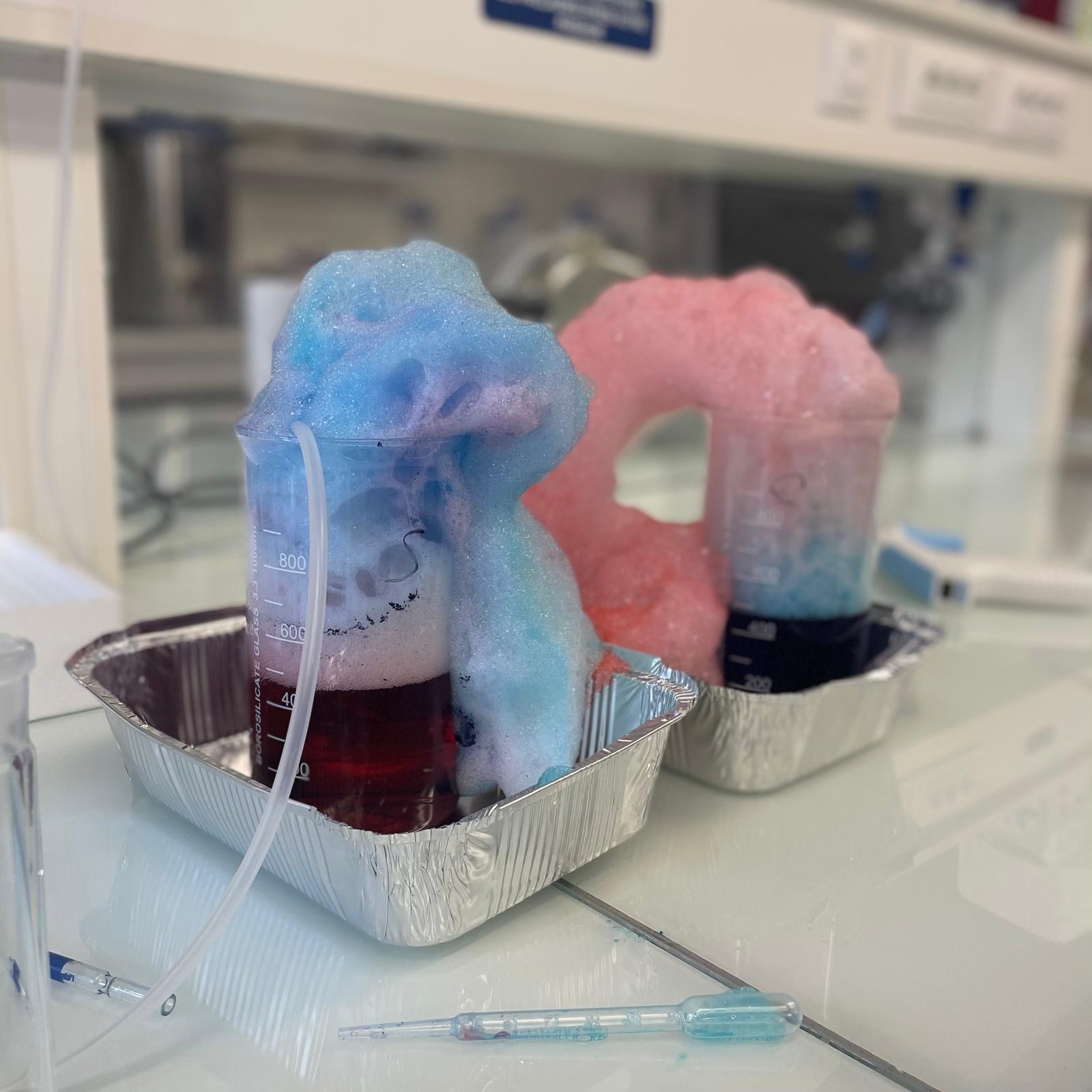
Nous avons d’abord actionné les pompes à air puis, en même temps, ajouté 5mL de tensioactifs dans les béchers (SDS à gauche et CTAB à droite) et actionné le chronomètre (afin de prendre des mesures d’absorbance des solutions toutes les 2 minutes). Au bout de 5 minutes, nous nous sommes rendu compte que la solution dans laquelle nous avons ajouté le SDS ne moussait pas :
Nous avons donc choisi de rajouter 5mL de SDS dans cette solution uniquement. Après cela, le problème était réglé et la solution s’est mise à mousser correctement :
Avant les dernières mesures d’absorbance, nous avons doublé la concentration de tensioactifs dans les solutions, nous avons donc rajouté 10mL de SDS dans la solution de gauche et 5mL de CTAB dans la solution de droite :
Notre expérience s’est réalisée à merveille, nous avons pu séparer les deux solutions colorées. La vaisselle a été réalisée pendant l’expérience, nous n’avions plus qu’à nettoyer les béchers et jeter la mousse. Les absorbances de chaque prélèvement ont été re-mesurées par précaution et nous avons pu tracer nos spectres d’absorbance sur le domaine visible pour les solutions colorées et le mélange.
Séance 4: Nettoyage de la vaisselle utilisée, 06/10/2025
Notre expérience étant finie, nous nous sommes focalisés sur l’écriture du compte-rendu et de l’oral concernant l’expérience. Lucas s’est chargé de nettoyer la vaisselle utilisée et de jeter les solutions de tensioactifs restantes. Il est ensuite allé rejoindre Emma, Immene et Meryem dans la préparation des comptes rendus oraux et écrits.





No Comments