Séquençage de l'ADN
-
Définition
Le séquençage de l'ADN (acide désoxyribonucléique) consiste à déterminer la succession linéaire des bases A, C, G et T qui composent la structure de l'ADN. Il est intéressant d'avoir la séquence de l'ADN car on a accès à toutes les informations qui la contiennent (Lamoril, J. et al. 2008). On peut
-
Applications
Le séquençage est une technique essentielle avec diverses applications. En médecine, il est utilisé pour diagnostiquer les maladies génétiques et les mutations associées aux cancers, ce qui guide les traitements. En recherche génétique, il aide à comprendre la structure et la fonction des gènes. La pharmacogénomique exploite les variations génétiques pour personnaliser les traitements. Les microbiomes et la génomique environnementale révèlent la diversité génétique des organismes et leur interaction avec leur environnement. Le séquençage de novo permet d'étudier des organismes sans séquence de référence. L'évolution est étudiée en comparant les séquences génétiques entre espèces ou populations. En agronomie, il est utilisé pour améliorer les plantes et les animaux d'élevage. Ces applications illustrent la polyvalence du séquençage dans divers domaines de recherche et de médecine.
-
Historique
Le séquençage de l'ADN est inventé dans la deuxième moitié des années 1970. Deux méthodes sont développées indépendamment, l'une par l'équipe de Walter Gilbert, aux États-Unis, et l'autre par celle de Frederick Sanger (en 1977), au Royaume-Uni, Pour cette découverte, Gilbert et Sanger sont récompensés par le prix Nobel de chimie en 1980.
-
Techniques
Les deux premières techniques sont celle de Maxam-Gilbert et celle de Sanger, Elles étaient décrites en 1977, Il existe aussi d’autres techniques modernes.
Quelques techniques et leurs méthode de fonctionnement :
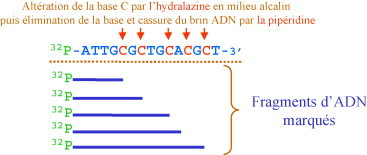
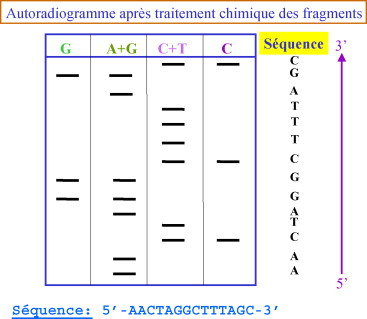
- Technique de Maxam-Gilbert: C’est une méthode chimique de séquençage,Les réactifs clivent spécifiquement après chacune des bases A, C, G, [A + G], [C + T]. Cette technique est basée sur la propriété de certains agents chimiques, l’hydrazine, le diméthyl sulfate (DMS) et l’acide formique, de modifier les bases de l’ADN. Dans un second temps, la pipéridine est ajoutée et « casse » les brins d’ADN au niveau des bases modifiées (Figure-1) . Les agents chimiques sont utilisés dans des conditions telles qu’ils n’agissent qu’avec un faible pourcentage des bases de l’ADN étudié. L’ADN à séquencer est marqué à une extrémité. Le plus souvent, il s’agit d’un marqueur radioactif. Le produit de séquence est déposé sur un gel d’acrylamide, puis la séquence lue après autoradiographie (Figure-2). L’ADN étudié peut être simple ou double brin. Cette technique permettait d’analyser des fragments allant jusqu’à 500 pb.
Figure (1)
Figure (2)
· Technique de Sanger: Elle a en effet rapidement dépassé la méthode de Maxam-Gilbert pour la remplacer et reste à ce jour la principale méthode de séquençage utilisée dans les laboratoires. Son principe est le suivant.
-
Préparation de l'ADN: Tout d'abord, l'ADN à séquencer est préparé. Il peut s'agir d'un fragment d'ADN spécifique ou d'une séquence plus longue.
-
Réaction de polymérisation en chaîne (PCR): Si nécessaire, l'ADN est amplifié par PCR pour obtenir suffisamment de matériel génétique pour l'analyse.
-
Fragmentation de l'ADN: L'ADN est ensuite fragmenté en morceaux de différentes longueurs.
-
Préparation des amorces: Des amorces courtes d'ADN complémentaires à des régions spécifiques de l'ADN à séquencer sont préparées. Ces amorces serviront de points de départ pour la réplication de l'ADN.
-
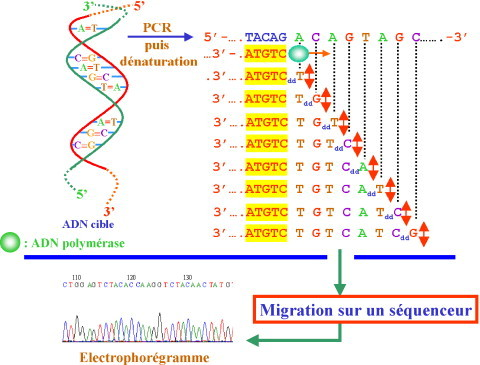
Réaction de séquençage: Dans des tubes à essai séparés, l'ADN fragmenté est combiné avec des amorces, de l'ADN polymérase, des désoxyribonucléotides (dNTP) normaux et des désoxyribonucléotides marqués spécifiquement avec des marqueurs fluorescents de différentes couleurs, un à chaque base (A, T, C, G).
-
Électrophorèse: Les réactions de séquençage sont soumises à une électrophorèse sur gel. Les fragments d'ADN résultants sont séparés en fonction de leur taille, les fragments plus courts se déplaçant plus rapidement que les fragments plus longs. (Figure-3)
-
Lecture de la séquence: Les marqueurs fluorescents sur les fragments d'ADN sont détectés à mesure qu'ils passent à travers le gel. La séquence d'ADN est lue à partir des couleurs des marqueurs fluorescents dans l'ordre dans lequel ils sont détectés.
-
Analyse des données: Les données de séquençage sont ensuite analysées par ordinateur pour assembler la séquence complète et déterminer l'ordre précis des nucléotides dans l'ADN.
Figure (3)
· Technique Shotgun
· Principe de séquençage de grands génomes
· Amplification génome complet / whole genome amplification (WGA)
· Séquençage par hybridation
· Méthode de PCR sur colonies (dite amplification clonale) ou PCR colonies (polony)
· Pyroséquençage
· Séquençage par spectrométrie de masse