Bibliographie et expérimentation
1) Le peroxyde d'hydrogène (H2O2)
Le peroxyde d'hydrogène une molécule d'eau à laquelle on a ajouté un atome d'oxygène, c'est-à-dire l'eau oxygénée. Cette molécule possède quelques caractéristiques qui en font un bon désinfectant : c'est un produit à grand pouvoir oxydant, ce qui le rend très réactif face à la matière organique, et ce qui lui donne un vaste spectre d'activité vis à vis des micro-organismes : il a un bon pouvoir bactéricide, virucide, et même sporicide. on mécanisme d'action consiste en l'oxydation des groupes sulfhydriles et des doubles liaisons des enzymes des bactéries, en provoquant une modification de la conformation des protéines formant ces enzymes, avec la perte de leur fonction, et par conséquent, la mort cellulaire.
2) La luciférase bactérienne et stress oxydatif.
Ce type de réaction nécessite 4 composés : la luciférase bactérienne ; la flavine mononucléotide réduite ou FMNH2 qui sert de luciférine ; un aldéhyde utilisé comme cofacteur RCHO (en biochimie, un cofacteur est une substance chimique non protéique, mais qui est nécessaire à l'activité biologique de celle-ci) ; et l’oxygène moléculaire O2.
La luciférase bactérienne est sensible au stress oxydatif. En relisant la bibliographie, nous acons vu que des concentrations en H2O2 ont été utilisés pour voir l'intensité de la bioluminescence. En effet des concentrations de H2O2 ont été utilisés de 50 µM, 100 µM et 250 µM.
3 ) Protocole Expérimental
Pour réaliser cette expérience, j'ai lancé 5 cultures bactériennes avec 200µL de la suspension mère de bactérie bioluminescente et 10mL de milieu classique. J'ai transféré 2mL de cette culture dans des cuves de spectro. J'ai ensuite fait des mesures de DO de cette culture au bout de 1h d'incubation.
Après la lecture de la DO j'ai ajouté le H202 aux concentrations voulus dans les cuves. j'ai préalablement dilué au 1/1000ème dans un erlenmeyer pour avoir une concentration de 8,79mM. Puis j'ai ajouté 11µL, 22µL et 55µL dans les cuves de spectro pour être à 50µM, 100µM et 250µM. et j'ai mesuré les DO toutes les heures.
| DO Témoin 1 | DO témoin 2 | DO avec 50µM | DO avec100µM | DO avec 250µM |
| DO 1h= 0,091 | DO 1h= 0,071 | DO 1h= 0,081 | DO 1h= 0,087 | DO 1h= 0,086 |
| DO 2h= 0,100 | DO 2h= 0,095 | DO 2h= 0,093 | DO 2h= 0,090 | DO 2h= 0,087 |
| DO 3h= / | DO 3h= / | DO 3h= / | DO 3h= / | DO 3h= / |
| DO 4h= 0,163 | DO 4h= 0,161 | DO 4h= 0,161 | DO 4h= 0,158 | DO 4h= 0,143 |
| DO 5h= 0,252 | DO 5h= 0,246 | DO 5h= 0,234 | DO 5h= 0,229 | DO 5h= 0,207 |
| DO 6h= 0,362 | DO 6h= 0,364 | DO 6h= 0,341 | DO 6h= 0,326 | DO 6h= 0,301 |
| DO 7h= 0,475 | DO 7h= 0,466 | DO 7h= 0,46 | DO 7h= 0,45 | DO 7h= 0,433 |
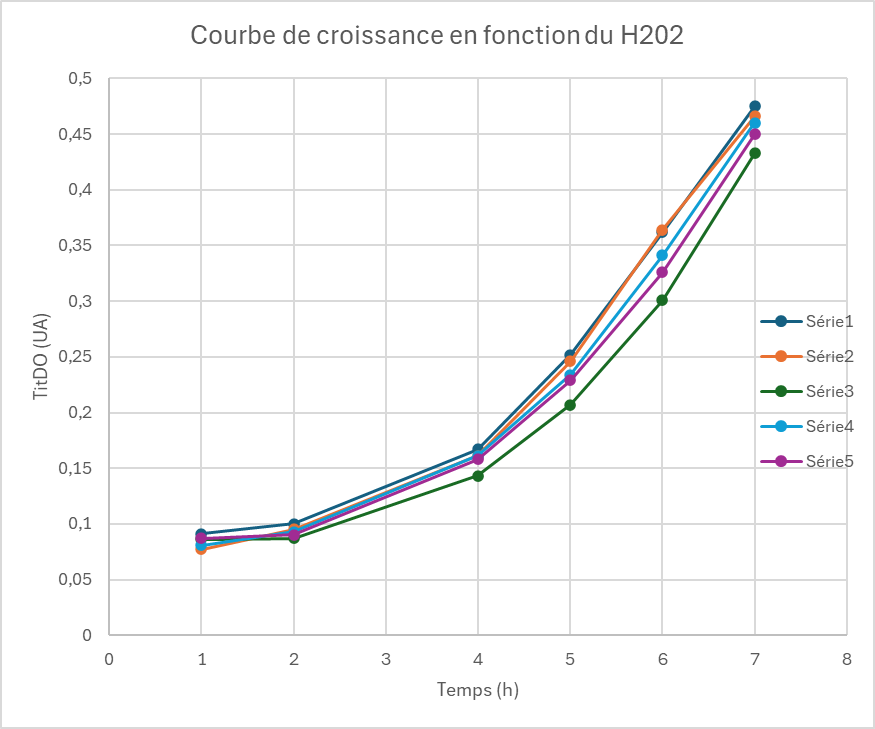
Série 1: Témoin sans H202 Série 2 : Témoin sans H202 Série 3: 50µM de H202 Série 4 : 100µM de H202 Série 5: 250 µM de H202
On observe que le H202 a une influence sur la croissance de la bactérie. En effet, la DO baisse en fonction de la concentration du H2O2. A ces concentrations, le H2O2 ne tue pas la bactérie mais ralenti sa croissance. Cependant, nous n'avons pas observé de différences sur la bioluminescence de la bactérie. Je pense que l'enzyme a besoin d'un cofacteur (FMN) pour pouvoir réagir à l'oxyfation du H2O2. C'est une réaction d'oxydo-réduction.


No Comments