Bouillon Tomates
Rania MADANI : rania.madani@etu.sorbonne-universite.fr
Wiki Projet : Valorisation des Peaux de Tomates
Présentation du Projet
Ce projet vise à valoriser les peaux de tomates, un sous-produit agroalimentaire abondant, en développant un bouillon en poudre fonctionnel destiné à des usages culinaires (soupes et sauces). Ce travail s’inscrit dans une démarche d’économie circulaire et met en lumière l'importance de transformer des résidus en produits à haute valeur ajoutée.
Objectifs
- Réduire le gaspillage alimentaire en valorisant les peaux de tomates.
- Comparer deux procédés de déshydratation : à 50°C (déshydrateur) et à 100°C (four).
- Optimiser la préservation des composés bioactifs, tels que le lycopène et le β-carotène.
- Proposer une alternative durable et naturelle aux bouillons industriels.
Matériel Utilisé
- Matières Premières :
- 1 kg de tomates grappes récupérées (sources locales).
- Équipements :
- Déshydrateur électrique : XUEII2.
- Four classique (température réglable à 100°C).
- Mixeur Moulinex pour broyage.
- Tamis (granulométrie de 100 µm).
- Spectrophotomètre UV-Vis (analyse à 472 nm et 450 nm).
- pH-mètre.
Étapes et Journal de Bord
9 janvier 2025 : Préparation des échantillons
- Activité :
- Découpe et tri des tomates (séparation des peaux, pulpes, et cœurs).
- Lavage minutieux à l’eau déminéralisée pour retirer les contaminants.
- Lancement des procédés de déshydratation :
- Déshydrateur : Température de 50°C, cycle initial de 6 heures.
En plus des tomates, des carottes ont également été préparées et soumises au même protocole de déshydratation pour une analyse comparative. Cependant, cela s'est avéré peu pertinent pour l’objectif principal du projet, et cette piste n’a pas été approfondie.
10 janvier 2025 : Déshydratation et broyage
- Activité :
- Déshydrateur : Ajout d’un second cycle de 4 heures à 50°C pour compléter le séchage.
- Four : Température de 100°C, durée de 2 heures.
- Broyage des échantillons déshydratés en poudre fine à l’aide du mixeur Moulinex.
- Uniformisation de la granulométrie avec un tamis (100 µm).
- Déshydrateur : Ajout d’un second cycle de 4 heures à 50°C pour compléter le séchage.
13 janvier 2025 : Première tentative d’analyse des caroténoïdes
- Activité :
- Mise en place du protocole d’extraction avec de l’hexane pur pour mesurer le lycopène et le β-carotène.
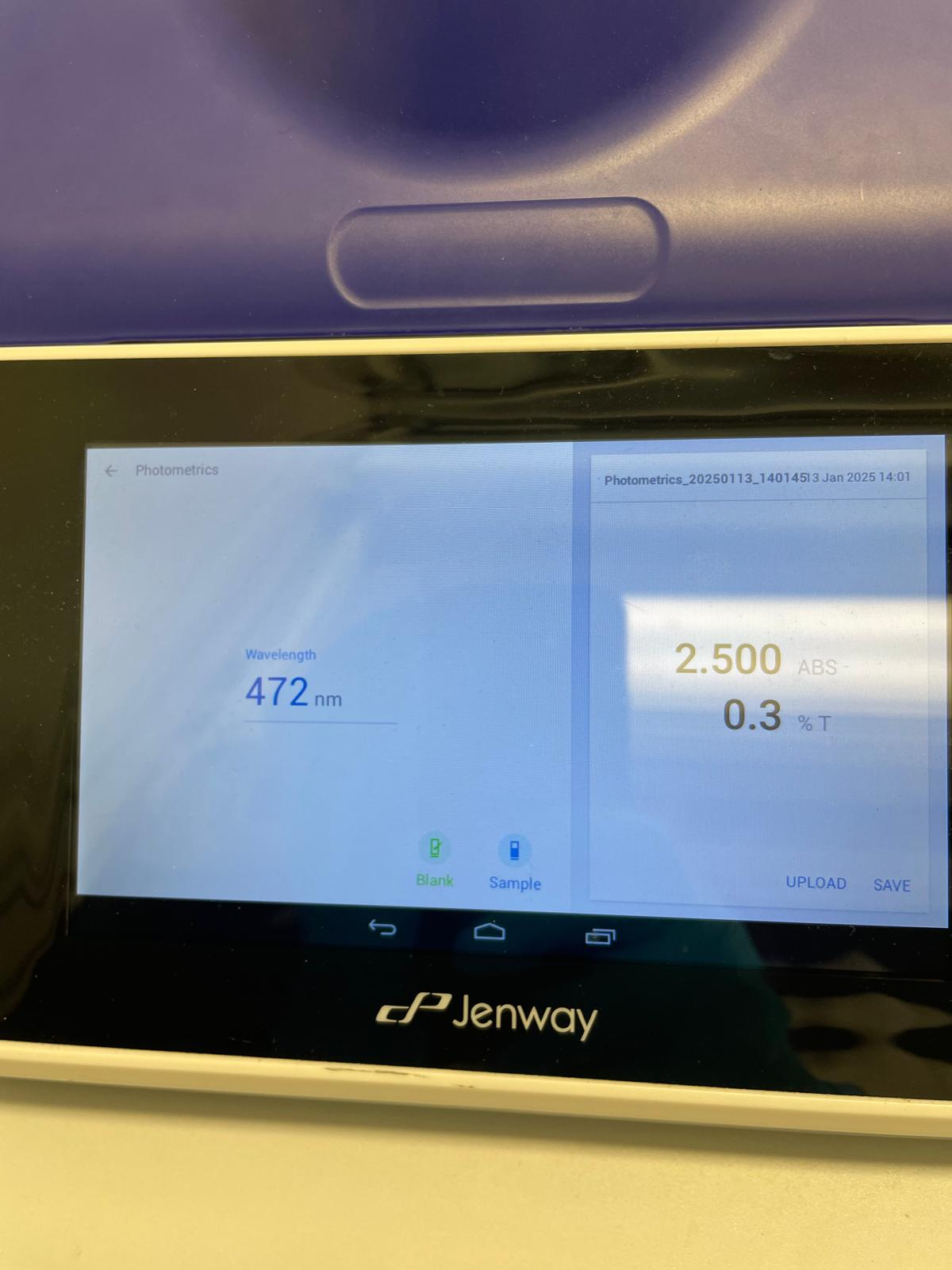
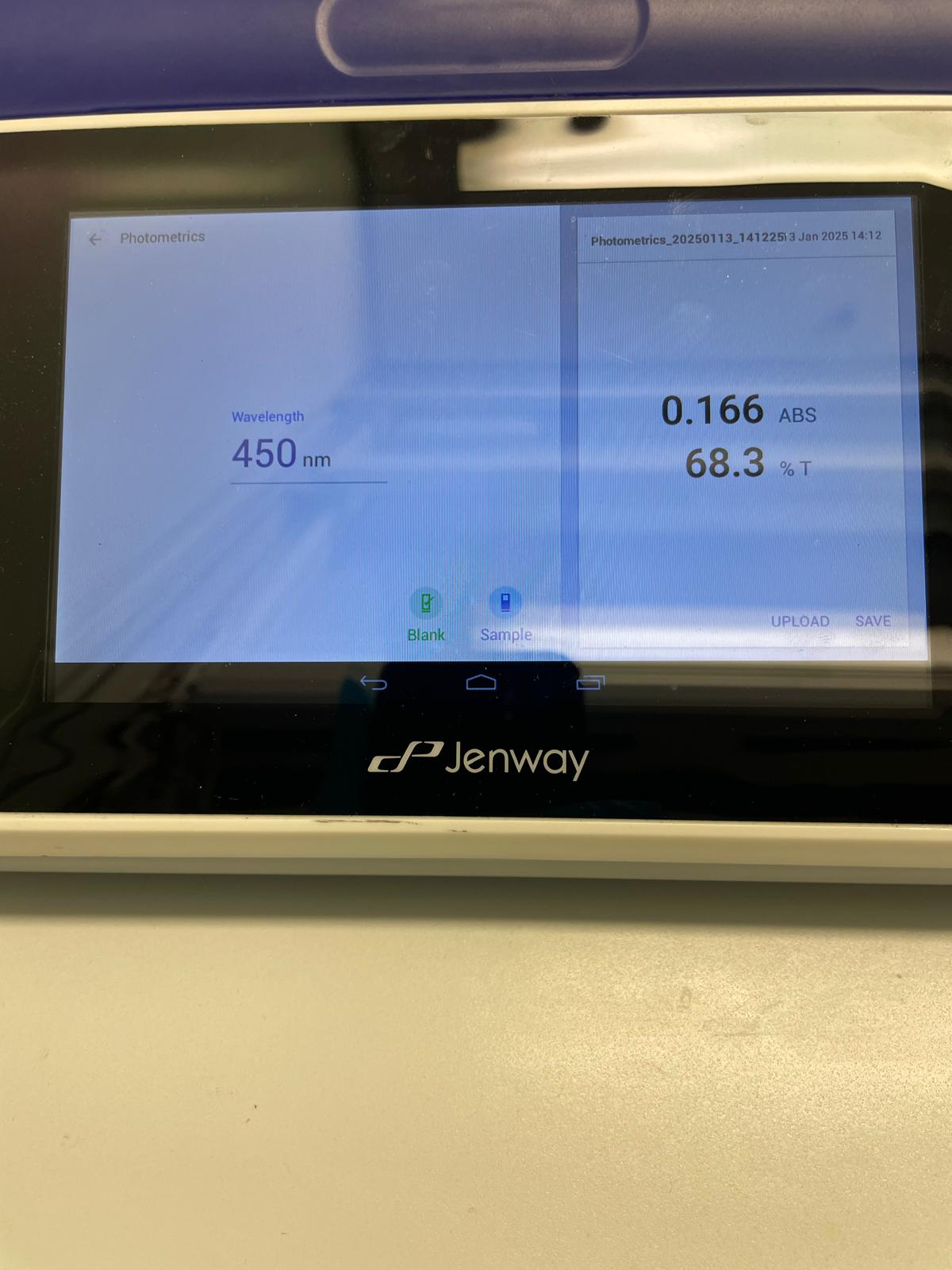
- Analyse au spectrophotomètre UV-Vis à 472 nm (lycopène) et 450 nm (β-carotène).
- Résultat : Échec des mesures initiales, erreurs possibles dans le protocole.
14 janvier 2025 : Reprise des analyses
- Activité :
- Ajustement du protocole d’extraction pour améliorer les résultats. (Résultats attendus!)
- Nouvelle analyse au spectrophotomètre pour quantifier le lycopène et le β-carotène.
- Résultat : Données cohérentes obtenues.
15 janvier 2025 : Analyse de l’humidité et du pH
- Activité :
- Mesure de l’humidité résiduelle des échantillons séchés à 105°C jusqu’à masse constante.
- Analyse du pH après dilution des échantillons dans l’eau distillée.
- Résultat :
- Taux d’humidité < 10 % pour les échantillons au déshydrateur.
- pH stable entre 4,25 et 4,33.
Protocole : Extraction et Mesure du Lycopène et du β-Carotène
Objectif :
Extraire et quantifier les caroténoïdes (lycopène et β-carotène) à partir d’échantillons de tomates séchées, en suivant une méthode inspirée d'Aremu (2017).
Matériel Nécessaire :
- Échantillons :
- Poudre fine obtenue à partir des échantillons séchés (peaux, pulpe, cœur ou mélange).
- Réactifs :
- Hexane pur 10mL
- Hexane pur 10mL
- Équipements :
- Bécher (50 mL).
- Spectrophotomètre UV-Vis.
- Cuvettes en quartz (1 cm de trajet optique).
Protocole :
Étape 1 : Préparation des Échantillons
- Peser 0,05 g de poudre d’échantillon dans un bécher de 50 mL.
Étape 2 : Extraction
- Préparation du solvant :
- Mesurer 10 mL d'hexane.
- Extraction :
- Ajouter l'hexane à l'échantillon pesé.
- Bien agiter pendant 5 minutes à température ambiante pour extraire les caroténoïdes.
- Laisser reposer environ 5 minutes pour permettre à la phase organique (contenant les caroténoïdes) de se séparer.
- Récupération de la phase organique :
- Prélever à l'aide d'une pipette la phase supérieure (hexane contenant les caroténoïdes) pour verser dans la cuve qui passe au spectrophotomètre.
Étape 3 : Analyse Spectrophotométrique
- Mesure au spectrophotomètre :
- Mesurer l’absorbance de l’extrait à :
- 472 nm pour le lycopène.
- 450 nm pour le β-carotène.
- Utiliser de l’hexane pur comme blanc.
- Mesurer l’absorbance de l’extrait à :
Résultats attendus :
|
Échantillon |
Absorbance à 472 nm (Lycopène) |
Absorbance à 450 nm (β-Carotène) |
|
Pulpe + cœur (50°C) |
~0.8 à 1.0 |
~0.4 à 0.6 |
|
Peaux (50°C) |
~1.0 à 1.2 |
~0.6 à 0.8 |
|
Mélange (100°C) |
~0.1 à 0.2 |
~0.05 à 0.1 |
Résultats
- Comparaison des Procédés de Déshydratation :
- Déshydrateur (50°C) : Meilleure conservation des composés bioactifs.
- Four (100°C) : Dégradation marquée des caroténoïdes (lycopène et β-carotène).
- Conservation des Nutriments :
- Lycopène : 1,029 (déshydrateur) contre 0,136 (four).
- β-carotène : 0,759 (déshydrateur) contre 0,095 (four).
- Analyse physico-chimique :
- Humidité résiduelle : < 10 % (déshydrateur).
- pH : Entre 4,25 et 4,33, favorable à la conservation.
Limites et Perspectives
- Limites :
- Absence d’analyses microbiologiques.
- Manque d’évaluations sensorielles.
- Variabilité dans la qualité des tomates utilisées.
- Perspectives :
- Explorer des températures intermédiaires pour le séchage.
- Effectuer des analyses microbiologiques pour valider la sécurité du produit.
- Étudier des applications industrielles (cosmétiques, nutraceutiques).
Photos :
10/01/25
13/01/25
14/01/25 :
15/01/25 :
Bibliographie
-
Aremu, S. O. (2017). Determination of vitamin A content from selected Nigerian fruits using spectrophotometric method. Food Chemistry, 235, 61–67. https://doi.org/10.1016/j.foodchem.2017.05.018
-
Barros, L., Ferreira, M. J., Carvalho, A. M., & Ferreira, I. C. (2014). Antioxidant activity and bioactive compounds of caper (Capparis spinosa L.) berries. Food Chemistry, 149, 631–637. https://doi.org/10.1016/j.foodchem.2013.11.107
-
Dewanto, V., Wu, X., Adom, K. K., & Liu, R. H. (2002). Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity. Journal of Agricultural and Food Chemistry, 50(10), 3010–3014. https://doi.org/10.1021/jf0115589
-
Fish, W. W., Perkins-Veazie, P., & Collins, J. K. (2002). A quantitative assay for lycopene that utilizes reduced volumes of organic solvents. Journal of Food Composition and Analysis, 15(3), 309–317. https://doi.org/10.1006/jfca.2002.1075
-
Gupta, S., Cox, S., & Abu-Ghannam, N. (2021). Effect of different drying techniques on the bioactive and volatile compounds of tomato peels. Journal of Food Processing and Preservation, 45(10), e15699. https://doi.org/10.1111/jfpp.15699
-
Jay, J. M., Loessner, M. J., & Golden, D. A. (2005). Modern Food Microbiology (7th ed.). Springer. https://doi.org/10.1007/978-1-4615-4427-5
-
Lavelli, V., Giovanelli, G., & Peri, C. (2013). Stabilization of tomato skins by dehydration or hot air drying for industrial exploitation. Journal of Food Engineering, 116(4), 539–547. https://doi.org/10.1016/j.jfoodeng.2013.01.005
-
Raiola, A., Rigano, M. M., Calafiore, R., Frusciante, L., & Barone, A. (2014). Enhancing the health-promoting effects of tomato fruit for biofortified food. Mediators of Inflammation, 2014, 1–16. https://doi.org/10.1155/2014/139873
-
Strati, I. F., & Oreopoulou, V. (2014). Effect of extraction parameters on the carotenoid recovery from tomato waste. International Journal of Food Science & Technology, 49(5), 1102–1108. https://doi.org/10.1111/ijfs.12413
-
Ventura, M., Tavares, M., & Fernandes, T. (2020). Optimization of drying processes for preservation of antioxidants in tomato waste. Drying Technology, 38(14), 1793–1803. https://doi.org/10.1080/07373937.2020.1714008
-
Zhang, Y., Liu, Y., Wang, X., & Song, F. (2023). Protective effects of lycopene against UV-induced skin damage. Journal of Dermatological Science, 112(2), 99–106. https://doi.org/10.1016/j.jdermsci.2022.11.003











No Comments