Arbre de Diane
L'arbre de diane sert à représenter les différentes étapes ou réactions chimiques d'une manière visuelle. Il montre comment une réaction peut mener à d'autres réactions ou produits, comme un arbre avec plusieurs branches qui se divisent à chaque étape. Cela permet de mieux comprendre les processus chimiques complexes.
Protocole:
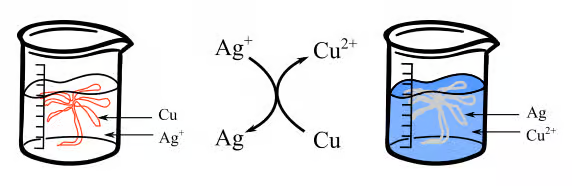
Pour réaliser le protocole, nous allons plonger 1 fil de cuivre torsadé en forme d'arbre dans 200 ml de solution de nitrate d'argent de concentration 0.1 mol/L et suivre l'évolution du système et l'apparition de l'argent. On obtient un bel « arbre de Diane » au bout de 25 minutes.
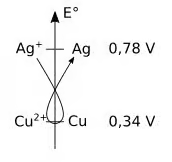
Le moteur thermodynamique de la réaction provient de la différence de potentiel entre les couples d'oxydo-réduction, différence qui peut être mise en évidence par la « règle du gamma » sur un axe représentant le potentiel standard.
Les demi-équations d'oxydo-réduction s'écrivent :
Oxydation du cuivre :
Réduction de l'argent :
Réaction totale :
La constante d'équilibre de cette réaction s'exprime :
À l'équilibre, le potentiel de la solution peut s'écrire avec la relation de Nernst associée aux deux couples d'oxydo-réduction présents en solution :
1ère expérience
Une solution de 30ml de nitrate d'argent à une concentration de 0,001mol /L

Au bout de quelques jours, nous pouvons voir une petite réaction au bout du fil mais celle-là ne tient pas sur l'arbre. Une couleur très légèrement bleu, visible uniquement à certains angles, apparait
On calcul ensuite la masse de AgNO3 à dissoudre en sachant que la masse molaire de AgNO3 est de 169,87 g/mol
m = n x M = 0,003 mol x 169, 87 g/mol = 0,5096 g
Pour obtenir 30ml de solution de nitrate d'argent à une concentration de 0,1mol/L , il faut donc dissoudre 0,51g de nitrate d'argent dans l'eau.
Ici, nous voulons tester pour deux fil de cuivre différents, nous avons donc besoin de deux solutions
Résultats:
Au bout de 1h , on a pu voir une petite réaction au bout du fil pour le premier fil de cuivre , cependant nous n'obtenons d'arborescence autour du fil. La couleur bleu n'apparait pas également. Pour le deuxième fil, il n 'y a pas de réaction au bout de 1h.
La première proposition est donc d'attendre quelques jours pour voir si la couleur bleu du cuivre se forme car nous supposons qu'il s'agit d'une réaction qui ne se fait pas immédiatement. En effet, grâce à la première expérience avec une concentration à 0,001mol/L , nous avons supposé que la couleur bleu apparaissait au bout de quelques jours .
Deuxième proposition, comme nous avons remarqué une réaction au bout du fil lorsqu'on a augmenté la concentration à 0,1 mol/ L , nous avons essayé de gratter le revêtement du fil du premier cuivre et voir si cela déclencherai la réaction dans une solution de nitrate d'argent à 0,1 mol/L
Résultats : un composé de couleur noir apparait bien autour du fil du cuivre dès que l'on plonge le fil . Le composé évolue petit à petit en passant du gris au blanc. La couleur bleu apparait également progressivement.
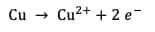
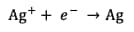
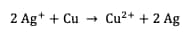
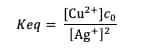
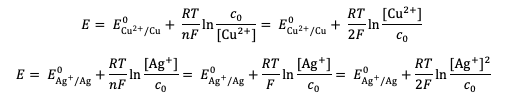



No Comments