Electrophorèse
I - Introduction :
L’électrophorèse - technique de séparation des molécules chargées sous l'effet d'un champ électrique appliqué par deux électrodes (négative et positive)
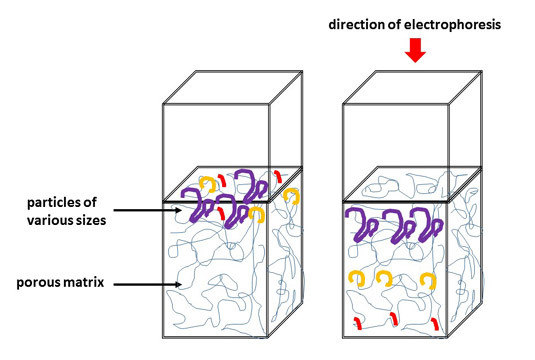
L'électrophorèse sur gel est une technique de laboratoire utilisée en biologie moléculaire et biochimie pour séparer des extraits contenant de l’ADN, de l’ARN et des protéines en fonction de leur taille et de leur poids moléculaire.
Matériel utilisé :
- Cuve d'électrophorèse avec un peigne (pour l'électrophorèse horizontal)
- Kits Western Blot (pour l'électrophorèse verticale) voir lien
- Tampon de migration
- Agarose ou polyacrylamide
- Balance de précision
- ErlenMeyer
- Marqueur de poids moléculaires (DNA Ladder)
- Tampon de charge
- UV (visualisation)
II - Électrophorèse horizontale de l'ADN sur gel d'agarose
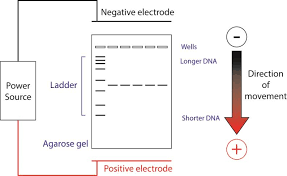
L’électrophorèse horizontale sur gel est une méthode utilisée dans la séparation de l’ADN. Une extrémité contient une anode et l’autre une cathode. L'ADN, en étant chargé négativement, migre vers l’électrode positif selon sa taille et son poids moléculaire.
Figure 1 : principe de l'électrophorèse horizontale
Préparation d’un gel d’agarose 1%
1. Pesez 1 g d'agarose et mettez dans l’Erlenmeyer-150ml. Ajoutez 100 ml de tampon (TBE) (on peut placer le 2ème ErlenMeyer-25ml comme un bouchon dans l’ErlenMeyer-150ml)
2. Chauffez au four micro-ondes jusqu’à la dissolution complète de l’agarose. Mélangez de temps en temps.
ATTENTION : Très chaud ! Portez des gants de protection !
3. Laissez reposer le gel à température ambiante durant 10 min.
4. Assemblez le plateau avec un peigne de 19 puits et coulez le gel.
5. Ajoutez de l'intercalant de l'ADN (par exemple Atlas ClearSight DNA Stain) et mélangez.
ATTENTION : L'intercalant de l'ADN est un composé toxique ! Portez des gants !
6. Coulez le gel et laissez polymériser au moins 30 min.
7. Ajoutez le tampon de charge (TpC)
8. Retirez le peigne du gel, placez le plateau avec le gel dans la cuve de migration. Mettez le tampon de migration (par exemple TBE-0.5x) dans la cuve pour couvrir le gel.
9. Déposez les échantillons sur le gel.
10. Lancez la migration : 100 V, 60 min.
11. Observez l’ADN sous la lampe à UV
12. Utilisez le DNA Ladder afin de repérer la quantité relative de l'ADN
Figure 2 : exemple du DNA Ladder (1 kb) - marquer du poids moléculaire
Figure 3 : cuve pour électrophorèse avec un peigne de 19 puits (ouverte - gauche; fermée - droite)
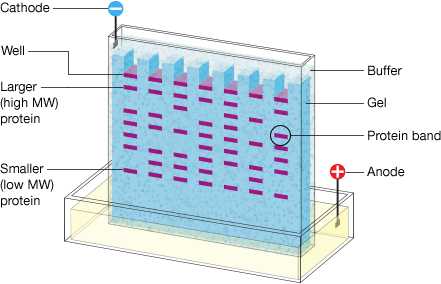
III - Électrophorèse verticale des protéines sur gel de polyacrylamide SDS-PAGE
L'électrophorèse des protéines sert à la quantification relative des protéines à partir d'un extrait suite à la séparation des protéines sur gel. La séparation s'effectue en fonction de la masse moléculaire. On peut effectuer l'électrophorèse PAGE en conditions non-dénaturantes (Poly-Acrylamide Gel Electrophoresis) mais également SDS-PAGE en conditions dénaturantes (Sodium Dodecylsulfate-PAGE).
Pour SDS-PAGE : Les protéines sont dénaturées dans un tampon de charge (tampon laemmli) contenant du
SDS (charge négativement les protéines en les déroulant) et un réducteur (β‐mercaptoéthanol ou
DTT) qui détruit les ponts disulfures. Les protéines, alors chargées négativement, migrent dans le
gel de polyacrylamide sous l'effet du champ électrique, en fonction de leur poids moléculaire apparent
*On pourrait éventuellement utiliser le gel d'agarose mais en raison de la taille plus petite des pores du gel de polyacrylamide, une séparation plus précise peut être obtenue
Figure 4 : principe de l'électrophorèse verticale
Les étapes principales
- Préparation des échantillons. Dénaturation des protéines par SDS et la réduction des ponts disulfures par un réducteur.
- Préparation de la cuve d’électrophorèse et du gel (Adapter la cassette de gel dans son support)
- Remplissage de la cuve. Remplir le compartiment intérieur (entre la cassette de gel et la plaque de barrage) et le compartiment principal avec du tampon de migration
- Dépôt des échantillons sur le gel
- Mise en route de l’électrophorèse
Figure 5 : Exemple de la migration des protéines sur gel
Cas pratique : Fabrication d'un gel de polyacrylamide et migration de protéines
-
Préparation d'un gel de polyacrylamide (1H30) :
Pour un gel de 0,75mm d'épaisseur
Matériel :
- Lames 0,75mm
- Support à lames
- Propipettes
- Tubes falcon ou bécher
- Glace
- Éprouvette graduée
- Pipette pasteur
- Peigne adapté à la largeur des lames
| SOLUTIONS MÈRES |
GEL DE SÉPARATION |
GEL DE CONCENTRATION |
| (1) Acrylamide/bis-acryl 40% |
1,9 mL (7,5%) |
0,5 mL (4,0%) |
| (2) Tris-HCL 1,5M pH 8,8 |
2,5 mL (0,375M) |
X |
| (3) Tris-HCL 0,5M pH 6,8 | X |
1,25 mL (0,125M) |
| (4) SDS 10% |
100 µL (0,1%) |
50 µL (0,1%) |
| (5) H2O distillée |
5,4 mL |
3,15 mL |
| (6) APS 10% |
100 µL (0,1%) |
50 µL (0,1%) |
| (7) TEMED |
10 µL |
5 µL |
Protocole :
- Préparer les deux gels séparément en introduisant dans un tube falcon les réactifs (1), (2), (4) et (5) pour le gel de séparation et les réactifs (1), (3), (4) et (5) dans un autre tube pour le gel de concentration.
- Préparer les lames en les insérant dans leur support en en faisant une marque à 5cm de hauteur
- Vérifier l'étanchéité du montage en introduisant de l'eau distillée, puis vider et sécher
- Mettre le tube du gel de séparation dans la glace (pour ralentir la polymérisation) et y ajouter le TEMED et l'APS
- Mélanger délicatement en retournant le tube (!! Ne pas agiter pour éviter qu'il ne se forme trop de bulles !!).
- Remplir de gel de séparation à hauteur de la marque en versant doucement sur les bords (tapoter pour équilibrer le niveau et faire remonter de potentielles bulles)
- Ajouter très délicatement une fine couche d'isopropanol ou d'eau distillée
- Laisser prendre pendant 30min (+ ou -)
- Bien rincer délicatement à l'eau distillée et égoutter
- Placer le tube de gel de concentration dans la glace et ajouter TEMED et APS
- Couler le gel de la même manière que le premier jusqu'à ras bord.
- Insérer le peigne et remuer jusqu'à ce qu'il n'y ait plus de bulles ( !! Bien porter des lunettes pour se protéger dans projections !! )
- Attendre 30 min
Ne pas détacher les plaques de verre avant la fin de la migration
-
Migration de protéines
Préparation du tampon de migration
Notre tampon était déjà préparé en 5X (qu'on a dilué en 1X). Pour autant, voici sa composition :
| SOLUTIONS MÈRES | TAMPON DE MIGRATION 1X |
| Tris / Glycine 10X |
300 mL (1X) |
| SDS 20% | 4 mL (0,1%) |
| Eau distillée |
3L |
Migration
La première étape consiste à préparer la cuve :
- Placer le gel sur un support. Si il y a plus d'emplacement que de gel par support, bien prévoir d'utiliser un "fantôme" pour assurer la conduction du courant.
- Remplir la cuve au tiers de son volume de tampon 1X et attendre quelques minutes que le gel en absorbe.
- Continuer à remplir la cuve progressivement en laissant reposer le chaque fois. S'arrêter un fois que la hauteur des puits est dépassée (y aller doucement pour éviter les bulles) mais ne pas monter trop haut.
Il faut ensuite centrifuger le marqueur et les échantillons puis les déposer en alternance dans les puits (on commence au bord par la marqueur, puis protéines, marqueur...)
Enfin, brancher la cuve au générateur (120V) et faire migrer pour environ 1H



No Comments