Western Blot
Introduction
Le Western Blot également connu sous le nom d'immunoblot, est une technique de biologie moléculaire largement utilisée pour détecter et analyser spécifiquement des protéines dans un échantillon biologique. Cette méthode combine électrophorèse sur gel pour séparer les protéines en fonction de leur poids moléculaire et l’immunomarquage pour détecter les protéines d’intérêt a l'aide d'anticorps spécifiques.
Principes de fonctionnement
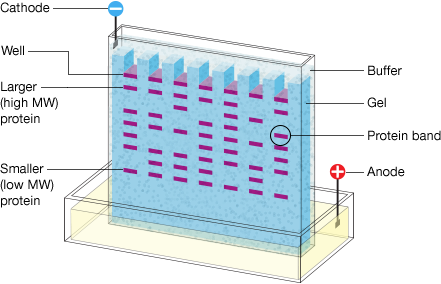
- Électrophorèse sur gel:
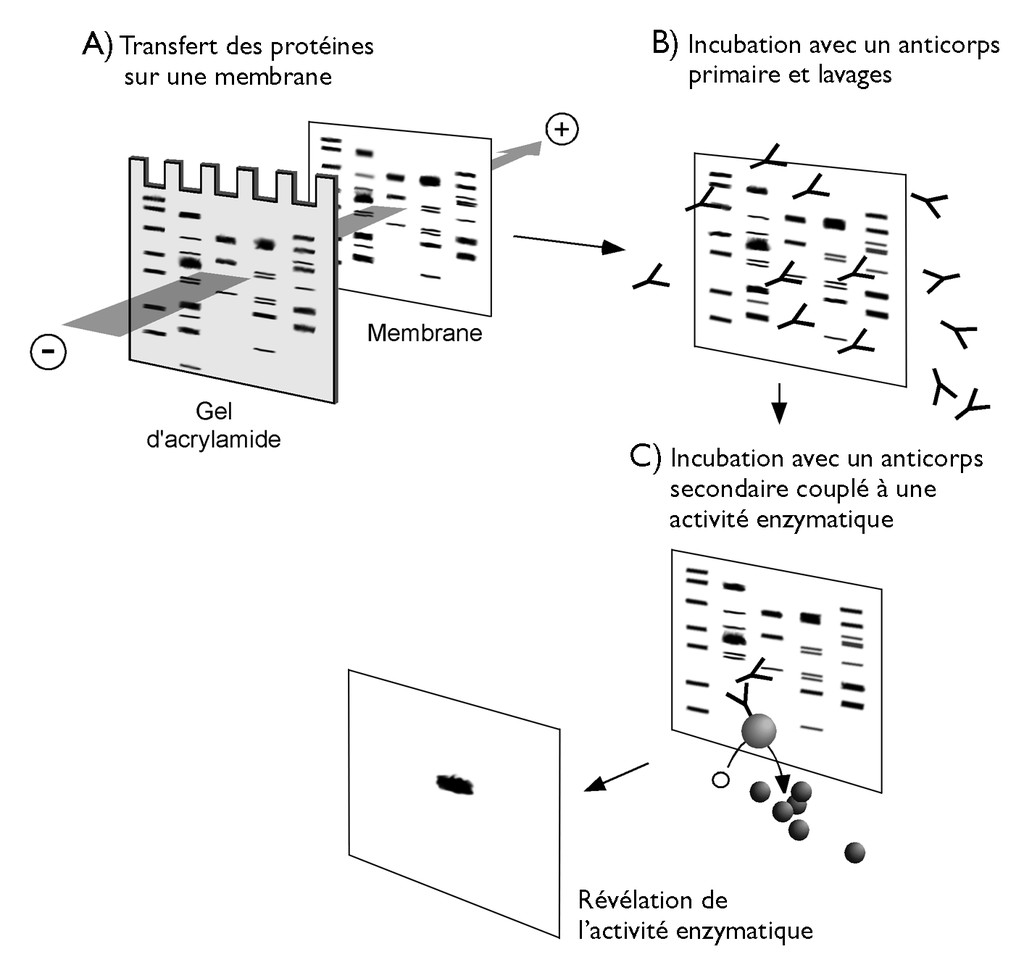
Les protéines sont séparées en fonction de leur taille sur un gel de polyacrylamide sous l'influence d'un champ électrique. Les protéines plus petites migrent plus rapidement a travers le gel que les protéines plus grandes. - Transfert sur membrane:
Après l'électrophorèse, les protéines sont transférées du gel sur une membrane de nitrocellulose ou PVDF. Ce transfert permet de fixer les protéines sur la membrane pour une détection ultérieure. - Détection des protéines:
La membrane est incubée avec des anticorps primaires spécifiques de la protéine ciblée, suivis d'anticorps secondaires conjugués à des enzymes ou des fluorophores. L’interaction entre les anticorps et les protéines cibles permet leur détection par des méthodes de visualisation telles que la luminescence ou la coloration.
Applications
- Analyse de l'expression protéique:
Le Western Blot permet de quantifier les niveaux d'expression des protéines dans différents types de cellules ou de tissus, offrant ainsi des informations sur la régulation génique et les voies de signalisation cellulaires. - Identification des isoformes:
Cette technique peut être utilisée pour distinguer les différentes isoformes ou formes post-traductionnelles d'une protéine en fonction de leur taille et de leur réactivité avec des anticorps spécifiques. - Détection et modification post-traductionnelles:
Le Western Blot peut être utilisé pour détecter des modifications telles que la phosphorylation, la glycosylation des protéines, fournissant ainsi des informations sur leur régulation et leur fonction. - Diagnostique médicale:
Cette méthode est largement utilisée en diagnostic médical pour détecter la présence de protéines spécifiques associées à des maladies, telles que les marqueurs tumoraux dans le cancer.
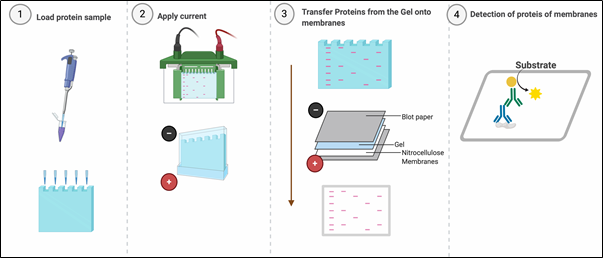
Méthodologie
I. Préparation des échantillons
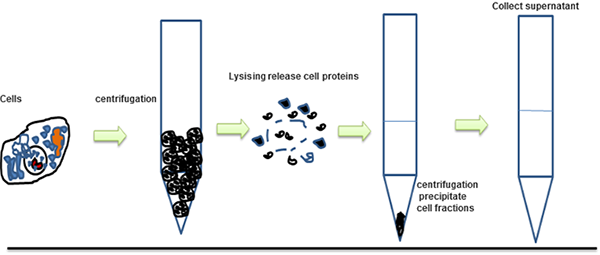
Extraction des protéines:
- Lyser les cellules ou les tissus dans un tampon de lyse approprié contenant des inhibiteurs de protéases.
- Centrifuger à haute vitesse pour éliminer les débris cellulaires.
Quantification des protéines:
- Utiliser une méthode de dosage des protéines telles que le dosage colorimétrique de Bradford ou le dosage BCA.
Préparation des échantillons:
- Charger une quantité égale de protéines (généralement 20-40 µg) par échantillon dans un tampon de chargement contenant un agent réducteur et un agent tensioactif.
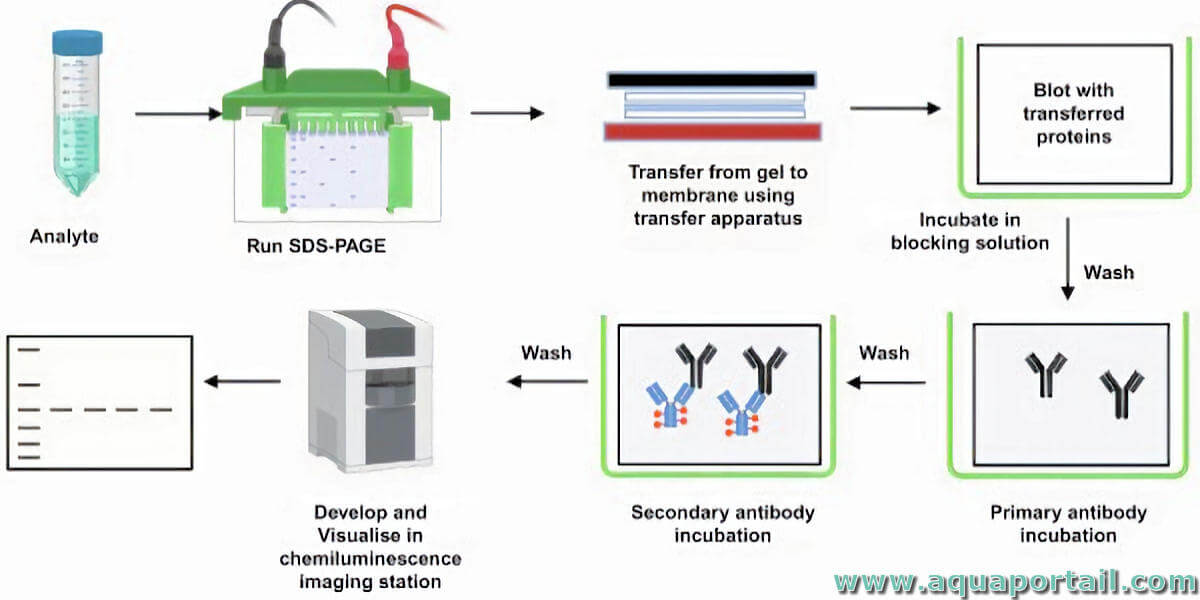
II. Électrophorèse sur gel
Préparation des gels :
- Préparer des gels de polyacrylamide de la concentration appropriée (généralement 8-15%) selon le poids moléculaire attendu des protéines cibles.
- Réaliser une électrophorèse en conditions réductrices.
Chargement des échantillons :
- Charger les échantillons dans les puits du gel en utilisant des pipettes à gel appropriées.
Électrophorèse :
- Faire fonctionner les gels à une tension constante jusqu'à ce que les protéines soient séparées selon leur poids moléculaire.
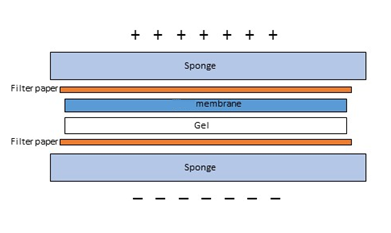
III. Transfert sur membrane
Équilibration du gel:
- Trempage dans une solution d'équilibre contenant du SDS pour dénaturer les protéines.
Transfert électrophorétique:
- Transférer les protéines du gel sur une membrane de nitrocellulose ou PVDF en utilisant une électrophorèse semi-sèche ou humide.
Validation du transfert:
- Vérifier l'efficacité du transfert en marquant la membrane avec une coloration protéique comme le Ponceau S.
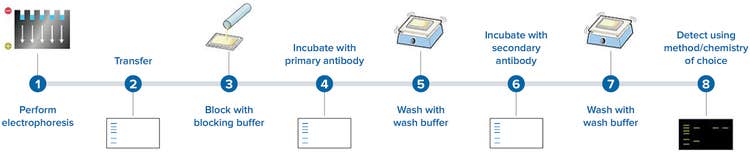
IV. Blocage et incubation avec les anticorps
Blocage non spécifique:
- Incuber la membrane dans une solution de blocage (par exemple, lait écrémé ou BSA) pour saturer les sites non spécifiques.
Incubation avec les anticorps primaires:
- Incuber la membrane avec l'anticorps primaire spécifique de la protéine cible à une concentration appropriée et dans des conditions optimales.
Lavage:
- Laver la membrane pour éliminer les anticorps non liés.
V. Détection des protéines
Incubation avec les anticorps secondaires:
- Incuber la membrane avec un anticorps secondaire conjugué à une enzyme ou un fluorophore.
Développement:
- Révéler les protéines cibles en utilisant un substrat chromogène ou luminescent pour l'enzyme conjuguée.
Imagerie:
- Capturer les images des protéines révélées à l'aide d'un système d'imagerie approprié comme une caméra CCD.
VI. Analyse et interprétation des résultats
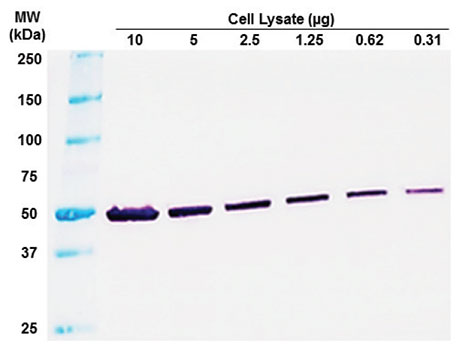
Quantification:
- Analyser l'intensité des bandes protéiques pour quantifier l'expression relative des protéines cibles.
Contrôle de charge:
- Utiliser des marques de poids moléculaire pour estimer les tailles des protéines cibles.
Analyse des données:
- Utiliser un logiciel d'imagerie pour analyser les données et comparer les niveaux d'expression des protéines entre les échantillons.
Remarque: Assurez-vous de suivre les protocoles de sécurité appropriés lors de la manipulation des produits chimiques et des échantillons biologiques
Conclusion
Le Western Blot est une technique puissante permettant la détection et la quantification des protéines spécifiques dans un échantillon biologique. Une bonne planification expérimentale, une manipulation précise des échantillons et une interprétation appropriée des résultats sont essentielles pour obtenir des données fiables et significatives.
No Comments