Mise au point milieu de culture bioluminescence
Informations
- Alan KERNANEC, Steve HUBERT
- alan.kernanec@sorbonne-universite.fr ; steve.hubert@sorbonne-universite.fr
- FabManagers espace Biologie/Chimie
- 10/2023
Contexte
Afin de tenter de réduire le coût de revient d'un milieu de culture spécifique à une souche de bactérie bioluminescent nous avons cherché à optimiser la quantité des certains constituants.
La 1ère publication du protocole de culture datant des années 1910 (La Vie et la Lumière ; Raphaël Dubois ; Félix Alcan Paris, 1914), certains produits sont disponibles avec un niveau de pureté non accessible à l'époque qui justifie de nouveaux essais.
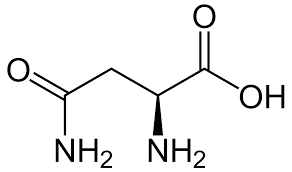
Nous nous sommes penchés en particulier sur un acide aminé de ce milieu qui représente à lui seul près de la moitié du coût final : l'asparagine.
Objectifs
Tester des milieux à différentes concentrations décroissantes d'aparagine pour déterminer jusqu'où il est possible de réduire tout en maintenant la bioluminescence optimum.
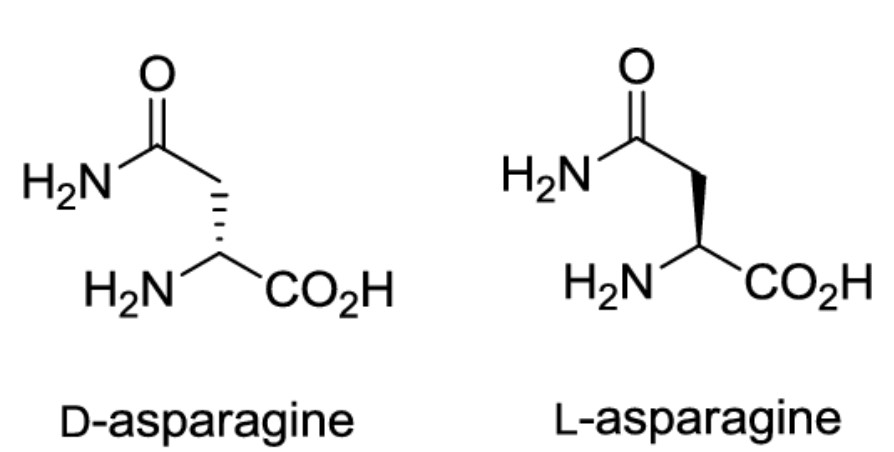
En réalité il est probable que seule la L-asparagine soit utilisable par les organismes bioluminescents, la D-asparagine restant inutilisée dans le milieu.
Or dans les années 1910 si l'asparagine était déjà disponible avec un très bon niveau de pureté, il n'est pas précisé si la différence était faite entre ses deux formes enantiomères. L'optimisation peut être envisagée de ce côté.
Consommables
- souche de cellules bioluminescente
- yeast exctract (0,75g)
- glycérol (0,75mL)
- asparagine (1g)
- NaCl (7,5g)
- eau distillée 250 mL
- divers (aluminium, coupelles de pesée, anses...)
Matériel et Machines utilisés
- erlenmeyer de 25 mL (x14), erlenmeyer 250 mL (x2)
- autoclave de paillasse (cycle 121°C/20min)
- balance de précision
- papier pH
- pipetman 200µL, 1000µL
Protocole
Nous allons tester 4 concentrations différentes soit de 4 séries de triplicats (12 échantillons) suivis sur 48h.
1/Préparation et stérilisation de 2 solutions-mères :
-1 erlenmeyer contenant 100 mL à 10g.L-1 de L-asparagine
-1 erlenmeyer contenant 150mL à 0g.L-1 de L-asparaigne
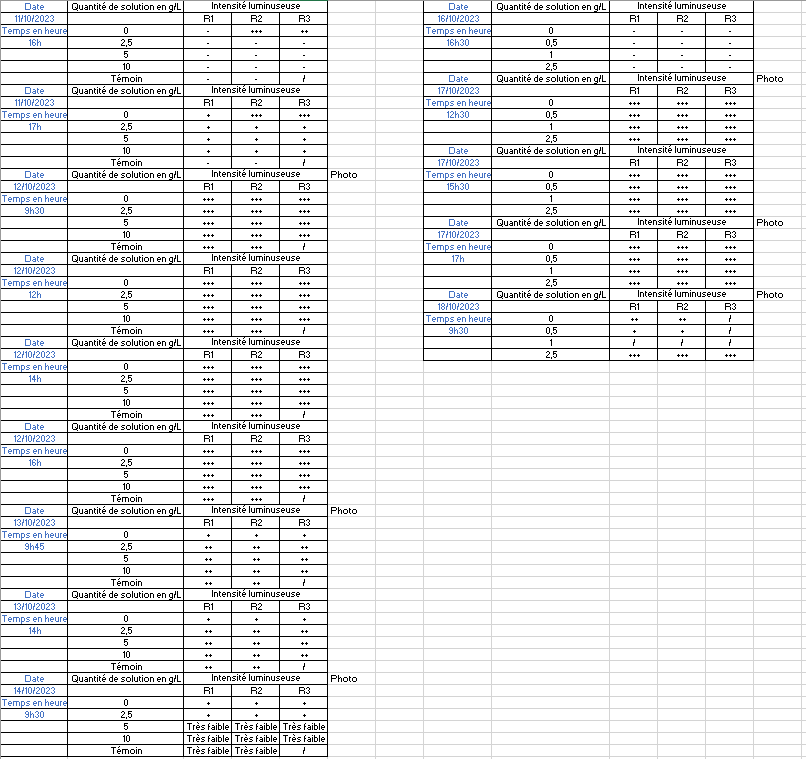
Observation :
Avec les concentrations de 0 ; 2,5 ; 5 ; 10 et 2 témoins
| Date | 12/10/23 à 9h30 | 13/10/23 à 9h45 | 14/10/23 à 9h30 |
 |
 |
Par la suite, nous avons fait un autre dosage avec les concentration de 0 ; 0,5 ; 1 et 2,5
| Date | 17/10/23 à 12h30 | 17/10/23 à 17h | 18/10/23 à 9h30 |
Résultats :







No Comments