Arbre de Diane
L'arbre de diane sert à représenter les différentes étapes ou réactions chimiques d'une manière visuelle. Il montre comment une réaction peut mener à d'autres réactions ou produits, comme un arbre avec plusieurs branches qui se divisent à chaque étape. Cela permet de mieux comprendre les processus chimiques complexes.
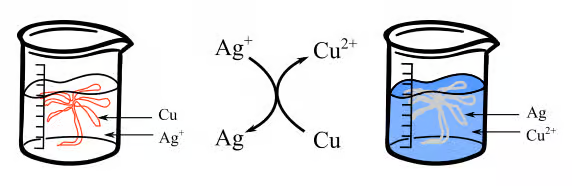
Dans cette réaction, on étudier le transfert d'électron entre le fil de cuivre métallique et les ions argent.
Protocole:
Pour réaliser le protocole, nous allons plonger 1 fil de cuivre torsadé en forme d'arbre dans 200 ml de solution de nitrate d'argent de concentration 0.1 mol/L et suivre l'évolution du système et l'apparition de l'argent. On obtient un bel « arbre de Diane » au bout de 25 minutes.
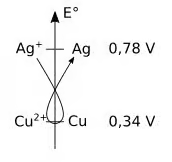
Le moteur thermodynamique de la réaction provient de la différence de potentiel entre les couples d'oxydo-réduction, différence qui peut être mise en évidence par la « règle du gamma » sur un axe représentant le potentiel standard.
Les demi-équations d'oxydo-réduction s'écrivent :
Oxydation du cuivre :
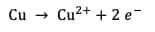
Réduction de l'argent :
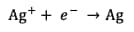
Réaction totale :
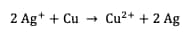
La constante d'équilibre de cette réaction s'exprime :
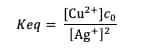
À l'équilibre, le potentiel de la solution peut s'écrire avec la relation de Nernst associée aux deux couples d'oxydo-réduction présents en solution :
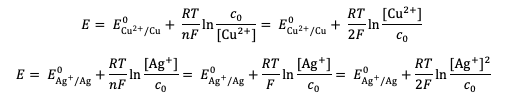
Pour ce faire nous avons besoin :
- D'un fil (ruban de cuivre)
- D'un erlenmeyer de 50mL
- D'une solution de nitrate d'argent
On utilise une solution dilué donc la réaction prendra plus de temps. On la laisse pour voir ce que ça va donner
Pour cette réaction on peut écrire : Cu(s) + 2Ag+(aq) --> Cu2+ + 2Ag(s)
- On verse un volume V=30mL de solution de nitrate d'argent dans un erlenmeyer (Ag+ +NO3-)
- On fait tremper notre ruban de cuivre dans la solution ( la solution est initialement incolore)
- La solution devient bleu petit à petit et on remarque la présence de précipité grisâtre
Résultats: Au bout de quelques jours, nous pouvons voir une petite réaction au bout du fil mais celle-là ne tient pas sur l'arbre. Une couleur très légèrement bleu, visible uniquement à certains angles, apparait
(Expérience en à refaire et photo à modifier)


No Comments