Création d'un dispositif d'électroporation sur puce pour la Biofonderie SU
fivos.pham@etu.sorbonne-universite.fr - printemps 2024 - UMS Biofonderie Alliance Sorbonne Université / UAR 2037 CNRS
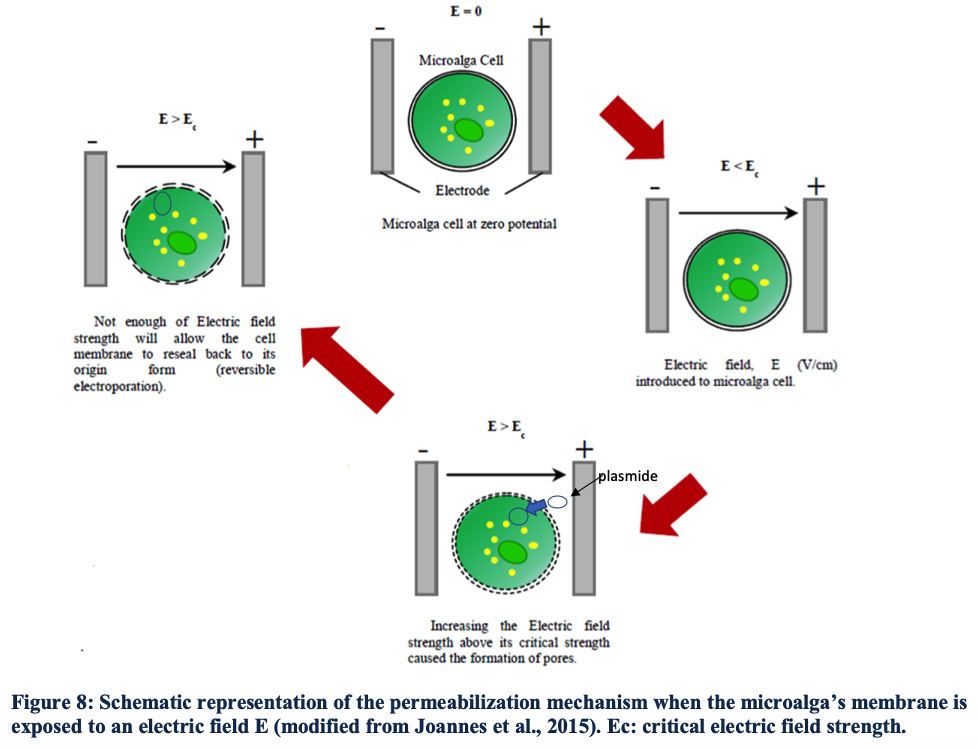
Dans le cadre de mon stage court à la biofonderie de Sorbonne Université, j'est été chargé de designer, fabriquer et tester un dispositif d'éléctroporation (fig1) microfluidique qui permettra de transformer simultanément un éventail de plasmides. On pourra ainsi créer de nombreuses souches ingénieurées de l'espèce Chlamydomonas reinhardtii avec des séquences différentes, en grand nombre et rapidement. L'appareil sera dans une biofonderie qui est une plateforme automatisée de biologie synthétique(2). Il devra donc être utilisable par des manipulateurs robotiques(fig2.).
fig1. Principe de l'électroporation fig2. robot pipeteur Hamilton avec pinces
1ère étape : fabriquer le PCB
Pour la compatibilité avec le matière biologique, le circuit d'électrodes sera en or. Comme la commande auprès d'un fabriquant français n'est pas encore arrivé, je vais tester plusieurs méthodes pour fabriquer un prototype en cuivre.
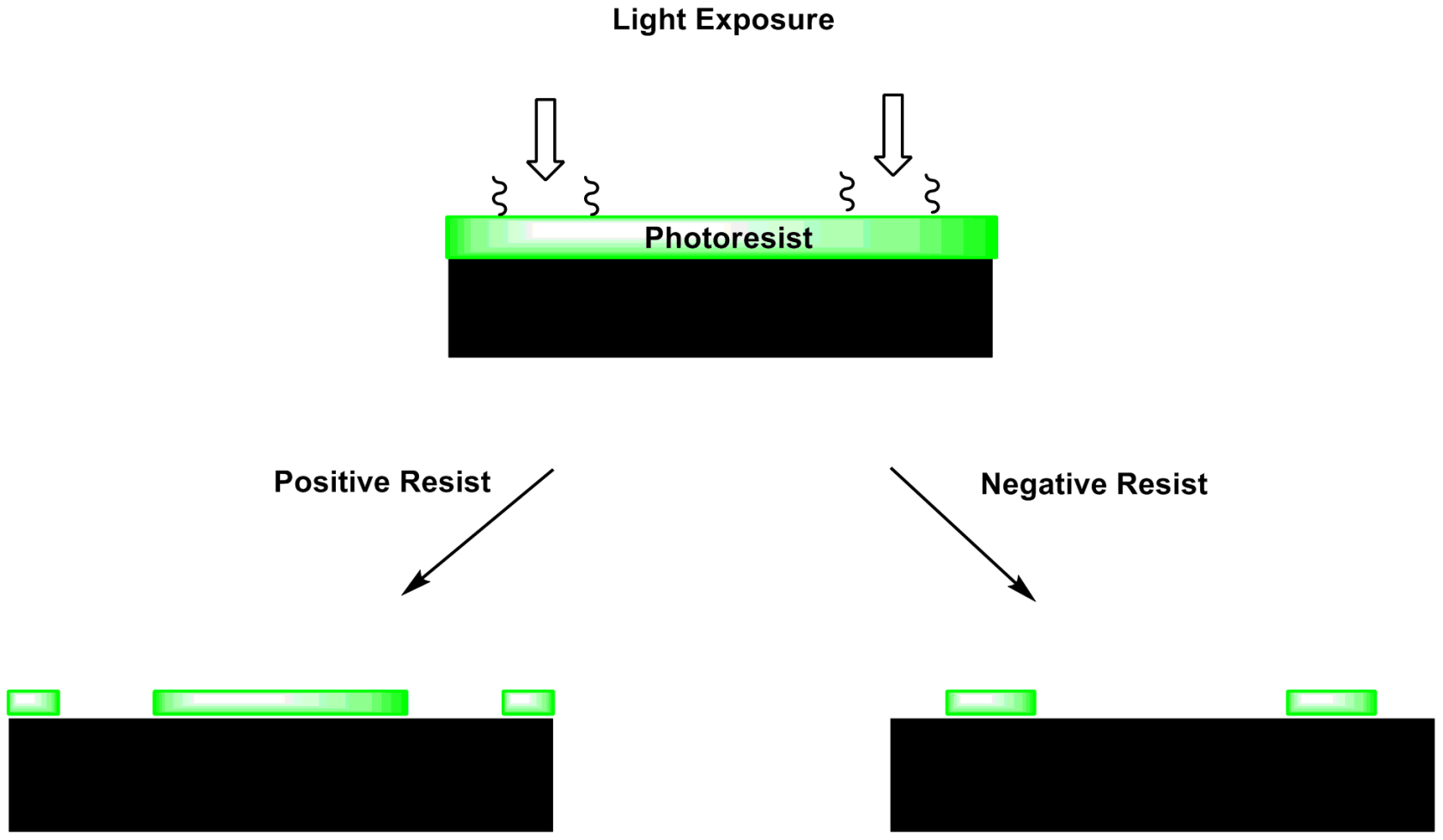
- Par photopolymérisation
Reprise de la technique testée par Steve : https://fablab.sorbonne-universite.fr/actualites-fablab/detourner-une-imprimante-resine-pour-fabriquer-un-circuit-electronique
qui consiste à imprimer la forme du circuit en résine directement sur une plaque de cuivre, puis de dissoudre la couche de cuivre partout où il n'y a pas de résine polymérisée.
fig3. Principe des résines photosensibles fig4. imprimante résine détourné en insoleuse
Pour la solution destiné à dissoudre le cuivre découvert, j'ai utilisé du perchlorate de fer, mais également une solution plus agressive (HCl + H2O2). Avec agitation continue, j'ai eu de bon résultats avec les deux, mais le temps d'action est différents (beaucoup plus long pour le perchlorate de fer) et il ne faut pas trop tarder au risque de dissoudre le cuivre sous la résine et de détruire les pistes.
fig4. électrodes protégées par la résine avant etching fig5. etching réalisé sous hotte chimique impérativement
J'ai également envisagé la technique testée par René : https://wiki.fablab.sorbonne-universite.fr/BookStack/books/petits-projets/page/impression-3d-electrochimique-realisation-dun-reseau-delectrodes qui consiste à retirer par gravure laser (sur la TROTEC) la couche conductrice en dehors du circuit voulu. Mais il faut trouver les bons paramètres de puissances.
On m'a également proposé de suivre une formation sur la LPKF, machine de microfabrication professionnelle, mais comme nous avons finalement reçu les 5 PCB commandés, je n'ai plus eu à continuer sur la fabrication de PCB. C'était néanmoins une expérience très enrichissante.
2ème étape : fabriquer les supports
Le support de la plaque d'électrode aura les même dimensions qu'une plaque 96 puits standard en vue de sa manipulation automatisée (voir fig2 plus haut).
Dans l'idéal, le support doit être dans un matériau non-conducteur et résistant à 120°C et 2 bar pour qu'il puisse s'autoclaver avec le PCB et être réutilisable. Pour l'instant les prototypes sont fait en PLA mais nous avons pensé au PP, au PEI ou à des résines thermo-résistantes.
3ème étape : tests
fig.9 fig10. fig11.
Pour réaliser une électroporation avec un taux de transformation et de survie optimal, de nombreuses pistes à explorer subsistent :
fig.9 : Quel est le volume de goutte optimal pour une électroporation sans dépasser de la piste?
fig.10 : Effet de l’ajout d’éthanol : changement de la tension superficielle
Il pourra être intéressant d’ajouter un tensioactif miscible et bio-compatible pour avoir une plus grande surface de contact, comme des protéines surfactantes par exemple.
fig.11 : Comment les champs électromagnétiques sont-ils distribués dans la goutte?
Est-ce optimal? Faut-il rajouter des ions? Quel sont les effets thermiques (effet Joule) et cela a-t-il un impact sur la survie après électroporation? Une simulation électromagnétique devrait être envisagée, ainsi qu'un film avec caméra thermique par exemple.
Comment est-ce que les Chlamydomonas sont distribués dans les gouttes?
De manière homogène? Ceci sous toutes les conditions (froid, vibrations...)? À partir de combien de temps tombent t’elles au fond? Faut-il utiliser des souches sans flagelles pour une électroporation plus efficace? Un balayage en microscopie confocale pourrait être intéressant.


No Comments